一种高效的莱茵衣藻电转化方法
刘 佳,何炫程,项 晨,马伯宁,韦航涛,杨明峰
(北京农学院 生物科学与工程学院,农业部华北都市农业重点实验室,北京 102206)
目前藻类的研究正在日益深入,其药性价值与保健功效正成为人们研究的热点[4]。与此同时藻类的转基因技术也取得了较大的进展,已经出现了越来越多关于转基因藻类的成功案例,如秦松[5]等将GUS基因导入褐藻细胞,吕玉民[6]等用基因枪法将bar基因导入杜氏盐藻其中,其中将基因导入原核藻类比较容易成功,而真核藻类的则相对较少。关于藻类转化的方法目前有基因枪法、玻璃珠法、电转化法等,而电转化法由于简单快捷、费用低廉等特点,具有明显的优势[7]。在藻类转化方法研究中,常用到的报告基因有绿色荧光蛋白基因、荧光素酶基因、氯霉素乙酰转移酶基因、硝酸还原酶基因和葡萄糖苷酸酶基因等,此类方法可鉴之处是结果可用肉眼观测,具有操作方便且基因易于检测的优点,因此在藻类的转基因试验中应用比较广泛。耿秋贵[8]强调若想让外源基因导入就需要有相对较强的场强和较长的电击时间,但这会使细胞死亡率大大增加,最终影响到转化率。
藻类高效的转化系统必须满足[9]转化率必须较高、导入的基因必须灵敏表达、转化后的细胞可以正常培养。尽管莱茵衣藻是目前研究转基因技术的一种良好材料,但仍存在转化率不高的问题。为了寻求莱茵衣藻较好的转化条件,研究以莱茵衣藻野生型WT和无细胞壁突变体CC425为材料,利用电击法进行转化,探索较为合适的抗生素筛选浓度、电击场强和电击时间,以提高衣藻的电击转化效率,为莱茵衣藻的进一步开发和利用提供技术支持。
1 材料与方法
1.1 试验材料
莱茵衣藻材料野生型WT和细胞壁缺失突变型CC425是由首都师范大学胡勇副教授惠赠。研究所用pChalic-2ATG-GFP与pChlalic-4CL-3a-STS质粒为实验室保存,载体带有抗性基因(aphVIII)。所用质粒在E.coliDH5α中培养扩增,采用质粒提取试剂盒提取质粒,质粒的浓度用紫外分光光度仪测定。
细菌培养以LB培养基为基本培养基,莱茵衣藻以TAP培养基培养。
1.2 试验方法
1.2.1 药品及精密仪器 磷酸缓冲液、微量元素、氨苄青霉素(ampicillin,Amp)储液、巴龙霉素(paromomycin,Par)储液、鲑鱼精(Salmon sperm)DNA储液。
使用的仪器有Eppendorf AG 22331PCR仪,DYY-6C核酸电泳仪、水平电泳槽,Delta320数字式pH计,KL-211GZ恒温光照培养摇床,TH2-312恒温培养摇床,Mettler toledo AL204精密电子天平,赛福SFG-02.500超净工作台,WD-9403C紫外可见光光度计,AlphaImager HP电泳图像分析系统,贝克曼冷冻离心机和Leica激光扫描共聚焦显微镜。
1.2.2 引物序列 根据4CL-3a-STS设计特异性引物,引物序列:4-3-S F 5′-TTGGAGGTACGACCGAGATGGC-3′,4-3-S R 5′-GGATGGCC GATTTCGCTGAT-3′。所有引物在北京睿博生物公司合成。
在小学数学教学中,很多教师认为要想打好小学生的数学基础,就应该重视知识的传授,牢记数学知识点,这样才能为后期教学奠定良好的基础,即便在记忆中容易产生遗忘,但通过反复巩固依旧可以达到教学的效果。在这一教学理念下,很多的教师并不重视实践活动课教学,甚至直接忽略了这一流程,影响了小学数学实践课程教学的效果。
1.2.3 质粒提取 参照康为世纪生物科技有限公司高纯度质粒小提试剂盒说明书上的具体步骤操作,进行质粒pChalic-2ATG-GFP和pChlalic-4CL-3a-STS的提取。
1.2.4 莱茵衣藻遗传转化 莱茵衣藻在TAP液体培养基中于25 ℃左右,以光/暗(12 h/12 h)周期进行光照培养。莱茵衣藻培养至对数生长期(OD750=0.6)时收集藻体,冰浴10 min,然后加入10 % Tween-20(1∶2 000v/v)。4 ℃下800 g离心5 min。去上清,将沉淀重新悬浮于含20 mM甘露醇与20 mM山梨醇TAP液体培养基中,重新培养至对数生长期。取250 μL莱茵衣藻悬浮细胞于无菌离心管中,加入环形质粒(终质量浓度10 μg/mL藻悬浮细胞)、鲑鱼精DNA(终质量浓度200 μg/mL)。混匀,冰浴10 min。之后加入到无菌的电转杯中进行电转化。电压为1 600 V/cm,脉冲时间为1 ms。电击结束后,加入到新的无菌离心管中,培养于1 mL TAP非选择培养基中,25 ℃水浴恢复培养5 min。之后在25 ℃左右、12 h/12 h的光/暗周期条件下进行光照培养48 h。取莱茵衣藻悬液涂布于TAP固体培养基上(含5 μg/mL Par),进行光照培养,7 d见菌落。挑取单克隆于TAP液体培养基中做2次筛选。
1.2.5 莱茵衣藻总DNA提取 利用CTAB法提取植物基因组DNA:收集0.1~0.2 g新鲜藻体,置于预冷的研钵中,加液氮研磨成细粉。将细粉加入到65 ℃预热的3 mL 2 % CTAB提取缓冲液(1.4 mol/L NaCl,20 mmol/L EDTA,2 % CTAB,100 mmol/L Tris-HCl,pH 8.0)中,轻轻混匀,65 ℃保温30 min。待冷却至室温后离心,吸取上清至一新的离心管中,加入等体积的氯仿/异戊醇(24∶1),轻轻混匀后,室温静置10 min,10 000 r/m离心10 min。重复上一步2~3次。将上清转入另一干净离心管中,加入2/3体积的异丙醇,轻缓地颠倒混匀,-40 ℃放置10 min后,10 000 r/min离心10 min。弃上清,加入1 mL 70 %乙醇将沉淀转移至1.5 mL离心管中,洗涤2~3次。沉淀室温下放置10 min,微干后,溶于500~700 μL ddH2O中。加入等体积的氯仿/异戊醇抽提1~3次。上清液加入1/5体积的1.4 mol/L NaCl,混匀后,加入2倍体积的无水乙醇,-20 ℃放置30 min后,12 000 r/min离心10 min。弃上清,沉淀用70 %乙醇洗涤2~3次,待其自然干燥后,溶于50~100 μL ddH2O中。取2 μL的 DNA进行琼脂糖凝胶电泳检测。
1.2.6 莱茵衣藻总RNA提取 参照奥莱博植物提取试剂盒说明书,进行莱茵衣藻总RNA的提取。
1.2.7 反转录,cDNA第一条链合成 提取的总RNA用全式金反转录试剂盒TransScript First-Strand cDNA Synthesis Supermix,将RNA反转成cDNA。
1.2.8 目的片段的获取 以上述经反转录得来的cDNA为模板进行PCR扩增,以全式金高保真Trans StartTMFast Pfu DNA聚合酶进行PCR反应。PCR产物用1%琼脂糖凝胶电泳进行检测,在凝胶成像仪中观察。
2 结果与分析
2.1 平板筛选结果
将电转化后的2种衣藻分别涂布于含有5 μg/mL巴龙霉素的TAP培养基上,光照下培养7 d后,发现2种类型的衣藻均能够正常生长(图1-A,B)。
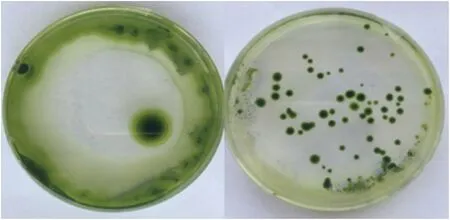
图1 WT 4CL-3a-STS转化结果(A)和CC4254CL-3a-STS转化结果(B)Fig.1 WT 4CL-3a-STS transformation results(A)and CC425 4CL-3a-STS transformation results(B)
2.2 转化率分析
液体分别培养未转化和已转化的野生型衣藻和突变型衣藻至OD750=0.6,稀释1 000倍,涂布于固体TAP培养基上,培养7 d后观察并进行单藻落计数(表1)。
由表1数据可得野生型衣藻转化率为11.07 %,突变型衣藻转化率为49.67 %,突变型衣藻转化率远高于野生型衣藻的转化率,可以推测野生型衣藻不易转化是因为含有细胞壁。在电转化时细胞壁不容易被电穿,而突变型因为缺少细胞壁电转化更加容易,从而使得转化率更高。

表1 莱茵衣藻单藻落数Tab.1 Number of single Chlamydomonas reinhardtii
2.3 镜检结果
2.3.1 衣藻野生型与突变体在明场与荧光下镜检情况 从平板上挑取衣藻野生型(WT)以及突变体(CC425)莱茵衣藻,制片后于同种状态下拍照记录在明场及荧光下观察结果。结果表明,衣藻在明场下呈现为绿色,在荧光下整体呈现为红色(图2- A,B)。
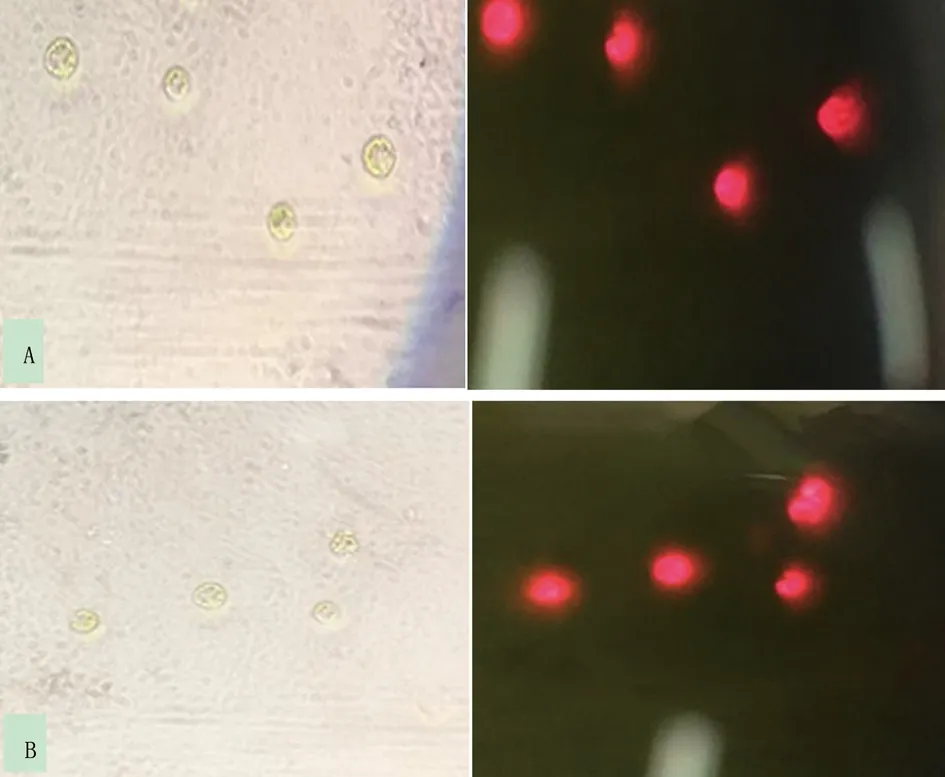
图2 衣藻野生型(A)和突变体(B)在明场(左)和荧光(右)下镜检结果Fig.2 Microscopic observation of Chlamydomonas(A) and mutant(B)in the bright field (left) and fluorescence (right)
2.3.2 衣藻野生型与突变体GFP表达情况的镜检 从平板上挑取转化GFP基因的WT和CC425衣藻,制片后在同种状态下拍照记录明场及荧光下的观察结果。结果(图3-A,B)表明,在明场下衣藻整体呈现绿色,而在荧光下整体呈现红色,且在红色中存在荧光点,说明GFP基因可能在衣藻中成功表达。

箭头所指为绿色荧光蛋白图3 转化GFP基因的衣藻突变体(A)和野生型(B)明场下及荧光下镜检结果Note:The arrows refer to GFPFig.3 Microscopic observation of Chlamydomonas GFP transformation(B) and mutant GFP transformation (A) in the bright field (left) and fluorescence (right)
2.4 转化藻株基因组检测
从上述2种转化藻株中提取基因组DNA,用4CL-3a-STS的引物扩增目的片段,结果发现扩增出目标条带(图4),初步证明目的基因4CL-3a-STS已经整合到莱茵衣藻基因组中。

M:DM 15000 DNA标记;1,质粒;2,载体;3,WT转化株;4,WT;5,CC425转化株;6,CC425图4 转化藻株目的基因片段的PCR检测Note:M, 15000 DNA Marker; 1, plasmid; 2, vector; 3, transgenic WT; 4,WT; 5, transgenic CC425; 6, CC425Fig.4 DNAgel electrophoresis of 4CL-3a-STS gene amplified from genome of Chlamydomonas strains
2.5 转化藻株转录水平检测结果
从上述两种转化藻株中提取基因组RNA并进行反转录,用4CL-3a-STS的引物扩增目标片段,结果发现扩增出目标条带(图5、6),初步证明目标基因4CL-3a-STS在莱茵衣藻中有表达。

M,DM 5000标记;1,CC425;2,CC425转化藻株图5 CC425转化藻株RT-PCR的凝胶电泳Note:M, DM 5000 Maker; 1, CC425; 2, CC425 transformantFig.5 RT-PCR gel electrophoresis of 4CL-3a-STSgene in CC425 transformant

M,DM 5000标记;1,WT;2,WT转化藻株图6 WT转化藻株RT-PCR的凝胶电泳Note:M, DM 5000 Marker; 1, WT; 2, WT transformantFig.6 RT-PCR gel electrophoresis of 4CL-3a-STS gene in WT transformant
3 讨 论
3.1 转化条件分析
3.1.1 最佳电击电压的条件 由于在衣藻进行转化时电击电压对于转化率存在很大的影响,为了得到较好的转化结果,将电压由低到高设置成3个梯度,分别为600、1 200、1 800 V/cm。结果表明,在600及1 200 V/cm时两种衣藻均能够正常生长,但在镜检下未发现荧光现象,表明这两种电压对衣藻造成的伤害较小,但不足以转入外源基因。当电压升高至1 800 V/cm,衣藻可以正常生长,并且成功在镜检下发现了绿色荧光,表明当电压为1 800 V/cm适用于转化实验。
3.1.2 最佳固体培养基 由于本试验所用的表达载体pChalic-2ATG带有aphVIII抗性基因,为了筛选出最佳抗性浓度。将衣藻两种株系WT和CC425分别涂布于含有0.1、0.2、0.3、0.4、0.5、1 μg/mL巴龙霉素的TAP培养基上。结果发现当浓度提高至0.4 μg/mL时衣藻可以正常生长,但当浓度超过0.5 μg/mL时便全部死亡。表明衣藻对巴龙霉素也具有一定的抵抗能力,但巴龙霉素浓度值不能超过0.4 μg/mL。
将转化后的衣藻涂布于含有3、4、4.5、5、5.5、6、6.5 μg/mL巴龙霉素的TAP培养基上。结果发现,当抗生素为5 μg/mL时,转化后的衣藻仍可以正常生长,但超过5.5 μg/mL时便表现为全部死亡。
3.1.3 最佳液体培养基抗生素浓度 将衣藻两种株系WT和CC425分别加入含有0.01、0.02、0.03、0.04、0.05、0.1 μg/mL巴龙霉素的TAP培养基中。发现当提高至0.01 μg/mL时衣藻可以正常生长,但当超过0.02 μg/mL时便全部死亡。表明衣藻对于巴龙霉素基本无抵抗能力。
挑取转化后的单藻落于含有0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5 μg/mL 的巴龙霉素液体培养基中,结果发现,当液体培养基抗生素为1.5 μg/mL时,转化子仍可以生长,但超过2.0 μg/mL时,莱茵衣藻全部死亡。
3.2 结论与展望
研究表明,电击方法进行基因转化,适宜脉冲电压为1 800 V/cm,此时衣藻野生型转化率为11.07 %,细胞壁缺失型转化率为49.67 %。转基因抗生素筛选浓度为:固体培养基为5 μg/mL巴龙霉素,液体培养基为1.5 μg/mL巴龙霉素。
以往应用基因工程和分子生物学方法都是利用微生物[10-12]或高等植物作为“生物反应器”[13-14]。利用微生物成本高,获得新遗传性状不稳定,在正常自然条件下不易于生产与管理;高等植物成长缓慢[15]。而莱茵衣藻可以避免以上的种种不足之处,它细胞结构简单,生长繁殖迅速,易于培养,遗传稳定。因此,可以作为一种非常优秀的生物反应器,具有广阔的应用前景。

