牦牛Toll样受体10基因的克隆与分析
黄 偲,兰道亮,林宝山,陈亚冰,黄 勇,李 键,*
(1.西南民族大学生命科学与技术学院,四川成都610041;2.西南民族大学青藏高原研究院,四川成都610041)
Toll样受体(toll-like receptors,TLRs)是一类模式识别受体,广泛表达于免疫系统,在机体先天免疫和适应性免疫中起着重要的作用[1-2]。哺乳动物TLRs为Ⅰ型跨膜蛋白,分为胞外区、跨膜区和胞内区。因其胞外区与一种早期发现的果蝇蛋白Toll同源而得名[3]。Toll样受体通过识别保守的病原体相关分子模式(pathogen associated molecular pattern,PAMPs)来识别大量的异己抗原,从而启动针对病原体的早期应答,激活获得性免疫反应。TLR10分子作为TLRs家族重要成员,与TLR1和TLR6拥有近50%的表达相似性,证明了TLR基因在进化中的保守性。但基因RACE产物测序和基因组序列比对结果显示TLR1、TLR6分别包含6个、3个外显子,而TLR10仅有1个外显子。TLR10显示出更强的功能分化能力,这与基因进化是一致的。TLR10相对TLR1、TLR6基因更早从祖先基因里分离出来。TLR10的mRNA高度表达于脾、淋巴结、胸腺和扁桃体上,表明TLR10会优先表达在与免疫应答有关的细胞和组织[4]。目前,TLR10的配体及其功能机制尚不完全清楚,但已有研究显示,TLR10与诸多疾病存在密切关联,如哮喘病、结节病等,同时作为TLRs家族重要成员,其在抗感染中的重要作用亦不可忽视[5]。
牦牛(Bosgrunniens,Yak)作为生活在高原环境下的特有物种,其机体早已适应了高原低氧、严寒等恶劣环境,可能存在特殊的抗病和免疫机制,因此对其免疫机制的研究具有重要意义。此外,近年来牦牛疫病有逐年上升的趋势,严重阻碍了牦牛业的健康发展[6]。同时,牦牛作为高原特色物种,有其独特的半野生放养模式,通常情况下药物注射不适用于牧区操作,加之牦牛作为反刍动物,不宜口服抗生素,为保证牦牛产品天然绿色无污染的品质,更应主张以非给药防治为主。因此,对牦牛抗病分子机制进行研究显得尤为重要,一方面可以深入理解高原动物特有的免疫机制,另一方面也可为牦牛的抗病育种提供理论基础。本试验通过RT-PCR技术首次克隆并得到牦牛TLR10基因的全长编码区,并对获得的目的基因进行了序列分析,对进一步研究天然免疫的调节机理提供基础数据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 试验所用材料为牦牛心、肝脾、肾、胃、肌肉、乳腺、睾丸、卵巢、大肠和小肠组织,采自四川省广汉市向阳屠宰场,牦牛来源地为四川省阿坝州红原县,属于麦洼牦牛。
1.1.2 主要仪器和试剂 普通PCR仪、电泳仪、琼脂糖凝胶成像系统为美国Bio-Rad公司产品;LATaqDNA聚合酶、大肠埃希菌DH5α为天根生化科技(北京)有限公司产品;pMD19-T克隆载体为TaKaRa公司产品;Trizol为Invitrogen公司产品;反转录试剂盒为Fermentas公司产品;凝胶回收试剂盒为Axygen(北京)公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中登录的牛Bostauruscytoglobin(TLR10)基因序列(登录号为 NM-001206720.1),用 Premier 5.0软件设计一对引物,引物序列与预期扩增片段长度如表1,引物由上海Invitrogen公司合成。
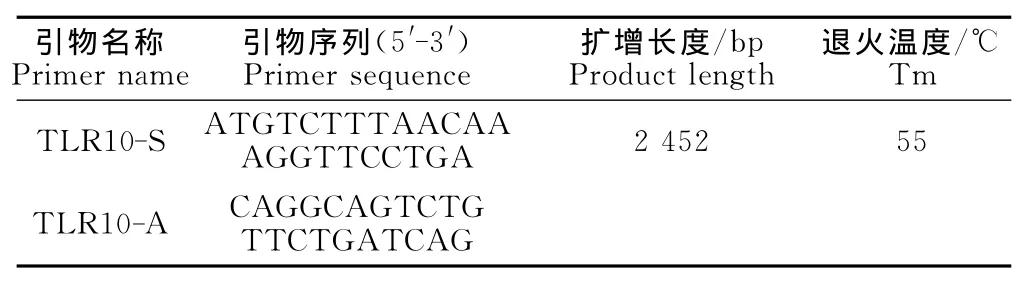
表1 TLR10基因的引物序列Table 1 Primer sequences of TLR10genes
1.2.2 RNA的提取和cDNA合成 取牦牛心、肝、脾、肺、肾、胃、肌肉、乳腺、睾丸、卵巢、大肠和小肠组织各0.1g,分别加入1mL Trizol液氮研磨提取总RNA,按照 Fermentas公司的 RevertAidTMFirst Strand cDNA Synthesis Kit反转录酶说明书,采用20μL体系:Oligo(dT)18 1μL,5×Reaction buffer 4μL,RibolockTMRnase Inhibitor(20μ/μL)1μL,10mmol/L dNTP Mix 2 μL,RevertAidTMMMuLV Reverse Transcriptase(200μ/μL)1μL,模板1μL,最后用RNase Free dH2O补足20μL,按以下程序进行反转录反应:42℃60min、70℃5min,合成cDNA,置-20℃保存备用。
1.2.3 目的基因的克隆 以获得牦牛脾脏组织cDNA为模版,进行PCR扩增。反应体系为:cDNA 1μL,2×TaqMasteMix 12.5μL,上、下游引物各1μL,双蒸水10μL。反应条件:95℃5min;94℃45s,55 ℃ 45s,72 ℃ 3min,30个 循 环;72 ℃5min。PCR产物经10g/L琼脂糖凝胶电泳查看扩增结果,Axygen凝胶回收试剂盒回收纯化目的产物。将PCR产物连接pMD19-T载体,转化DH5α感受态细胞并在Amp+琼脂平板上涂板,37℃培养后挑选单菌落,菌液PCR鉴定后,将阳性重组质粒送往Invitrogen(上海)公司进行测序。
1.2.4 TRL10基因组织表达检测 利用Primer 5软件,根据牦牛管家基因GAPDH序列设计参照引物;根据获得的牦牛脾脏组织TRL10基因序列设计特异引物:采用半定量RT-PCR技术检测TRL10基因在不同组织的表达情况。反应体系:95℃5min;94℃30s,58 ℃ 30s,72 ℃ 1min,35个循环;72℃10min。PCR产物经10g/L琼脂糖凝胶电泳查看扩增结果。
1.2.5 生物信息学分析 测序结果利用DNA Star、DNA Man、PBIL、Interpro等软件进行分析。
2 结果
2.1 牦牛TLR10基因克隆
牦牛TLR10基因扩增结果如图1。由图1可知,扩增片段大小约为2 450bp,与预期扩增片段大小相符。将获得的序列与NCBI数据库中进行Blast分析,结果表明,该序列与其他物种的TLR10基因存在高度同源性,推测该序列为牦牛TLR10基因的编码区。
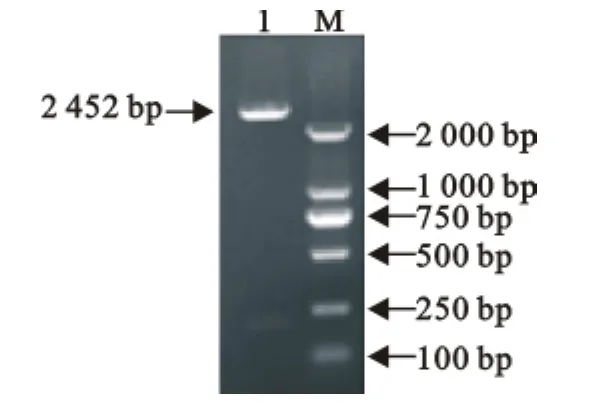
图1 牦牛TLR10基因PCR扩增结果Fig.1 PCR amplication result of yak TLR10gene
2.2 基本理化性质分析
扩增得到牦牛TLR10基因编码区为2 328bp,通过expasy等生物信息学在线软件对其基本理化性质进行分析。结果显示,TLR10基因开放阅读框全长2 328bp,编码氨基酸776个,分子质量196.3ku,理论等电点为4.94。氨基酸组成中,正电荷残基为68个,负电荷残基为83个,整个蛋白带负电荷。
2.3 牦牛TLR10基因的组织表达谱
通过半定量RT-PCR技术对牦牛各组织中TLR10基因的表达进行分析,如图2,结果显示,TLR10基因在牦牛心、肝、脾、肺、肾、胃、肌肉、乳腺、睾丸、卵巢、大肠和小肠组织均有表达,这一结果与TLR家族其他基因在哺乳动物各主要组织中均有表达的现象一致,反映出TLR10基因在组织细胞中的重要性,推测TLR10基因可能同样具备家族基因特征,在先天免疫和适应性免疫中起着重要的作用[7]。
2.4 TLR10基因编码产物亲/疏水性,柔韧性/抗原性预测
用DNA Star软件子程序Edit Seq和Pro stean对TLR10基因编码产物的亲/疏水性,柔韧性/抗原性进行分析,由图3可知,TLR10基因编码产物含有293个亲水性残基和231个疏水残基,因此推测其整体表现为亲水性。柔韧性区域分布相对均匀。抗原表位区域较大,与柔韧性区域和表面可能性区域出现了较多的重叠区,这些区域相对易于变形,便于抗原、抗体的自由结合,可能是抗原位点的富集区[8]。

图2 牦牛TLR10基因在各组织中的RT-PCR扩增结果Fig.2 RT-PCR results of TLR10gene in yak tissues

图3 牦牛应激型TLR10基因亲水性、柔韧性及抗原性的预测结果Fig.3 Predictive results of hydrophilicity,flexibility,surface probability and antigenicity of TLR10gene in yak
2.5 信号肽预测和分析
通常分泌蛋白及细胞膜蛋白都以前体物质多肽的形式合成,其N末端含有作为通过膜时指导蛋白质跨膜转移的氨基酸序列,即为信号肽。利用丹麦科技大学(DTU)的CBS服务器对蛋白质序列的信号肽(signal peptide)进行预测,结果显示TLR10基因编码的蛋白没有信号肽,属于非分泌型蛋白。
2.6 二级结构和三级结构预测
应用在线软件PBIL预测组成TLR10多肽链二级结构的3种类型,即α螺旋(Alpha helix)、延伸链(extended strand)和自由卷曲(random coil)的比例是33.12∶20.62∶46.26,表明蛋白质的二级结构主要由α螺旋及自由卷曲两种结构元件组成,延伸链相对较少,β螺旋(Beta helix)则散布于整个蛋白质中。利用SwissModeling对TLR10的氨基酸序列进行蛋白质三维结构的同源建模(图4),可见结构中含有较多的α螺旋和自由卷曲,与二级结构预测结果基本相同。
2.7 TLR10蛋白结构域和蛋白功能位点预测
利用Interpro在线工具对牦牛TLR10蛋白进行结构域预测,结果见图5。该蛋白质在N端有多个亮氨酸富集区域 LRRs(leucine rich repeat),LRRs是受体识别存在于病原体细胞表面的分子标志,即与配体结合的特异部位其间有非LRR序列分隔;C端487-540氨基酸处有一个半胱氨酸富集区域,结合已知的TLRs基因产物结构分析,预测此结构域为该蛋白跨膜区;C端596-743氨基酸处有一个Toll/IL-1R(Toll/IL-1receptor homologous region,TIR)功能结构域,结合已知的TLRs基因产物结构分析,这一区域氨基酸结构应当高度保守,是TLR10传导信号的核心区域在介导细胞内信号传递,与天然免疫和获得性免疫作用的发挥密切相关。

图4 TLR10蛋白三级级结构的预测Fig.4 The predictive results of tertiary structure of TLR10protein

图5 TLR10蛋白结构域分析Fig.5 The structure domain analysis of TLR10protein
2.8 同源性分析
利用DNA Star软件子程序 MegAlign的Clustal W 方法与GenBank中公布的部分物种TLR10基因序列进行同源性比较,结果如图6所示。牦牛TLR10基因序列与其他10个物种相比,同源性最高的是牛,高达94%,最低的是鸭嘴兽,为62.6%;与水牛、绵羊、山羊、梅花鹿的同源性都高于90%;与野猪、家犬、大猩猩、人、猕猴、狐蝠的同源性均高于85%;与家鼠的同源性为76.9%。该结果说明TLR10基因在哺乳动物间具有较高的保守性。
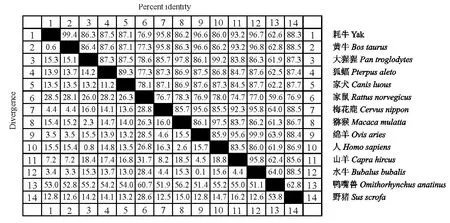
图6 TLR10基因核苷酸序列同源性比较Fig.6 Homological alignment of TLR10gene nucleotide sequences
2.9 遗传进化树
运用MEGA 5.0软件的Neighbor-Joining法,重复1 000次,将获得的11个TLR10基因序列构建Bootstrap验证的系统发育树,结果如图7所示。由图7可见,牦牛与黄牛TLR10基因的亲缘关系最近,并与山羊、绵羊、水牛、梅花鹿、野猪形成偶蹄目哺乳动物的一个分支,人、大猩猩、猕猴形成的跟牦牛较近的灵长目分支,而鸭嘴兽代表的原兽亚纲动物与牦牛的遗传距离最远。
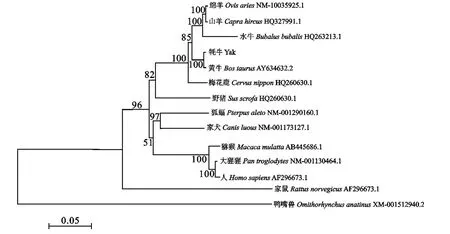
图7 TLR10基因的核苷酸序列系统进化树Fig.7 Phylogenetic tree of TLR10gene nucleotide sequences
3 讨论
随着对TLRs的深入研究,人们发现从低等到高等不同进化层次的动物体内都可查到TLRs的存在,提示这是一个生命体古老的防御机制。虽然仍有部分TLRs的功能及机制还未被人所认识,但从已知的TLRs功能来看,TLRs在介导机体固有性免疫应答、促使机体免疫系统在抵御病原体入侵的早期就开始启动,并且在诱生多种促炎症细胞因子的同时,也使免疫细胞表达出多种膜表面分子[9-11]。TLR10分子作为TLRs家族重要成员,显示出较其他相似成员更强的功能分化能力,同时鉴于TLR10在不同组织均有表达,其对于机体免疫重要性不言而喻。已有研究证明TLR10在炎症识别过程中的介导作用,证实了TLR10基因优先表达在和免疫应答有关的细胞和组织上[12]。而关于其相关配体组成及详细作用机制的发现相信亦只是时间问题。
牦牛作为我国青藏高原特色物种,在高原人民生活中扮演着重要角色。但是近年来牦牛疫病发生率逐年上升,严重影响牦牛存活率和单重,直接威胁牧民的经济命脉。此外,牦牛乳作为牧民群众主要的生活饮食品,其对提高饮食档次,改善膳食结构,提供营养成分等方面起着重要作用。泌乳期牦牛易患乳房炎,不仅降低产奶量,造成经济损失,而且影响奶品质量,危害牧民健康。TLRs作为一种模式识别受体,不仅在天然免疫中起重要作用,同时也被视为天然免疫与获得性免疫的“桥梁"。目前已有多个TLRs家族基因被证明对牛多种疾病有重要意义。牦牛TLR10基因组织表达谱结果显示,TLR10在组织中普遍表达,而相关研究对牦牛雄性生殖器官中TLR10的相对高表达也提示该基因可能对牦牛生殖疾病有着特殊意义[13]。因此,对TLR10基因的研究,在兽医相关研究方面可望明确病原体被其识别的本质,阐明其天然免疫机制,为寻找由于免疫系统失调所致疾病的治疗新途径及靶点提供新的思路,为解决牦牛疾病问题提供绿色解决方案。
目前已有研究显示在牛、猪等哺乳动物中TLR10基因均存在一定的多态性[14-15],在人类身上已发现TLR10基因的多态性与某些疾病发病密切相关[16]。本试验限于样品来源地及数量限制,并未发现TLR10编码区的多态性,但牦牛不同品种存在明显地域限制,故而牦牛TLR10基因多态性亦值得进一步研究。牦牛与其他物种TLR10基因编码区序列具有较高的同源性,TLR10基因进化上高度保守。参考TLRs家族其他基因相关研究,推测牦牛TLR10基因与其他物种的差异性可能存在于表观遗传学方面[17]。此外,碱基的差异是否对TLR10基因表达产物产生功能影响亦值得进一步研究。TLR10基因编码区的克隆及生物信息学分析将为后续研究牦牛的免疫机制奠定理论基础。
[1]Akira S,Uematsu S,Takeuehi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[2]张立春,王全凯,陈尚武.梅花鹿TLR10基因克隆与序列分析[J].东北林业大学学报,2013,41(1):116-120.
[3]李 拓,储明星,王金玉.荷斯坦母牛TLR10基因PCR-SSCP分析[J].中国畜牧兽医,2009,36(12):81-84.
[4]王 军,赵迎飞,方正锋,等.饲粮中添加苏氨酸和色氨酸对接种猪繁殖与呼吸综合征弱毒苗生长猪免疫反应的影响[J].动物营养学报,2013,25(6):1189-1198.
[5]Govindaraj R GManavalan BLee G.Molecular modelingbased evaluation of hTLR10and identification of potential ligands in toll-like receptor signaling[J].PLoS One,2010,5(9):1-13.
[6]孙西峰,沈延银.牦牛隐性乳房炎发病情况的调查[J].青海畜牧兽医杂志,2003,39(3):27-28.
[7]王树茂,兰道亮,陈亚冰,等.牦牛HSPA1A和HSPA2基因组织表达分布的检测[J].动物医学进展,2013,34(12):139-144.
[8]林宝山,兰道亮,王树茂,等.牦牛神经珠蛋白基因的克隆及序列分析[J].动物医学进展,2014,35(1):64-68.
[9]Abad C,Gonzdlez-Escribano M F,Diaz-Gallo L M,et al.Association of Toll-like receptor 10and susceptibility to Crohn's disease independent of NOD2[J].Genes Immun,2011,12(8):635-642.
[10]韩正强,王楠楠.Toll样受体的研究进展[J].畜牧与兽医,2011,43(12):93-96.
[11]Lee S M,Kok K H,Jaume M.et al.Toll-like receptor 10is involved in induction of innate immune responses to influenza virus infection[J].Proc Natl Acad Sci U S A,2014,111(10):3793-3798.
[12]Regan T,Nally K.Identification of TLR10as a key mediator of the inflammatory response toListeriamonocytogenesin intestinal epithelial cells and macrophages[J].J Immunol,2013;191(12):6084-6092.
[13]曹随忠,李计尚,张 于,等.TLRs基因在牦牛雄性生殖器官中表达情况的检测[J].中国兽医科学,2014,44(2);193-198.
[14]翠 霞,王洪梅,李建斌.荷斯坦牛TLR2基因遗传多态性与乳腺炎抗性关系[J].华北农学报,2008,23(5):35-39.
[15]Opsal M A,Vage D l,Haves B,et al.Genomic organization and transcript profiling of the bovine toll-like receptor gene cluster TLR6-TLRl-TLRl0[J].Gene,2006,384:45-50.
[16]Kim S K,Kim Y O,Lee B C,et al.Toll-like receptor 10-1-6 gene cluster polymorphisms are not associated with benign prostatic hyperplasia in korean population[J].Int Neurourol J,2014,18(1):10-15.
[17]Mikacenic C,Reiner Alexander P,Holden Tarah D.Variation in the TLR10/TLR1/TLR6locus is the major genetic determinant of inter-individual difference in TLR1/2-mediated responses[J].Genes Immun,2013,14(1):52-57.

