犬皮下注射麻保沙星生物利用度的研究
阮祥春,季 辉,彭 麟,高修歌,张冠军,江善祥*
(1.安徽农业大学动物科技学院,安徽合肥 230036;2.南京农业大学动物医学院,江苏南京 210095)
氟喹诺酮类药物被广泛的应用于各种动物的细菌感染性疾病。麻保沙星是第3代氟喹诺酮类动物专用的抗菌药物。对绝大多数革兰阳性菌具有较强的抗菌活性,对革兰阴性菌更为敏感,对多数厌氧菌则比氧氟沙星有更高的活性,尤其是对阳性芽胞杆菌;一些对林可霉素、强力霉素及磺胺等药物产生部分耐药性的病原菌对麻保沙星仍然敏感。临床上已被用于治疗犬的深部和浅表皮肤感染、泌尿道感染、猫的皮肤及软组织感染、急性上呼吸道感染。另外,麻保沙星对牛的一些致病菌如溶血性巴氏杆菌、多杀性巴氏杆菌等也有较高活性。麻保沙星在牛、犬[1]、猪[2-3]、羊、鹿[4]、肉鸡、兔[5-6]、海龟[7]体内的药动学特征研究表明,该药内服及非胃肠道给药后吸收迅速且完全,分布广泛,血浆及组织中的浓度高,消除半衰期长,生物利用度较高。通过本试验研究健康犬皮下注射麻保沙星的药物动力学及生物利用度,旨在为兽医临床制定合理的给药方案提供理论依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 麻保沙星冻干粉由南京农业大学兽医药理实验室自制,规格:0.1g/瓶,含量:99.2%;氧氟沙星对照品由中国兽医药品监察所提供,含量98.2%,批号:H0090912;麻保沙星对照品为上海安谱科学仪器有限公司生产,含量100.1%;乙腈,色谱级为德国CNW公司产品;肝素钠、三乙胺、磷酸、等为国产分析纯。
1.1.2 试验用动物 健康史宾格犬18只,公母兼有,体重9kg~15kg,由南京市江宁区青龙山动物繁殖场提供,饲料由江浦农场饲料厂提供,不含任何抗菌药物。购回后常规饲养,自由饮水、采食,临床观察1周后,做常规体检功能正常,临床健康者用于试验。随机分为2组,分别用于静注、皮下注射给药的药动学试验。试验前16h起至给药后4h间禁食,仅自由饮水。
1.1.3 仪器设备 Ailgent 1200型高效液相色谱仪、Sigma3K15型低温高速离心机为德国Sigma公司产品;WH-3型微型漩涡混合仪为上海沪西分析仪器厂产品;BS-210S型电子分析天平为北京赛多利斯天平有限公司产品;DC12H型氮吹仪为上海安谱科学仪器有限公司产品。
1.2 方法
1.2.1 给药方案与血样采集 一组按2mg/kg单次皮下注射麻保沙星冻干粉,即0.2mL/kg,另外一组静脉注射给药;空白血样在给药前采集,后分别于5、10、15、30、45min,1、1.5、2、4、6、8、12、24、36、48、72h从前肢头静脉采血,每次约2mL,分离血浆,-20℃冰箱保存待测。间隔2周后两组交叉给药,同样方法采血。
1.2.2 血浆中麻保沙星浓度的测定 参照Schneider[8]和李云峰[2]报道的方法,并稍作 改动。取300μL含药血浆加至离心管中,加入10μg/mL的内标物氧氟沙星对照品溶液15μL,加入2mL二氯甲烷,混合涡旋3min。10 000r/min离心10min后,取下层二氯甲烷层,氮吹仪40℃吹干,200μL流动相溶解,混合涡旋2min溶解,12 000r/min离心5min,取上清进样20μL。色谱条件:色谱柱为Agilent(5μm,4.6×250mm),流动相为乙腈:0.02mol/L磷酸溶液(500mL+0.5mL三乙胺)=13.5∶86.5,流速为0.8mL/min,柱温35℃,检测波长295nm。在上述色谱条件下能将麻保沙星、氧氟沙星与血浆中其他组分分开,麻保沙星最低检测限为0.02μg/mL ,定量限为0.04μg/mL。麻保沙星、氧氟沙星的色谱峰保留时间分别为9.3、11.3min(图1)。经本方法测定,麻保沙星的绝对回收率分别为85%~115%,标准曲线在0.04μg/mL~4μg/mL范围内(标准曲线方程为Y=1.25X-0.015 3(R2=0.999 9))线性关系良好,批内、批间变异系数分别为2.03%和3.77%。
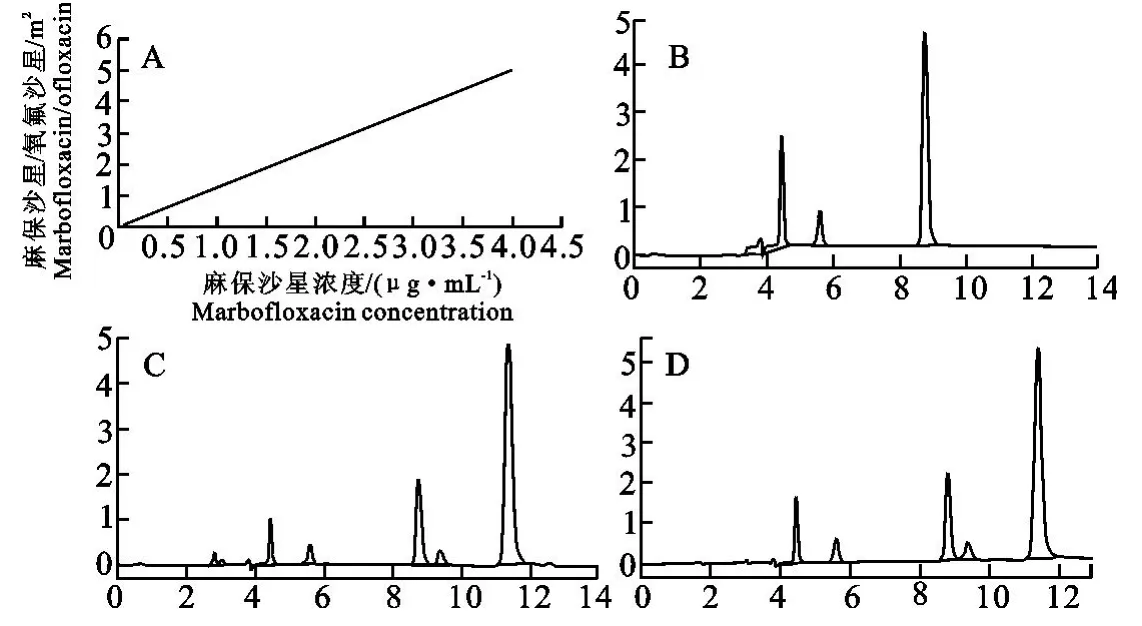
图1 麻保沙星高效液相色谱检测方法图谱Fig.1 The detection method of marbofloxacin with HPLC
1.2.3 方法数据处理 方法学验证考察数据采用SPSS16.0软件分析处理;药动学数据处理及生物等效性检验采用3P97药动学软件分析,并对生物利用度进行计算。生物利用度(AUC0-t)sc、(AUC0-t)iv分别为皮下注射和静脉给药后的药时曲线下面积。
2 结果
健康犬单剂量皮下注射麻保沙星后,在1h左右达到了最大的血药浓度,说明麻保沙星给药后能迅速的被机体组织所吸收。具体的静脉、皮下不同时间血药浓度的实测值见表1。静注给药的最佳药物动力学模型为无吸收三室开放模型,肌注及内服给药的最佳药物动力学模型均为一级吸收二室开放模型,药时曲线见图2。
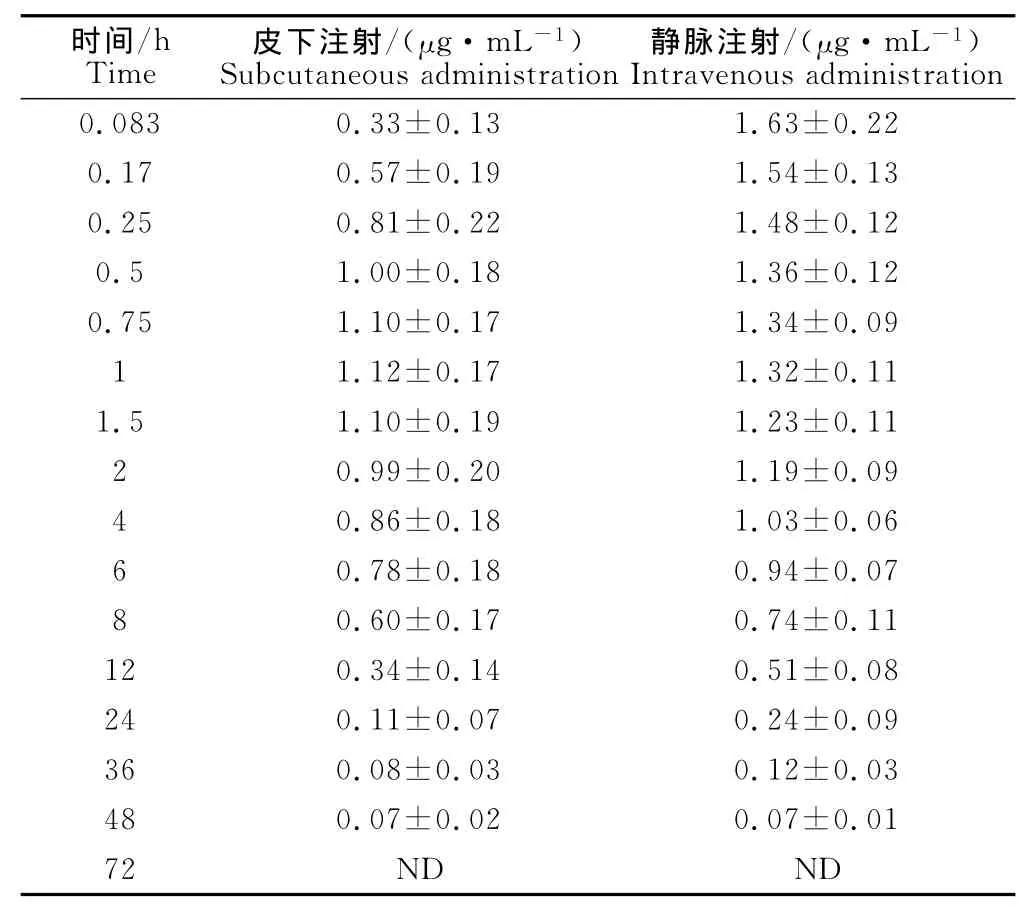
表1 皮下、静脉注射后麻保沙星的血药浓度Table 1 The plasma concertrations of marbofloxacin after subcutaneous and intravenous adminstrations
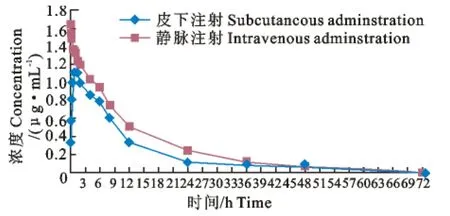
图2 皮下、静脉药时曲线图Fig.2 Drug concentration-time curves after subcutaneous and intravenous administrations
根据各血样测定的数据,利用3P97药代动力学软件进行麻保沙星的药代动力学的分析,所得的参数见表2。本试验结果显示,健康犬皮下注射单剂量麻保沙星后,0.97h左右达到峰值,且吸收半衰期为0.19h左右,表观分布容积(V/F)为1.63L/kg左右,生物利用度(F)达66.72%,表明其吸收较快,分布较广。

表2 皮下、静脉注射后麻保沙星的药代动力学参数Table 2 Pharmacokinetics parameters of marbofloxacin after subcutaneous and intravenous administrations
3 讨论
3.1 皮下注射给药的药代动力学特征
张玲玲等[9]报道以2.75mg/kg体重比较了口服与肌肉注射麻保沙星2中剂型在犬体内的药代动力学研究。肌肉注射与口服麻保沙星的药时,符合一级吸收一室开放模型,与皮下一级吸收二室开放模型有差异,但与日本对虾肌肉注射和口服在体内动力学模型一致[10]。肌肉注射与口服麻保沙星吸收半衰期为0.52h和0.41h,比皮下注射麻保沙星吸收半衰期为0.19h要长。但是,与泌乳期奶牛肌肉注射0.17h、家兔肌肉注射 0.24h[6]、猪肌肉注射0.27h[2]等报道的相接近。肌肉注射和口服的消除半衰期分别为4.4h和6.25h,小于皮下注射的7.21h,比泌乳期奶牛肌肉注射t1/2ke=2.53h、家兔肌肉注射t1/2ke=2.17h[6]的要长,但比猪肌肉注射时t1/2ke=17.39h[2]要短。本试验说明皮下注射麻保沙星比肌肉注射和口服的吸收要快,消除要慢。
3.2 检测方法准确性
喹诺酮类药物在兽医临床上有着广泛的应用,其检测的方法和手段也比较的多,残留检测方法发展的更为迅速。由微生物方法发展到色谱、单克隆抗体等方法,当初的单一检测喹诺酮类药物到喹诺酮类药物的多残留检测[11-12]。本试验所采用的检测方法,是在前人的基础上略微进行了改动,与林仙军[13]所报道的有差异,但是方法是针对不同的样品来进行检测。本方法完全满足本试验的要求。
3.3 疗效预测
对于氟喹诺酮类等浓度依赖型药物,根据大量的人及动物体内、体外的研究结果,AUC/MIC值和Cmax/MIC值是预测药物疗效的重要指标,即当AUC/MIC值为100h~125h时,预测有效率可达80%,Cmax/MIC值大于8~10时临床效果较好[1]。Cmax/MIC有较高的比值就能避免细菌对麻保沙星耐药性的产生[7]。据报道,麻保沙星对革兰阴性细菌的 MIC值在0.016μg/mL~0.5μg/mL,对革兰阳 性 细 菌 的 MIC 值 在 0.18 μg/mL ~0.25μg/mL[14]。因此,皮下注射麻保沙星的对革兰阴性细菌的 AUC/MIC值为26.26h~820.625h,Cmax/MIC为2.26~70.625之间,而对革兰阳性细菌的AUC/MIC值为52.52h~72.44h,Cmax/MIC为4.52~6.28之间。说明针对某些革兰阴性病原菌 MIC50为低于0.131μg/mL,麻保沙星能取得良好的治疗,但是按照2mg/kg单次皮下注射对于革兰阴性细菌的MIC高于0.131μg/mL值及革兰阳性就不一定能取得很好的疗效。此预测只是理论上角度去分析,具体在临床中的应用,由于耐药性的出现[15],还需要针对具体的细菌,根据其 MIC和MBC值来指导临床实际应用剂量。
[1]刘利锋,高丽丽,苏 凤,等.犬口服国产麻保沙星溶液的生物利用度研究[J].畜牧兽医学报,2010(41):1317-1321.
[2]李云峰,曾振灵,陈杖榴,等.麻保沙星(marbofloxacin)在猪体内的药物动力学[J].中国兽医学报,2004(24):177-180.
[3]邹 明,曾振灵.麻保沙星对实验性猪传染性胸膜肺炎的药效学研究[J].西南农业学报,2012,25(6):2333-2337.
[4]Gomez-Martin A,Sanchez A,Amores J,et al.Effect of marbofloxacin on mycoplasma carrier state and sperm quality in goat bucks[J].Small Ruminant Res,2013,112(1):186-190.
[5]Marín P,Alamo L F,Escudero E,et al.Pharmacokinetics of marbofloxacin in rabbit after intravenous,intramuscular and subcutaneous administration[J].Res Vet Sci,2013(94):698-700.
[6]余军军,张驰野,远立国,等.麻保沙星在家兔体内的药代动力学研究[J].中国兽医科学,2010(10):1072-1075.
[7]Marín P,Lai O R,Laricchiuta P.Pharmacokinetics of marbofloxacin after a single oral dose to loggerhead sea turtles(Carettacaretta)[J].Res Vet Sci,2009(87):284-286.
[8]Schneider M,Thomas V,Boisrame B,et al.Pharmacokinetics of marbofloxacin in dogs after oral and parenteral administration[J].J Vet Pharmacol Therap,1996(19):56-61.
[9]张玲玲,潘 安,赵 杰,等.2种剂型麻保沙星在健康家犬体内药物动力学比较[J].华中农业大学学报,2010,29(1):75-78.
[10]李 晖,李 健,孙 铭,等.肌注和口服药饵麻保沙星在日本对虾体内的药代动力学比较[J].海洋科学,2013,37(3):63-69.
[11]李新朋,姜金庆,钱爱东,等.动物性食品中氟喹诺酮类药物多残留检测研究进展[J].动物医学进展,2013,34(9):99-103.
[12]钱卓真,朱世超,魏博娟,等.高效液相色谱串联质谱法测定水产品中19种喹诺酮类药物残留量[J].中国渔业质量与标准,2012,2(3):68-76.
[13]林仙军,穆 琳,吕伟军.高效液相色谱法测定麻保沙星溶液的含量[J].中国兽药杂志,2013,47(6):36-38.
[14]Albarellos G A,Montoya L,Landoni M F.Pharmacokinetics of marbofloxacin after single intravenous and repeat oral administration to cats[J].Vet J,2005(170):222-229.
[15]李淑梅,郝海玲,白有杰.喹诺酮类药物对猪沙门菌防耐药变异浓度的研究[J].动物医学进展,2013,34(3):76-79.

