自制中药复方片剂对小鼠的急性毒性试验
王 静,蒋 万,何生虎,李志红,葛 松,郭澍强
(宁夏大学农学院,宁夏银川 750021)
母牛在产犊后,气血亏损,生殖器官受到损伤,机体抵抗力减弱,消化机能降低,而乳腺机能却在逐渐恢复,泌乳量逐日上升,体质的恢复和泌乳之间的矛盾较为突出[1],极易引起各种疾病,特别是在临床上奶牛产后疾病较为常见,其发病率高、治愈率低。奶牛产后疾病包括奶牛产后瘫痪、胎衣不下、子宫内翻及脱出、子宫内膜炎、乳房炎等[2]。若不能及时进行合理的诊治,会直接影响奶牛的生产性能,降低奶牛繁殖能力和受胎率[3],延续发情,奶牛胎间距延长甚至会导致奶牛死亡[4]。因此,奶牛产后保健对奶牛业的发展具有极其重要的意义。
目前,有关奶牛产后疾病的治疗,国内外学者总结出了很多的治疗方法,但存在诸多问题。奶牛产后疾病的治疗主要是以抗生素疗法为主,而长期使用抗生素不仅会对奶牛机体产生许多副作用,损伤机体内脏器官,同时也会导致耐药菌株的产生和药物残留等问题,从而降低了抗生素的治疗效果,且对食品安全及人和动物健康都产生着不同程度的影响[5],其经济效益也值得怀疑,并且某些抗生素还会使奶牛的免疫功能受到抑制,容易造成重复感染[6]。现在越来越多的学者注重中草药疗法,对奶牛产后疾病的疗效进行各方面的研究,常用中药制剂主要有散剂、汤剂、针剂、子宫灌注剂等剂型。本试验从中药黄芪、当归、枸杞子、益母草、炙甘草等提取有效成分,研制出一种具有含药量高,服用剂量小,使用方便,吸收快,能提高奶牛机体免疫力等特点的中药复方口服片剂,从而达到预防奶牛产后疾病的作用。为了验证该中药复方片剂的安全性,确定其中药配方提取后制成的片剂的安全性,试验采用小鼠急性毒性试验方法测定小鼠半数致死量(LD50),对该复方中药制剂进行药物安全性评价,为该药在防治奶牛产后疾病中的临床应用提供可靠的依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 ICR系小鼠160只,约7周龄,雌雄各半,体重18g~22g,由宁夏医科大学动物实验中心购入。在通风良好的情况下,饲养在室温20℃~25℃的鼠笼中,观察5d,预试验随机分成5组,8只/组,其中1组小鼠为空白对照组;正式试验随机分成10组,10只/组,其中1组为小鼠空白对照组。自由饮水及采食。试验前禁食12h~16h,给药后4h内禁食,但不禁水。
1.1.2 试验药品 复方中药制剂由宁夏大学农学院临床兽医实验室研制,复方中药片是由50%的药液和50%的不同辅料配比制备而成;本试验原药采用黄芪、当归、枸杞子、灵芝、党参、益母草等有效成分提取物,按一定浓度配制而成,1mL相当于原药物2g,经除杂质过滤后为红棕色透明澄清液体。
1.1.3 试验器材 D228-1电子计数秤为上海高致精密仪器有限公司产品;1mL注射器;小鼠笼;小烧杯;外科器械等。
1.2 方法
1.2.1 小鼠口服(灌胃)急性毒性预试验 选取30只ICR系小鼠,随机分成5组,雌雄各半,6只/组,其中一组小鼠为空白对照组。试验组小鼠用12号灌胃针进行灌服,灌服剂量分别为20 000、40 000、80 000、160 000mg/kg体重,给药后笼边观察。先观察30min,在给药后的4h再观察1次,以后每天早晚各观察1次,连续观察7d,对动物的全身精神状态观察的主要内容有被毛组织光滑度、眼角膜是否有血丝、红肿现象、小鼠活动是否有异常行为,以及小鼠的神经系统、呼吸系统、消化系统、泌尿生殖系统等,并记录各组小鼠死亡数和存活数,试验过程中对中毒死亡后的小鼠进行剖检,观察小鼠各组织器官的变化。
1.2.2 小鼠腹腔注射急性毒性预试验 选取30只ICR系小鼠,随机分成5组,雌雄各半,6只/组,其中一组小鼠为空白对照组,以2倍稀释的药物浓度,即各组剂量为10 000、20 000、40 000、80 000mg/kg体重腹腔注射小鼠,观察时间及内容同小鼠灌胃方法。根据各组小鼠死亡数和存活数,确定出大致死亡浓度,即估计致死量(Dmin和Dmax)。当出现LD100时,若前一组剂量不为LD100时,则该剂量为Dmax;当出现LD0时,若后一组剂量不为LD0时,则该剂量为Dmin。腹腔注射后观察小鼠中毒症状和死亡数量,根据公式i=(logDmax-logDmin)/(n-1),计算出来组间距i值(i值即组间距,剂量的对数值等差分布,剂量成等比分布),根据Dmin和Dmax设计出正式试验各组的剂量分布,即D1=Dmin,D2=D1(1+i)、D3=D2(1+i)、D4=D3(1+i)......D9>Dmax,以此类推即可得到正式试验组各组的剂量值。
1.2.3 小鼠腹腔注射急性毒性正式试验 随机抽取100只ICR系小鼠(18g~22g),雌雄各半,随机分为10组,10只/组,其中1组小鼠为空白对照组。各组分别按照上述预试验计算出来结果,将自制的复方中药液以不同浓度梯度剂量为准对小鼠进行腹腔注射给药,按每只小鼠的体重计算给药量(mg/kg体重),在给药前18h和给药后4h内禁食,自由饮水,给药后笼边先观察30min,在给药后的4h再观察1次,以后每天早晚各观察1次,连续观察7d,并记录7d内小鼠的各体征动态、给药前后体重变化、行为活动及小鼠的死亡数。对中毒后的小鼠剖检各组织器官的变化。按改良寇氏法计算出半数致死量[7](LD50)。
2 结果
2.1 小鼠口服(灌胃)急性毒性预试验结果
用灌胃针灌服复方中药提取液之后,在10min后观察小鼠,大部分小鼠表现很兴奋,个别小鼠蜷缩在角落,眼睛微闭,呼吸频率加快,活动量减少;用药4h后观察小鼠,注射20 000mg/kg剂量组的小鼠小鼠精神状态基本恢复正常,小鼠的采食量、饮水量、活动均正常,并且小鼠被毛平整,反应灵敏,与对照组相比较粪便形态无区别,但是尿液呈现黄色。18h后观察40 000mg/kg剂量组的小鼠小鼠精神状态基本恢复正常,小鼠的采食量良好、饮水量、活动均正常,小鼠被毛平整,反应灵敏,但80 000mg/kg剂量组的各别小鼠被毛松弛,活动懒散,有个别呈嗜睡状态。42h后观察,40 000mg/kg剂量组的小鼠死亡1只,80 000mg/kg剂量组的小鼠死亡3只,而160 000mg/kg剂量组的小鼠全部死亡,剖检死亡后小鼠发现小鼠肝脏肿大表面呈现紫红色,切面呈暗红色,质地软易碎,肾脏无明显眼观变化,预试验结果见表1。

表1 小鼠口服注射急性毒性预试验结果Table 1 The pre-experimental resullts of the injection oral acute toxicity in mice
由表1可知,预试验中估计致死量Dmin为40 000mg/kg,Dmax为80 000mg/kg,按照毒理学评价标准,LD50>10 000mg/kg时药物属于无毒性物质,而本试验的最小致死量已经远远超于10 000mg/kg,说明复方中药制剂对小鼠安全无毒。
2.2 小鼠腹腔注射急性毒性试验结果
2.2.1 小鼠腹腔注射急性毒性预试验结果 由表2可知,预试验中估计致死量Dmin为10 000mg/kg,Dmax为80 000mg/kg。按寇氏法设计根据公式i=(logDmax-logDmin)/(n-1),计算出来组间距i=0.113,组间剂量比为1∶0.77,所以正式试验各组剂量,分别为10 000、12 970、16 822、21 818、28 297、36 703、47 604、61 742、80 079、103 862mg/kg体重。
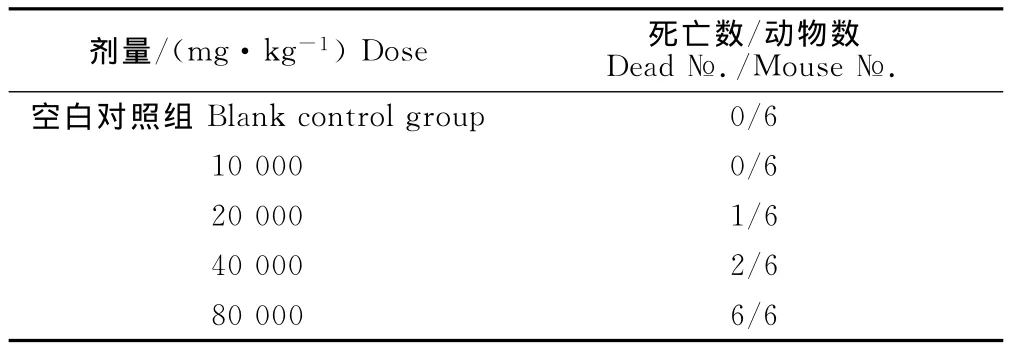
表2 小鼠腹腔注射急性毒性预试验结果Table 2 The pre-experimental resullts of acute toxicity in mice by intraperitoneal injection
2.2.2 小鼠腹腔注射急性毒性正式试验结果 腹腔注射复方中药提取液制剂6min后,大部分小鼠表现出兴奋不安,痉挛,缩成一团,眼睛微闭,嗜睡,被毛粗乱,平滑肌松弛,呼吸急促,对外界刺激略微迟钝,部分小鼠饮食饮水量少。用药4h后观察小鼠以上症状仍持续,注射10 000mg/kg~21 818mg/kg组个别小鼠有恢复迹象,有采食饮水行为;注射28 297mg/kg~47 604mg/kg组个别小鼠蜷缩在角落,被毛松散,呼吸频率加快,活动量减少;用药8h后观察小鼠,注射61 742mg/kg~80 079mg/kg组个别小鼠有濒死迹象,呈极度嗜睡状态,呼吸呈深度腹式呼吸,翻正反射迟钝甚至消失,对外界刺激无反应。18h后观察注射10 000mg/kg~218 18mg/kg组的小鼠逐渐恢复,活跃程度不如空白对照组,采食量减少,尿液呈黄色,粪便形状良好,但相比空白对照组颜色略黄且湿润。注射36 703mg/kg~61 742mg/kg组的小鼠被毛无光泽、松弛,活动量少,平滑肌松弛,采食饮水量相对于对照组明显减少,并有死亡迹象。其中,80 079mg/kg组的小鼠死亡只数为3只,解剖后小鼠肝脏肿大,颜色呈紫红色,嘴角并有血迹现象。46h后观察注射80 079mg/kg的小鼠全部死亡,除此之外,其他各组剂量的小鼠均有死亡;随着剂量组剂量的增大,ICR小鼠的死亡率也是逐渐增加,脏器病变也随之显著,直到用药后的108h后,存活的小鼠采食、饮水均正常,活动自如,各项体征和各系统情况与对照组相比无差别。针对死亡小鼠剖解发现,小鼠肝脾脏肿大、被膜紧张、边缘钝圆,尤其以肝脏肿大最为明显,颜色呈暗紫红色,纵切面呈暗红色,肝脏质地变软易碎,肠系膜略有充血现象,其他脏器未见有异常情况。各剂量组死亡统计表见表3。
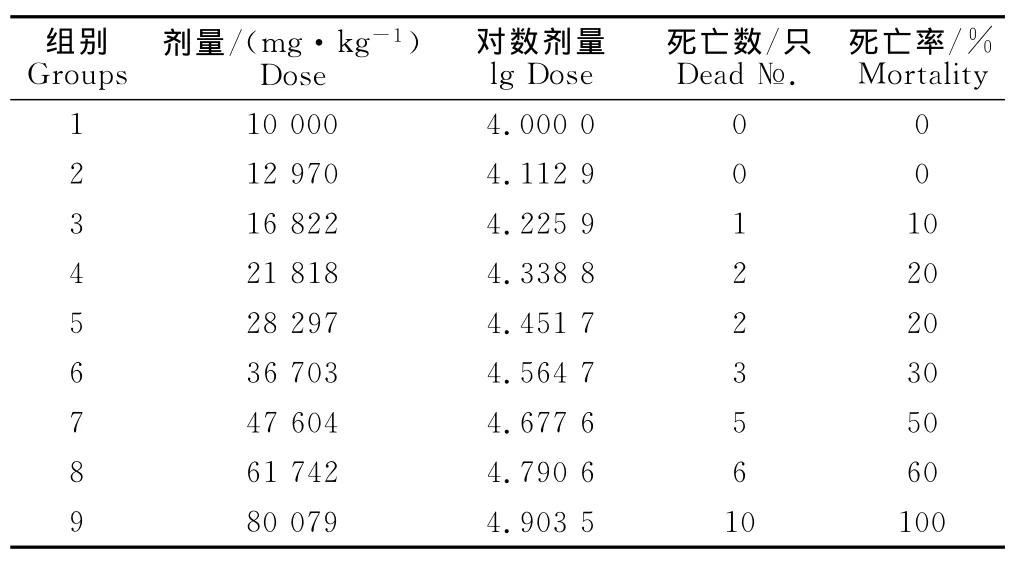
表3 小鼠腹腔注射急性毒性正式试验结果Table 3 The experimental results of acute toxicity in mice by intraperitoneal injection
结果表明,小鼠的最大耐受量LD0=12 970mg/kg,最小致死量 MLD=16 822mg/kg,根据改良寇氏法计算公式:LD50=lg-1[Xm-i(∑P-0.5)],式中Xm为最大剂量的对数,P为各组动物的死亡率,∑P为各组动物死亡率总和,i为组间距(相邻两组对数剂量的差值),根据表3计算出LD50=42 884mg/kg。 根据公式 Slog LD50=式中d为对数组距,p为各组死亡率,n为每组动物数,得出标准误Slog LD50=0.039 7,LD50的 95% 的可信限范围 为35 222.77mg/kg~50 545.23mg/kg。根据毒理学评价标准,LD50>10 000mg/kg属于无毒性物质,本试验中复方中药片对小鼠安全无毒。各组小鼠用药前后体重变化情况见表4(1组为空白对照组,2组~10组为试验组)。

表4 小鼠腹腔注射急性毒性试验给药前后体重变化情况Table 4 Weight changes before and after intraperitoneal injection in acute toxicity test in mice
由表4可知,1组为对照组,小鼠体重明显增加,2组~3组在给药前后小鼠的体重变化明显,在小鼠一切行为活动恢复正常的同时,且小鼠的体重较给药前有所增加;4组~10组在给药前后小鼠的体重明显减轻,并且随着剂量的增加,小鼠给药前后的体重减轻趋势也愈加明显。
3 讨论
现在越来越多的学者注重采用中草药疗法对奶牛产后疾病的效果研究。从中医学的角度来看[8],奶牛产后疾病主要在由于气血不畅或者气血不足而引起的,经产奶牛大多气虚血虚,中气不足,或有中气下陷,导致外感风寒风热,会继发各种产科疾病,使得脾胃虚弱,导致产奶量降低。中药具有清热解毒、抑菌消炎、活血化淤、收敛止血、改善血液循环、增强子宫收缩[9],以及增强机体免疫力的功效[10],并且药物残留低,无毒、刺激性低,并兼有药物与营养剂的双重功效。本试验用的复方中药制剂,原药主要是黄芪、当归、枸杞子、灵芝、党参、益母草等有效成分提取物,按一定浓度配制而成,具有抑菌消炎、改善微循环、增加机体免疫力,提高机体非特异和特异性免疫的功能和兴奋子宫等的作用。中草药在临床中的应用,首先要保证安全可靠,而急性毒性试验是药物安全性评价的重要环节,是任何一类新药都不可缺少的试验项目之一,其试验结果将为药物后续的毒理学试验和药效学评价提供可靠的依据。
3.1 关于药物毒性
根据中草药制剂的有关规定[11],每种中药在两部以上古籍中记载无毒,便视为无毒性作用,该配方中的单味中药在文献《本草》、《别目》、《本草纲目》均未见有毒性记载,说明选取的药物安全可靠。
因药物与毒物之间并不存在绝对的界限,而只能根据动物中毒剂量的大小做相对比较。若剂量过大,会引起动物中毒,用量适当对疾病起到一定的良好疗效。本试验对复方中药制剂进行了急性毒性试验。口服给药时,剂量达到40 000mg/kg体重与对照组差异不显著,且无不良临床症状和死亡。按照药物学急性毒性试验标准[12],在小鼠急性毒性口服试验中,口服剂量>10 000mg/kg体重,在观察108 h后,小鼠健活,则认为该药物安全无毒,由此可证实本试验Dmin=40 000mg/kg复方中药制剂对小鼠安全无毒。而腹腔注射后,由于小鼠腹腔面积相对较大,药物直接以原型的形式进入血液循环[11],其吸收几乎不受吸收部位的影响,并且药物的毒性也不会被机体的消化酶等降解。因此本试验中小鼠会因注射剂量的增大,其死亡率也会随之增大,中毒症状也愈加明显,肝、肾脏的病理变化也随着剂量的增大而增强,这与牛建荣等报道的一致[13]。
3.2 关于急性毒性试验小鼠给药体积及前后体重变化
在急性毒性试验中给药体积的也是非常重要的。啮齿类动物口服给药和腹腔注射的最大体积对水溶性或混悬液一般不超过20mL/kg,小鼠腹腔的最大容积应不超过50mL/kg[14]。因此对给药体积较大的不便一次给完的应将给药剂量等量分配,每隔6h~8h给药一次,在24h内给完。根据药物毒理学急性毒性试验相关规定,此种给药方法安全可行,符合药物毒理学研究规定,基本不影响试验效果。
在急性毒性试验前、中、后(包括试验中死亡动物)应各称取体重一次,以观察给药后的变化。一般认为在保持动物正常饮食及生长环境的条件下,出现体重下降应看做是药物毒效应的一种表现。而引起动物体重减轻的原因比较复杂,譬如药物引起腹泻而影响动物食欲,从而进一步影响了食物的吸收和被利用,或对机体消化机能造成障碍而引起动物厌食或绝食、绝饮,造成肾功能及其他组织脏器的急性损伤,都可能会使动物体重下降。本试验小鼠的体重随药物剂量的增加而出现减轻的趋势,在剖检后发现药物毒性作用于肝脏、肾脏变化较为明显,可认为小鼠的体重减轻可能与肝脏、肾脏的损伤有关。
[1]付尚杰.奶牛产后保健[J].黑龙江畜牧兽医,2013(5):44-47.
[2]史天民,思耀辉,徐文华,等.奶牛产后保健技术概述[J].中国牛业科学,2013(3):22-24.
[3]Lincke A,Drillich M,Heuwieser W.Subclinical endometritis in dairy cattle and its effect on fertility-a review of recent publications[J].Berl Munch Tierarztl Wochenschr,2007,120(5-6):245-50.
[4]王秀芳.2种常见奶牛产后疾病的症状与防治[J].畜牧与饲料科学,2013,34(1):123-124.
[5]Bretzlaff K.Rational effort treatment of endometritis in the dairy cow[J].Vet Clin North Am Food Anim Pract,1987(3):593-607.
[6]莫伟伟.新型奶牛子宫内膜炎中药复方的研制[D].内蒙古呼和浩特:内蒙古农业大学,2006.
[7]徐叔云,卞如濂,陈 修.药理实验方法学[M].2版.北京:人民卫生出版社,1994.
[8]温 赞.补中益气汤和当归四物散对经产奶牛的保健效果观察[J].中国奶牛,2013(9):54-55.
[9]汤春华,礼 中,建 清,等.中草药制剂防治奶牛繁殖障碍疾病的效果[J].江苏农业科学,2001(1):61-62.
[10]陈品球,蒋继琰.中药子宫灌注液治疗奶牛子宫内膜炎的效果观察[J].中兽医学杂志,2006(4):21-22.
[11]陈忠伟,刘 伟,赵 武.复方中药制剂对小鼠的急性毒性试验[J].中国畜牧兽医,2007,34(6):112-113.
[12]陈 申,刘 宇,强 哲,等.苦豆子总碱对小鼠急性毒性试验研究[J].中兽医医药杂志,2013(2):34-36.
[13]牛建荣,李剑勇,等.复方葛黄消炎液刺激性及急性毒性试验[J].动物医学进展,2006,27(7):111-113.
[14]刘昌孝,孙瑞元.药物评价实验设计与统计学基础[M].北京:军事医学科学出版社,1998.