仔猪雷极氏普罗菲登斯菌的分离鉴定及系统进化分析
秦毅斌,何 颖,卢冰霞,李 斌,李莹莹,2,梁家幸,陈忠伟,梁保忠,苏乾莲,周英宁,蒋冬福,黎珂钰,2,卢敬专,赵 武*
(1.广西兽医研究所/广西畜禽疫苗新技术重点实验室,广西南宁 530001;2.广西大学动物科学技术学院,广西南宁 530005)
普罗菲登斯菌(Providencia)属于肠杆菌科普罗菲登斯菌属,广泛分布于土壤、水体、下水道等自然环境以及苍蝇、猫、鸟、狗、牛、羊、企鹅、豚鼠等的体表或肠道[1]。普罗菲登斯菌是条件致病性人兽共患病病原菌,可以引起人和动物尿路感染、伤口感染、眼结膜炎、腹泻、肺炎等多种病症[2-4],此外还可以引起食物中毒[5]。普罗菲登斯菌属包括9个种,分别是P.stuartii、P.rettgeri、P.alcalifaciens、P.rustigianii、P.heimbachae、P.vermicola、P.sneebia、P.burhodogranariea和P.thailandensis[1]。雷极氏普罗菲登斯菌最早在1904年由Rettger在发生类似于禽霍乱的鸡群中分离到,但直到14年后才得以进一步深入研究,并由Hadley命名为P.rettgeri[6]。在人类,P.rettgeri主要引起有尿道留置导管的住院病人的尿路感染、败血症甚至死亡[2-3,7],潜在的儿童腹泻[8]以及较为罕见的角膜炎、泪囊炎、结膜炎等眼部感染[4]。在动物,Ladds P W 和Camus A C等[9-10]各自报道了P.rettgeri可以引起鳄鱼的脑膜脑炎、肺炎、肝炎和败血症;陈永林等[11]从死亡的白鳍鲨鱼腹腔脓液和心血中分离到P.rettgeri,并证实该菌可引起小鼠发病死亡。
普罗菲登斯菌的感染虽然不常见或者通常是医院内感染,但逐渐增多的新型病例已经引起了学者注意。近来的研究表明,普罗菲登斯菌可以引起人的心包炎、心内膜炎、脑膜炎以及犬的皮肤溃疡[3]。值得注意的是,从人和动物分离到普罗菲登斯菌显示有不同程度的抗生素耐药性。本研究首次从发生腹泻的哺乳仔猪内脏器官中分离到了雷极氏普罗菲登斯菌,致病性试验和动物回归试验证实该菌具有致病性,并可引起哺乳仔猪严重腹泻,提示在仔猪腹泻中应注意该菌感染的诊断、监测和防控。
1 材料与方法
1.1 材料
1.1.1 病料来源及试验用动物 4头腹泻严重(部分拉血便)的5日龄哺乳仔猪为广西某规模猪场送检的病猪;25只6周龄的Balb/c小鼠购自广西医科大学实验动物中心;6头5日龄健康仔猪来自本地生产状况良好的猪场。
1.1.2 主要试剂 营养琼脂、麦康凯琼脂、TSA琼脂和SS琼脂培养基,北京路桥技术公司产品;革兰染色液、药敏纸片、微量生化反应鉴定管,杭州天和微生物试剂有限公司产品;细菌基因组、琼脂糖凝胶DNA纯化试剂盒、质粒提取试剂盒提取试剂盒,北京天根生物有限公司产品;氨苄青霉素、2×TaqPCR Master Mix、DNA Marker DL 2 000、BamHⅠ、HindⅢ、pMD18-T载体,TaKaRa公司产品;大肠埃希菌感受态细胞DH5α,由广西兽医研究所/广西畜禽疫苗新技术重点实验室制备保存。
1.1.3 16SrRNA引物 根据细菌16SrRNA通用扩增引物合成扩增引物,序列如下:上游引物P1:5′-AGA GTT TGA TCC TGG CTC AG-3′;下游引物P2:5′-AAG GAG GTG ATC CAG CCG CA-3′。引物由上海英骏生物技术有限公司合成,预计扩增片段长度约为1 500bp。
1.2 方法
1.2.1 流行病学调查 对猪场发病情况进行流行病学调查,了解发病群的日龄、临床症状、发病率和死亡率、病理变化及药物治疗情况。
1.2.2 细菌分离培养及纯化 无菌采集送检病死仔猪肾脏、肝脏、肺脏、肠系膜淋巴结及肠道内容物,接种营养肉汤,37℃培养16h~18h。取培养液涂片,染色镜检,同时划线接种血液琼脂和TSA琼脂,培养18h~24h,观察菌落形态特征。挑取典型菌落,接种营养琼脂、麦康凯琼脂、TSA琼脂和SS琼脂,纯化培养,并进行培养特性鉴定。取纯培养物涂片,革兰染色,观察细菌形态。
1.2.3 生化试验 将分离纯化细菌接种到TSB培养18h~20h,取菌液接种到微量生化管进行葡萄糖、乳糖、麦芽糖、蔗糖、甘露醇、卫茅醇、肌醇、枸橼酸盐、硫化氢、吲哚、尿素、鸟氨酸脱羧酶、赖氨酸脱羧酶、苯丙氨酸脱氨酶生化试验。
1.2.4 药敏试验 取分离纯化的细菌接种于TSB肉汤培养基,37℃振荡培养18h~20h,用TSB肉汤培养基调整菌液浓度至109CFU/mL,将菌液均匀涂布于TSA平板,稍干后取药敏纸片分别平铺在培养基表面,置37℃培养18h~20h,测量抑菌圈直径,依据抑菌圈大小判定标准判定细菌的药物敏感性。
1.2.5 16SrRNA基因序列测定及分析 按照细菌基因组DNA抽提试剂盒说明书提取分离菌DNA,并进行16SrRNA基因扩增。PCR反应体系为50μL,反应条件:95℃4min;94℃30s,55℃30s,72℃90s,35个循环;72℃10min。
PCR产物纯化后与pMD18-T连接,转化大肠埃希菌感受态,鉴定为阳性的重组质粒由上海生工生物生物工程技术服务有限公司测序。将分离菌株的16SrRNA基因序列通过NCBI的Blast检索系统进行序列同源性分析,使用软件与从GenBank数据库中获得的细菌的16SrRNA序列进行多序列匹配排列,采用邻接法构建系统进化树。
1.2.6 致病性试验 取4周龄健康小鼠25只,随机分为5组,每组5只。试验组4组(Ⅰ、Ⅱ、Ⅲ、Ⅳ)小鼠分别腹腔接种5.0×1010、5.0×109、5.0×108、5.0×107CFU/mL不同浓度的菌液,接种量为0.2 mL/只;对照组(Ⅴ)腹腔注射等量灭菌肉汤培养液,隔离饲养。观察记录小鼠发病情况,剖检发病死亡小鼠,并从内脏器官中分离细菌。
1.2.7 动物回归试验 取5日龄健康哺乳仔猪6只,试验组和对照组各3头,分栏隔离饲养,人工奶粉喂养。试验组猪只腹腔接种浓度为5.0×109CFU/mL的菌液2mL,对照组猪只腹腔注射2mL灭菌肉汤培养液。观察记录发病情况,及时剖检发病死亡猪只,记录大体的病理变化,对肝脏、脾脏、肾脏、肺脏、心脏及淋巴结等内脏器官进行细菌分离培养,并对分离细菌进行鉴定。
2 结果
2.1 发病情况调查
2013年12月中下旬,某规模化猪场出现严重腹泻、部分仔猪拉新鲜血样便的病例,其中一栋产房有5窝(共54只)3日龄~7日龄哺乳仔猪发生腹泻、血痢后很快脱水死亡,病死率高达75%以上。发病仔猪在出生时状况良好,第3天开始出现拉稀、水样或血样腹泻、消瘦脱水的症状,一般在发病后24h到3d内死亡,而母猪并无异常表现。通过观察发病猪只的临床症状和剖检变化,显示其病变特征基本一致。病理剖检显示肾脏表面有大量点状出血,肠道、肠系膜淋巴结肿大出血,肠内有鲜红色液体。
2.2 细菌分离培养结果
采集发病猪的内脏器官进行了病毒检测和细菌分离。病毒检测结果均为阴性,排除了几种导致腹泻的病毒感染的可能性。而从所有送检发病猪肾脏、肝脏、脾脏、肺脏、肠系膜淋巴结均分离到一种革兰阴性杆菌。挑取典型的菌落进行纯化培养观察,分离菌株在TSA平板上培养18h~20h可见直径约1mm~2mm的黏液状菌落,呈灰白色、圆形、隆起、表明光滑、边缘整齐、不透明、湿润、黏稠,以铂金环挑取易拉成丝;随着培养时间的延长,菌落边缘有迁徙生长现象;分离菌株为兼性厌氧菌,在普通琼脂平板、麦康凯琼脂、牛血清琼脂平板、鲜血琼脂上生长良好;普通肉汤呈均匀浑浊;鲜血琼脂上未出现溶血圈。
2.3 染色镜检结果
分离菌染色镜检为革兰阴性、两极着色的杆菌,多单个存在,少数成对或个别短链排列,有鞭毛。
2.4 分离菌株生化特征鉴定
分离菌株发酵葡萄糖,产酸产气;可发酵甘露醇、肌醇,不发酵乳糖、麦芽糖、蔗糖和卫茅醇;尿素酶为阳性;赖氨酸脱羧酶、鸟氨酸脱羧酶、苯丙氨酸脱氨酶、枸橼酸盐、吲哚、H2S试验均为阴性(表1)。

表1 分离菌株生化试验结果Table 1 Biochemical characteristics of isolated strain
2.5 分离菌株药物敏感性试验结果
药敏试验结果表明,在测定的29种药物中,分离菌株对头孢哌酮钠、头孢噻肟钠、头孢曲松钠、头孢唑啉、头孢呋肟、头孢吡肟、阿莫西林、链霉素、氨曲南、洛美沙星、诺氟沙星、左氟沙星、恩诺沙星、大观霉素、卡那霉素、氨苄青霉素、米诺环素、氯霉素和阿米卡星等19种药物敏感,占试验药物的65.5%;对四环素、青霉素中敏,占6.9%;对利福平、多黏菌素B、新生霉素、复方新诺明、亚胺培南、奥普托欣、克林霉素、万古霉素其他8种药物均耐药,占27.6%(表2)。
2.6 16SrRNA基因的扩增及酶切鉴定
以提取的分离菌株基因组为模板,P1、P2为引物进行16SrRNA基因PCR扩增,结果扩增出一条约1 532bp的条带。将PCR纯化产物与pMD18-T载体连接,并转入大肠埃希菌感受态细胞,提取重组质粒进行BamHⅠ、HindⅢ双酶切鉴定,可见2条条带,大小分别约为1 500bp和2 600bp,其中1 500bp的条带即为16SrRNA基因片段(图1)。
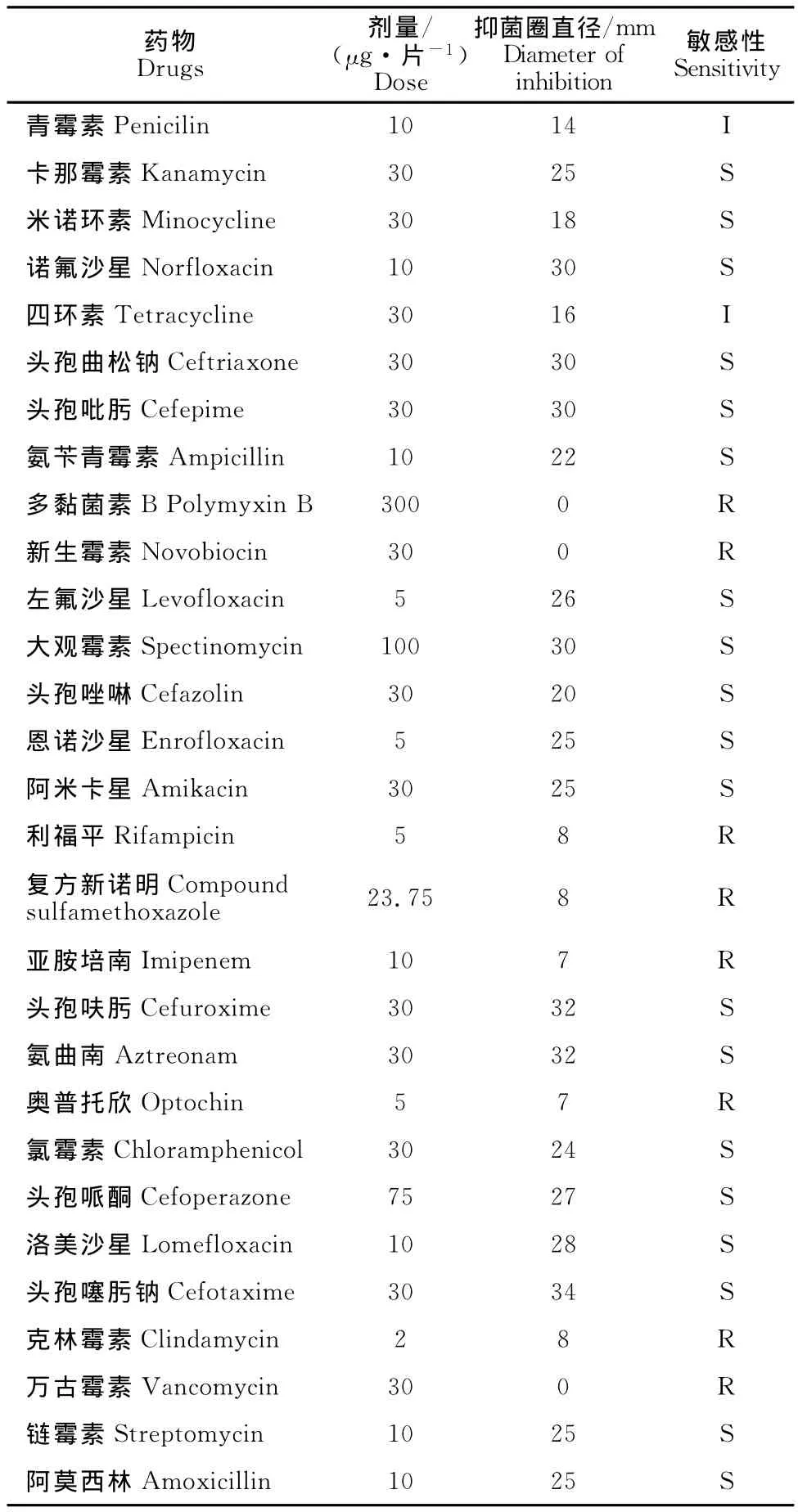
表2 分离菌株药敏试验结果Table 2 Drug sensitivity test of isolated strain

图1 16SrRNA基因重组质粒的PCR、酶切鉴定Fig.1 PCR and restriction enzyme analysis of the recombinant plasmid with 16SrRNA gene
2.7 16SrRNA的遗传进化分析
分离菌株16SrRNA基因测序结果在Gen-Bank中进行Blast比对分析,结果表明与其同源性最高的序列为普罗威登斯属各菌种的16SrRNA序列。将分离菌株与普罗威登斯属各代表种26株的16SrRNA基因序列,用DNA Star软件进行同源性分析,利用MEGA4.0软件的N-J法绘制系统进化树。同源性结果显示,分离菌株与本属26株代表菌的同源性在95.9%~99.6%之间;与雷极氏普罗威登斯菌代表菌的同源性在97.3%~99.6%之间,其中与雷极氏普罗威登斯菌DSM 4542株同源性最高,为99.6%。遗传进化分析显示,分离菌株与雷极氏普罗威登斯菌关系最为密切,同处一个进化分支。由此证明该菌为P.reggteri,并命名为Guangxi 2013株(图2)。
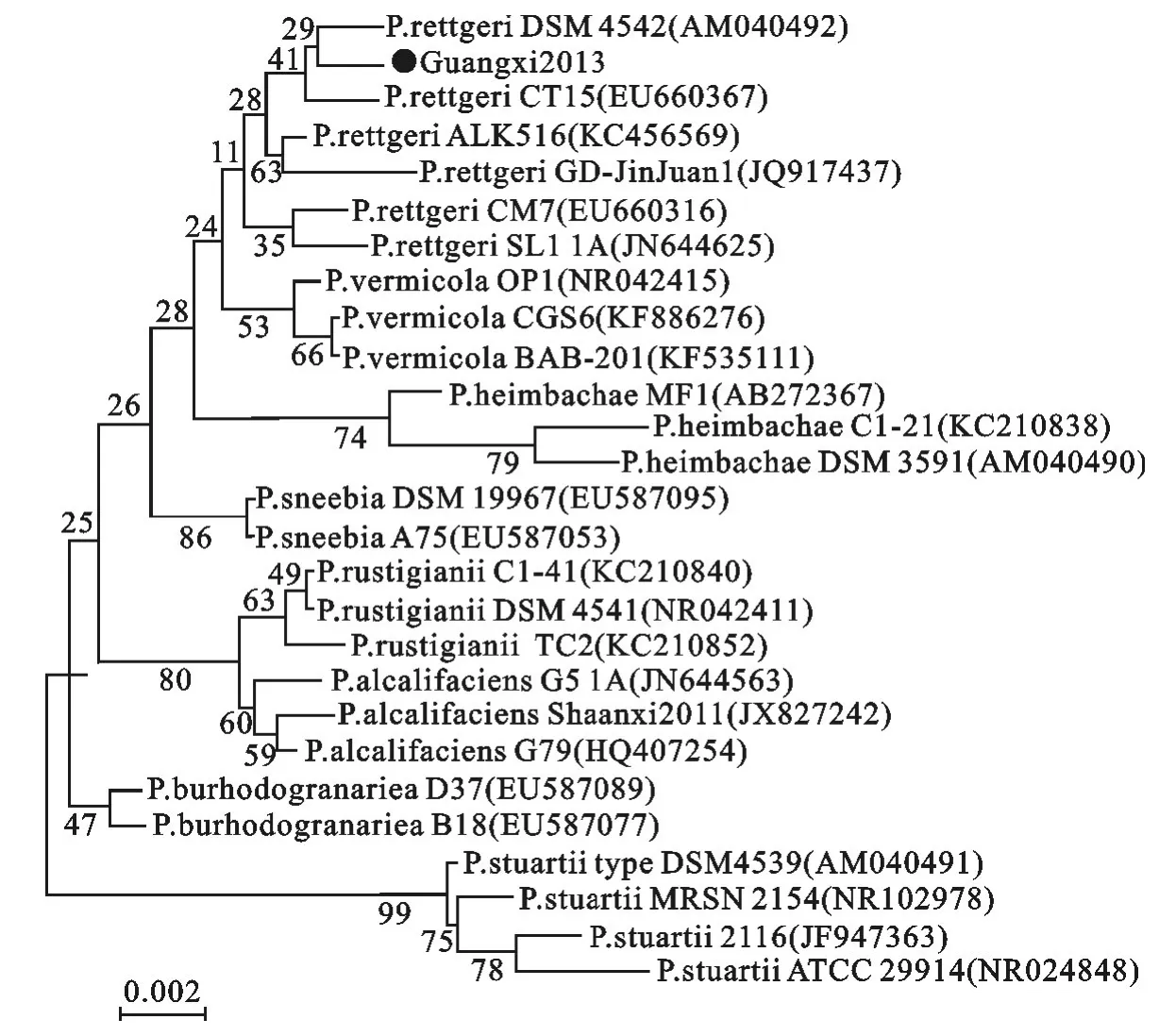
图2 Guangxi 2013分离菌16SrRNA基因系统进化树Fig.2 Phylogenetic tree based on 16SrRNA gene of Guangxi 2013isolate
2.8 致病性试验结果
致病性试验结果显示,分离菌可引起小鼠发病,试验组小鼠在攻毒2h后出现精神沉郁、呼吸急促等症状。试验组Ⅰ(1.0×1010CFU)小鼠在攻毒后24h~36h全部死亡;试验组Ⅱ(1.0×109CFU)4只小鼠在攻毒后30h~48h内死亡,1只存活;试验组Ⅲ(1.0×108CFU)、试验组Ⅳ(1.0×107CFU)所有小鼠均存活;对照组小鼠均健活(表3)。剖检死亡小鼠,发现肝脏、肾脏肿大;肠道、肠系膜淋巴结出血。死亡小鼠的心、肝、脾、肺、肾等器官中均分离到细菌,革兰染色镜检显示,分离菌与接种菌是完全相同的细菌。
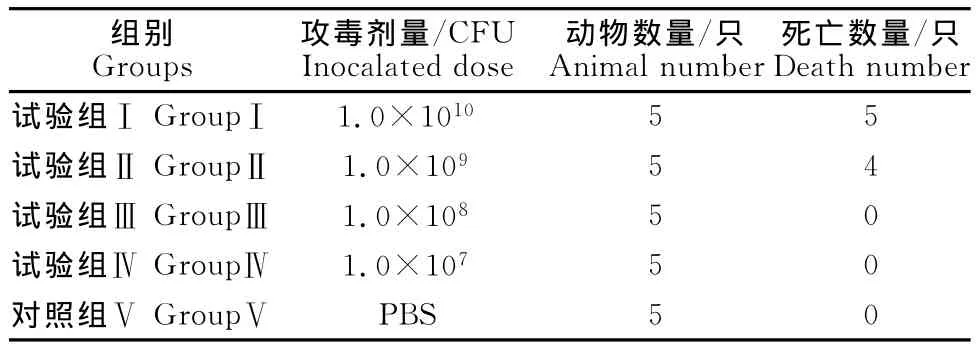
表3 致病性试验结果Table 3 Pathogenicity of strain Guangxi 2013in mice
2.9 动物回归试验结果
动物回归试验显示,5日龄哺乳仔猪在接种1.0×1010CFU剂量的分离菌后出现了严重的临床症状。所有试验组仔猪在接种分离菌6h后出现精神沉郁、食欲减退、腹泻等症状,与临床所见的症状基本一致又有所不同,即没有看到拉血便的症状;所有试验组仔猪在接种后36h内全部死亡,而对照组仔猪未见异常。剖检死亡仔猪,大体病理变化为肾脏表面有出血点,肠系膜淋巴结肿大出血,肠道出血(图3A)。死亡仔猪的心、肝、脾、肺、肾等器官中均分离到与攻毒细菌一样的形态特征和生化特性的细菌。

图3 Guangxi 2013分离菌攻毒仔猪肠道病变Fig.3 Gross lesions of intestines of the inoculated pigs
3 讨论
普罗菲登斯菌属细菌是一种运动型的、有菌体外周鞭毛的革兰阴性杆菌。在目前发现的普罗菲登斯菌属9个种当中,大多数都被证实具有致病性。P.stuartii、P.rettgeri可导致有尿道留置导管的住院病人的尿路感染[2];P.rettgeri还可引起人的眼部感染,潜在的儿童腹泻及鳄鱼的脑膜脑炎、肺炎、肝炎和败血症[4,8-10]。P.alcalifaciens、P.rustigianii和P.heimbachae均是人和动物肠道的定植者,它们是公认的引起胃肠炎的病原[2-3]。P.vermicola最初从线虫中分离得到[12],近来的研究显示其可引起鲤鱼的腹部皮肤溃疡和腹鳍发红等病变[1]。其余的普罗威登斯菌都是新近发现的,P.sneebia和P.burhodogranariea均是从野生果蝇的淋巴细胞中分离到的新物种,P.thailandensis是从海产品加工过程的废水中分离鉴定的,目前还没上述3种普罗菲登斯菌的致病性报道。
目前,有关普罗威登斯菌的检测通常采用传统的细菌分离、生化反应进行鉴定,但不同分离菌株的生化特征可能存在一定的差异。普罗威登斯菌属各种细菌拥有共同的生化特性:发酵葡萄糖、甘露糖,不发酵乳糖、卫茅醇、山梨醇;赖氨酸脱羧酶、鸟氨酸脱羧酶、精氨酸双水解酶、硫化氢、V-P试验为阴性,苯丙氨酸脱氨酶、硝酸盐还原阳性。而尿素酶阳性,赤藻糖、甘露醇、阿拉伯醇、核糖醇和纤维醇产酸阳性是P.rettgeri区分于同属其他细菌的重要特征[6,13]。本研究中的分离菌株生化特性中除了苯丙氨酸脱氨酶阴性外,其余特性与上述的P.rettgeri生化特性相符,从生化特性上来看可以初步鉴定分离菌为P.rettgeri。
随着分子生物学技术的不断发展,16SrRNA基因扩增和序列分析技术已成为细菌检测和鉴定的一种强有力工具。通过对高度保守性和特异性的16 S rRNA进行同源性比较分析,可以判定不同菌属、菌种间遗传关系的远近;通过基因序列的差异来鉴定种属,还可以发现细菌新的种类[14]。因此,从基因的角度来研究细菌的分类更加精确。对16S rRNA基因的遗传进化分析显示,本研究分离菌株与26株普罗威登斯菌代表菌株的同源性在95.9%~99.6%之间;与P.rettgeriDSM 4542等代表菌株关系最为密切,同源性在97.3%~99.6%之间,处于同一个进化分支;从基因水平证实了该菌为P.reggteri。
小鼠致病性试验和动物回归试验均证实,该分离菌具有较强致病力;在试验组仔猪接种分离菌后6h出现精神沉郁、食欲减退、腹泻等症状,但没有见到临床出现的拉血便的症状,这可能是在复杂的养猪生产实际中感染P.reggteri后可能会表现出更为严重的症状。
对于细菌性感染病例最有效的治疗途径是对分离细菌进行药物敏感性测定后采用敏感药物治疗。在本试验测定的20多种常用药物中,分离菌株对头孢菌素类、喹诺酮类、氨基糖苷类及氨苄青霉素、阿莫西林、氨曲南、米诺环素、氯霉素等19种药物敏感;有2种药物中度敏感;有8种药物不敏感,占测定药物的27.6%,这表明分离菌株对部分药物具有较高抗药性。这与Stock I等[15]报道的普罗菲登斯菌药敏结果较为一致。
由于抗菌药物的广泛及不合理的使用,普罗菲登斯菌的耐药性已经越来越普遍和严重,成为临床关注的重点,通常造成对耐药菌株感染病例的治疗花费增加及延误治疗。细菌产生的由质粒基因介导的超广谱β-内酰胺酶(extended-spectrumβ-lactamases,ESBLs)是导致其对广谱β-内酰胺类抗生素产生耐药性的重要机制,ESBLs能够水解多数广谱β-内酰胺类抗生素,从而使其失去抗菌作用[16]。P.stuartii是普罗菲登斯菌属细菌中耐药性最为严重的菌种。意大利的调查显示,约有36.7%的P.stuartii菌株产ESBLs,产ESBLs的P.stuartii菌株数占所有产ESBLs肠道细菌菌株总数的10%,对阿莫西林-克拉维酸、氨苄西林-舒巴坦等药物耐药较为严重[17];而来自意大利某大学医院的连续4年的监测显示,产ESBLs的P.stuartii菌株数占P.stuartii分离菌株的53%,且呈逐年上升的趋势[18]。
本研究首次从发生腹泻的哺乳仔猪内脏器官中分离到了P.reggteri,将该分离菌接种哺乳仔猪后成功复制了哺乳仔猪腹泻、死亡的病例。因此,对P.reggteri这一重要的条件致病性人兽共患病病原菌引起的感染应该引起重视,并加强对其诊断、监测和防控措施。
[1]Ramkumar R,Ravi M,Jayaseelan C,et al.Description ofProvidenciavermicolaisolated from diseased Indian major carp,Labeorohita(Hamilton,1822)[J].Aquaculture,2014,420-421:193-197.
[2]Manos J,Belas R.The generaProteus,Providencia,andMorganella[J].Prokaryotes,2006,6:245-269.
[3]Wang X L,Wang J Q,Hao H F,et al.PathogenicProvidencia alcalifaciensstrain that causes fatal hemorrhagic pneumonia in piglets[J].Curr Microbiol,2014,68:278-284.
[4]Koreishi A F,Schechter B A,Karp C L.Ocular infections caused byProvidenciarettgeri[J].Ophthalmology,2006,113(8):1463-1466.
[5]Murata T,Iida T,Shiomi Y,et al.A large outbreak of foodborne infection attributed toProvidenciaalcalifaciens[J].J Infect Dis,2001,184(8):1050-1055.
[6]O'Hara C M,Brenner F W,Miller J M.Classification,identification,and clinical significance ofProteus,Providencia,andMorganella[J].Clin Microbiol Rev,2000,13(4):534-546.
[7]Kaslow R A,Lindsey J O,Bisno A L,et al.Nosocomial infection with highly resistantProteusrettgeri.Report of an epidemic[J].Am J Epidemiol,1976,104(3):278-286.
[8]Shima A,Hinenoya A,Asakura M,et al.Prevalence ofProvidenciastrains among children with diarrhea in Japan[J].Jpn J Infect Dis,2012,65(6):545-547.
[9]Ladds P W,Bradley J,Hirst R G.Providenciarettgerimeningitis in hatchling saltwater crocodiles(Crocodylusporosus)[J].Aust Vet J,1996,74(5):397-398.
[10]Camus A C,Hawke J P.Providenciarettgeri-associated septicemia and meningoencephalitis in juvenile farmed American alligatorsAlligatormississippiensis[J].J Aquat Anim Health,2002,14:149-153.
[11]陈永林,张成林,闫 鹤,等.白鳍鲨雷极氏普罗菲登斯菌的分离鉴定与药敏试验[J].中国兽药杂志,2010,44(6):48-50.
[12]Somvanshi V S,Lang E,Straaubler B.Providenciavermicolasp.nov.,isolated from infective juveniles of the entomopathogenic nematodeSteinernemathermophilum[J].Int J Syst Evol Microbiol,2006,56,629-633.
[13]Farmer J J,Davis B R,Hickman-Brenner F W,et al.Biochemical identification of new species and biogroups of enterobacteriaceae isolated from clinical specimens[J].J Clin Microbiol,1985,21(1):46-76.
[14]刘文强,贾玉萍,赵宏坤.16SrRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2006,27(11):15-18.
[15]Stock I,Wiedemann B.Natural antibiotic susceptibiIity ofProvidenciastuartii,P.rettgeri,P.alcalifaciensandP.rustigianiistrains[J].J Med Microbiol,1998,47:629-642.
[16]赵成坚,黄 勇,谷颖乐,等.银环蛇奇异变形杆菌的分离鉴定与药敏试验[J].动物医学进展,2013,34(12):213-217.
[17]Tumbarello M,Citton R,Spanu T,et al.ESBL-producing multidrug-resistantProvidenciastuartiiinfections in a university hospital[J].J Antimicrob Chemother,2004,53:277-282.
[18]Luzzaro F,Mezzatesta M,Mugnaioli C,et al.Trends in production of extended-spectrum beta-lactamases among enterobacteria of medical Interest:Report of the Second Italian Nationwide Survey[J].J Clin Microbiol,2006,44:1659-1664

