氧化琼脂的合成及性能表征
夏 凯 赵镜琨 安兴杰 刘 馨
(青岛大学化学科学与工程学院 山东 青岛:266071)
琼脂又称琼胶、洋菜、冻粉,按中华人民共和国药典定义, 琼脂是一种从某些海藻萃取的亲水胶体[1]。琼脂为多糖类物质,以半乳糖为基础单位,在其分子的长链上存在不同程度的硫酸酯基团。琼脂为可溶性植物纤维,它不溶于冷水,但能吸水膨胀,能溶于沸水,其溶液冷却后形成胶冻(凝胶)[2]。琼脂水溶液形成凝胶时不需要其他任何化学物质的帮助,而且在相同的浓度时其水溶液所形成的胶冻的凝胶强度比其他任何胶凝剂所形成的胶冻的凝胶强度高。琼脂由于具有很好的胶凝性和凝胶稳定性,广泛用于食品、医药、日用化工、生物工程等许多方面[3]。琼脂早已被美国食品药物管理条例列为公认安全的产品,获准作为食品添加剂载入食品化学品药典之中,被联合国粮农组织确认为21世纪健康食品。目前对氧化琼脂的报道极少,本文对自制的氧化琼脂从凝胶性能、旋光度、粘度、冷冻干燥扫描电镜、质构、热重等方面进行了性能表征。
1 实验材料与方法
1.1 实验材料与设备
101A-1型干燥箱,上海实验仪器总厂;FD1冷冻干燥机,北京博医康实验仪器有限公司;凝胶强度测试仪,中国海洋大学;WZZ-2A型自动旋光仪,上海精科物理光学仪器厂;Brookfield LVT旋转粘度计,美国Brookfield公司;扫描电子显微镜(JSM-840),日本Jeol公司; TA-XT2i质构仪,英国Surrey公司;热重分析仪,北京精仪高科仪器有限公司。
琼脂(食品级);30%过氧化氢(AR);氢氧化钠(AR);硫酸亚铁(AR);盐酸(AR)。
1.2 氧化琼脂的制备工艺
在四口烧瓶中加入固含量为15%的琼脂水分散液300g,加入适量催化剂硫酸亚铁,开动搅拌并升温到46℃,调节并保持pH值在7.5-7.8范围内后,在30min内均匀滴加入30%双氧水溶液2.25g,滴加完毕后继续保温反应3h,反应完成后降至室温,并调pH至6.5-7,用适量还原剂消除过量双氧水,过滤、洗涤、完全烘干,制得氧化琼脂样品1。在相同制备条件下,改变双氧水用量为4.5g,制得氧化琼脂样品2。
1.3 氧化琼脂的性能测试
1.3.1 氧化琼脂的羧基含量测定
氧化琼脂的羧基含量测定方法参照热糊滴定法[4]。
1.3.2 氧化琼脂的凝胶温度、凝胶再溶温度和凝胶强度
将氧化琼脂与原料琼脂分别配制为质量分数1.5%溶液,加热溶解、冷却后,测试凝胶温度、凝胶再溶温度、凝胶强度。凝胶温度、再溶温度测试方法参照Freile-Pelegrin and Robledo[5]。凝胶样品室温放置12h后,使用凝胶强度测试仪测定凝胶强度。
1.3.3 旋光测试
精确称取0.01g氧化琼脂(样品2)于20mL蒸馏水中加热溶解,用WZZ-2A型自动旋光仪于不同温度下测定旋光值。测试时,从70℃逐渐降温,测试试管保持水浴恒温10min后测定旋光值。原料琼脂作对照试验。
1.3.4 粘度测试
分别称取1.50g琼脂干粉和氧化琼脂样品,配制为质量分数1.5%的溶液,加热溶解,恒温水浴中从70℃逐渐降温,测定不同温度下的粘度值,绘制粘温曲线。
1.3.5 冷冻干燥扫描电镜
将氧化琼脂与原料琼脂分别配制为质量分数1.5%溶液,加热完全溶解后,自然冷却至室温形成凝胶,继续室温放置12h,得到测试凝胶样品。将测试凝胶样品于-25℃预冻3h,然后用FD1冷冻干燥机进行冷冻干燥(约36h),将干燥完全后的样品观察面表层切割除去,然后用导电胶带将样品粘在扫描电镜样品台上用离子溅射镀膜仪进行镀金处理,处理好的样品放入样品盒扫描观察。
1.3.6 质构性能测试
凝胶样品(按1.3.3中所述方法制备)采用TA-XT2i质构仪进行质构测定,主要参数如下,运行模式:Texture Profile Analysis(TPA),测试速度:1.0 mm/s,压缩比:50%,探头圆柱表面积1.0 cm2,每个样品测定3次。质构参数的具体定义如郝红涛[6]所述。
1.3.7 热重分析测试
将测试样品放入恒湿干燥器中至少恒湿48h.然后称取样品约10mg置于样品池中,并在高纯氮气气氛中进行热重分析。热重分析升温范围为25~600℃,升温速率为5℃/min。氮气流速为20mL/min。根据失重率与温度的变化关系做出热重曲线(TG)。
2 结果与讨论
2.1 氧化琼脂的凝胶温度、凝胶再溶温度和凝胶强度
分别测试原料琼脂和氧化琼脂的凝胶温度、凝胶再溶温度和凝胶强度,结果如表1所示。
由表1可以看出:琼脂氧化后,琼脂的凝胶温度、凝胶再溶温度和凝胶强度均有不同程度的下降,而且随着氧化深度的增加,下降程度逐渐增大。这说明氧化改性琼脂会对其物理性质产生影响。
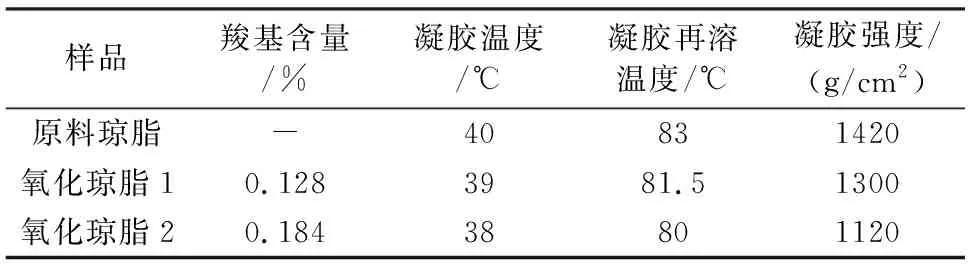
表1 氧化琼脂与原料琼脂的凝胶温度、凝胶再溶温度和凝胶强度测试
2.2 旋光度测试
琼脂溶液形成凝胶的机理是由于分子间形成双螺旋结构,并相互聚集而引起的[7]。当琼脂溶胶冷却时,琼脂分子相互作用形成双螺旋体,进一步冷却,双螺旋体进一步聚集而生成较硬的凝胶。图1为氧化琼脂(样品2)与原料琼脂的旋光度随温度变化曲线图。
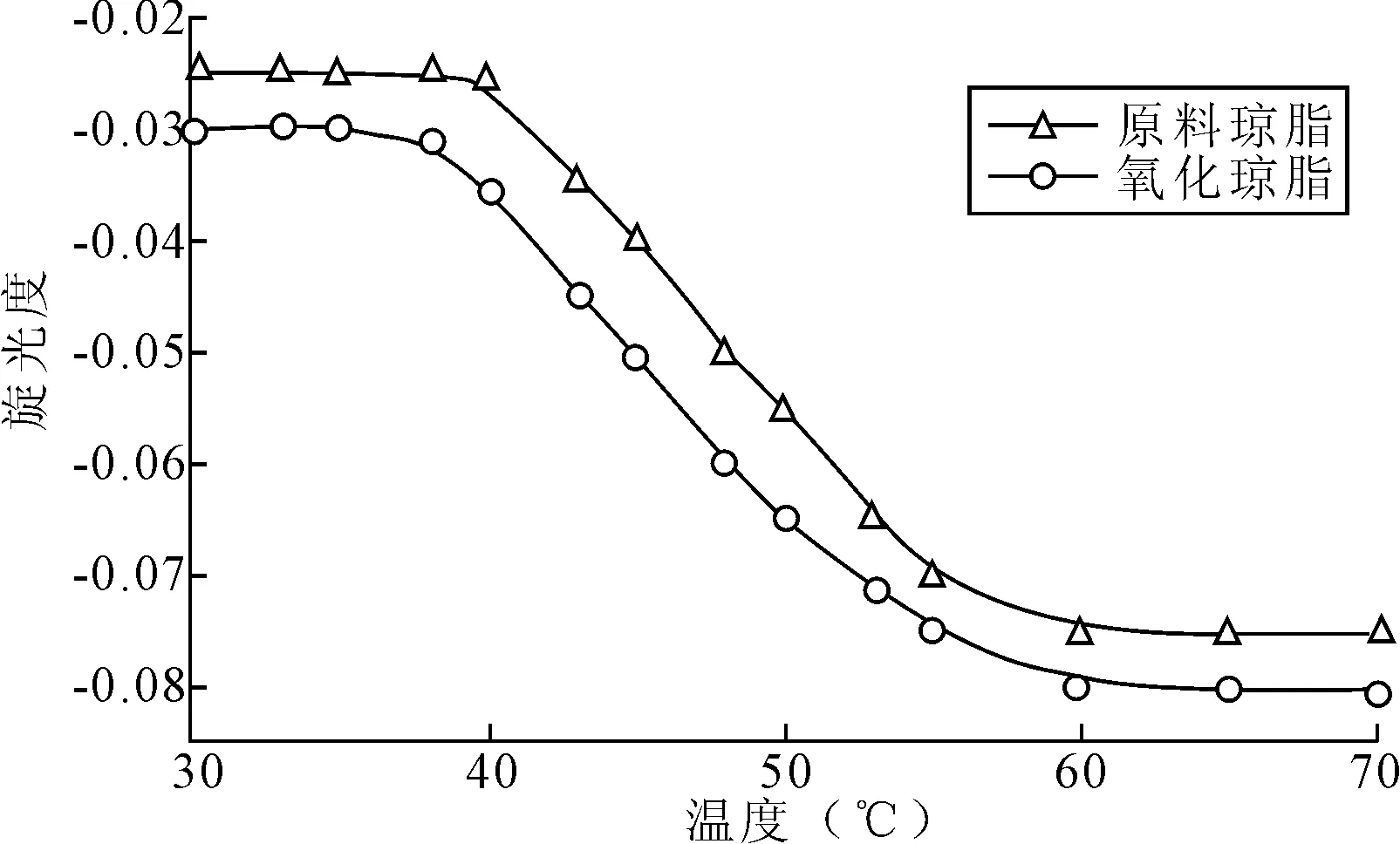
图1 氧化琼脂与原料琼脂的旋光度随温度变化图
由图1可以看出,琼脂溶胶的旋光度为负值,说明琼脂分子组成中L-半乳糖组分要大于D-半乳糖组分,并且在相同温度下原料琼脂的旋光度比氧化琼脂的旋光度大。当温度高于60℃时,琼脂分子基本上是以单分子状态存在,为随机线团,在水相中呈无序态,随着温度的降低,旋光度保持不变;当溶液温度进一步降低到60℃以下时,琼脂分子开始相互作用形成双螺旋体,并开始相互聚集;此时溶液旋光度开始随着温度下降而快速增大;当温度降低至40℃时,溶液旋光度达到最大值,温度继续下降,溶液旋光度变化不大。说明此时溶液中由琼脂分子形成的双螺旋结构已经完成相互聚集,形成了硬凝胶。此外,从图1中还可以看出,在温度低于40℃时,原料琼脂溶液的旋光度基本保持不变,而氧化琼脂溶液在低于38℃时,其旋光度才基本保持不变,说明氧化后,琼脂的凝胶形成温度降低。
2.3 表观粘度测试
图2为氧化琼脂与原料琼脂溶液的粘温曲线图。由图2可以看出,随着温度的降低,三只样品的溶液表观粘度均逐渐变大。相同温度时,氧化琼脂溶液的表观粘度小于原料琼脂溶液的表观粘度,而且羧基含量越大氧化琼脂溶液的表观粘度越小。在温度高于50℃时,原料与氧化琼脂溶液的表观粘度增加很小,当温度进一步降低时,三只样品溶液的表观粘度开始随温度降低而急剧增加,说明此温度下,样品溶液中琼脂分子开始形成凝胶,其中原料琼脂溶液形成凝胶速度最快,氧化琼脂1溶液次之,氧化琼脂2溶液最慢。根据Plashchina等的理论研究,当∂η/∂T→∞(η为表观粘度)时,可认为该温度为凝胶形成温度[8]。所以从图2可以得出,原料琼脂、氧化琼脂1、氧化琼脂2的凝胶形成温度分别为39℃、38℃、37℃,这与表1中所测得的凝胶温度基本符合。
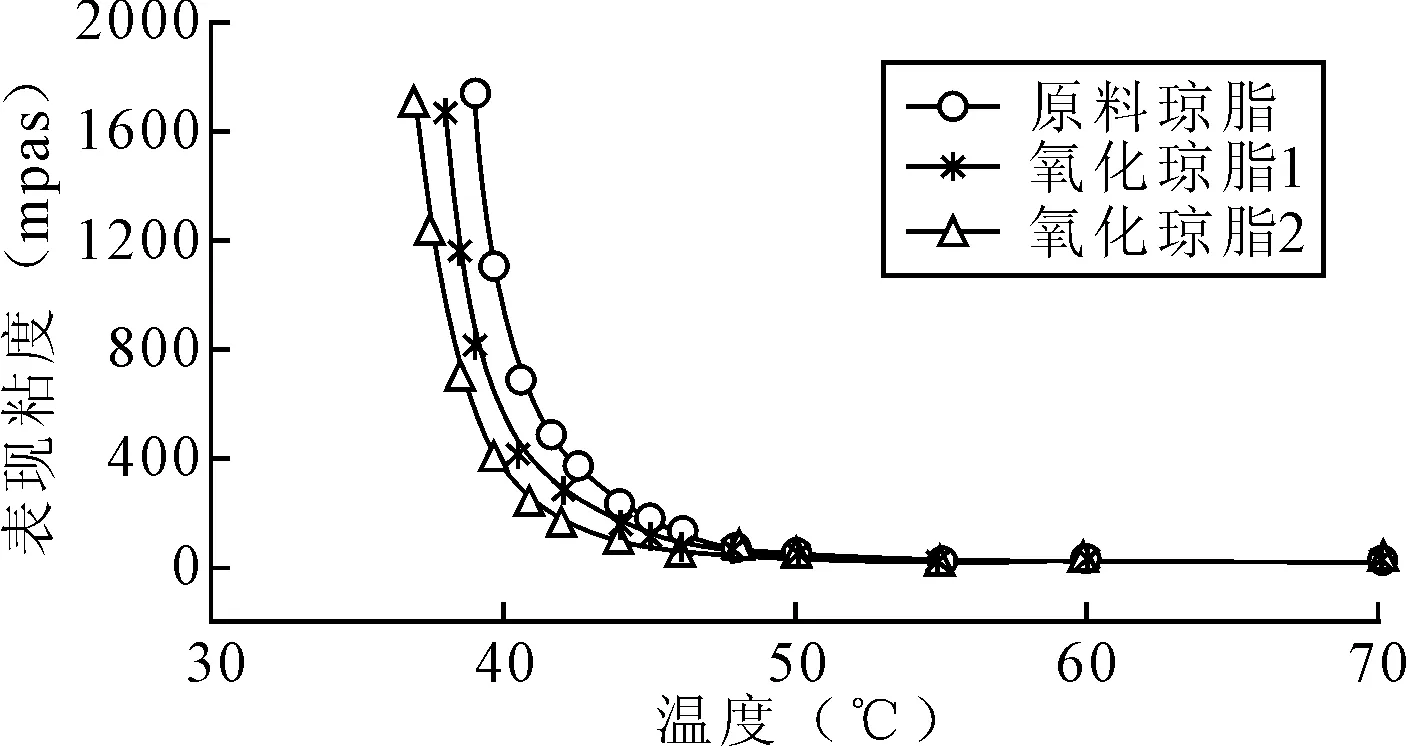
图2 氧化琼脂与原料琼脂的粘温曲线图
2.4 扫描电镜分析
图3是原料琼脂与氧化琼脂(样品2)的凝胶冷冻干燥扫描电镜图。由图3可以看出,原料琼脂与氧化琼脂的凝胶骨架结构均为多孔网状结构。其孔隙是由琼脂凝胶经真空冷冻干燥后凝胶中的冰晶升华所产生的。对比图3中(a)和(b)可以看出,琼脂氧化后,其多孔凝胶骨架结构的孔隙变小变密,致密的凝胶骨架结构,具有更好的毛细作用[9],从而使得氧化琼脂具有更加良好的保水性能。

图3 氧化琼脂与原料琼脂的凝胶冷冻干燥扫描电镜图
2.5 质构性能分析
由表2可以看出,随着氧化琼脂羧基含量的增加,凝胶样品的硬度、脆性、弹性和咀嚼性都逐渐降低,而内聚性却逐渐增加。这说明随着氧化深度的增加,琼脂凝胶抵抗外力,保持原有形状能力减弱,在承受相同外力作用下,氧化琼脂凝胶更容易破碎为小的碎片[10],这点可由图3所示的氧化琼脂凝胶多孔骨架结构随氧化深度增加,其孔隙变小变密的结论给予支持。
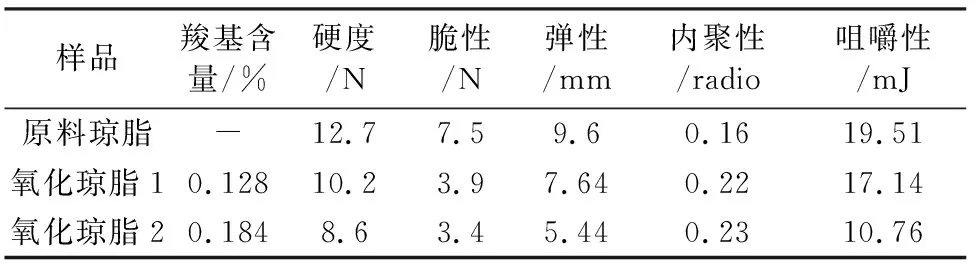
表2 氧化琼脂与原料琼脂的质构参数测试结果
2.6 热重分析
图4是原料琼脂与氧化琼脂(样品2)的热重曲线图。从图4(a)可以看出,25~130℃,原料琼脂失重率达18%,这主要是琼脂所含水分的重量损失;温度升至270℃后,失重率迅速增加,这是由琼脂的降解所引起的;最终原料琼脂的残渣质量为20%。从图4(b)可以看出,25~150℃,氧化琼脂的失重率达20%,这部分的重量损失同样为样品所含的水分;温度高于270℃后,氧化琼脂同样开始降解;最终氧化琼脂的残渣质量为22%。比较2条曲线可以看出,琼脂氧化后含湿率高,失水速率慢,保水性增强,而热稳定性基本不变。
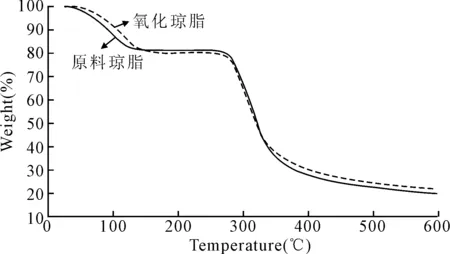
图4 氧化琼脂与原料琼脂的热重曲线图
3 结论
本文以双氧水为氧化剂制备了氧化琼脂,并测试了其性能。测试结果表明,氧化琼脂的凝胶温度、凝胶再溶温度、凝胶强度随羧基含量的增加而降低。氧化后琼脂的水溶液的旋光度值与表观粘度值均下降。氧化琼脂凝胶具有更致密的网络骨架结构。质构特性参数中硬度、脆性、弹性、咀嚼性随氧化琼脂的羧基含量增加而逐渐降低,而内聚性却逐渐增加。热重分析显示,琼脂氧化后,其的热稳定性基本保持不变,但其保水性增强。
[1] 中华人民共和国卫生部药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:911.
[2] 王铭和.琼胶和卡拉胶的生产和应用[M].海洋出版社,2001:1-12.
[3] 李琴梅,戚勃.琼脂的物化特性及其在食品工业中的应用[J].中国食品添加剂,2009,(6):170-174.
[4] 冯国涛,陈慧,单志华.双氧水对淀粉氧化程度影响的研究[J].皮革科学与工程,2005,15(2): 46-50.
[5] Freile-Pelegrín Y, Robledo D. Influence of alkali treatment on agar from Gracilaria cornea from Yucatan, Mexico[J].Journal of applied Phycology,1997,9(6):533-539.
[6] 郝红涛,赵改名,柳艳霞,等.肉类制品的质构特性及其研究进展[J].食品与机械,2009,25(3):125-128.
[7] Arnott S, Fulmer A, Scott W E, Dea I C M, Moorhouse R, Rees D A. The agarose double helix and its function in agarose gel structure[J]. Journal of Molecular Biology,1974,90(2):269-284.
[8] Plashchina I G, Muratalieva I R, Braudo E E, Tolstoguzov V B. Studies of the gel formation of κ-carrageenan above the coil-helix transition temperature range[J]. Carbohydrate Polymers,1986,6(1):15-34.
[9] Mao R, Tang J, Swanson B G. Water holding capacity and microstructure of gellan gels [J]. Carbohydrate polymers,2001,46(4):365-371.
[10] Marshall S G, Vaisey M. Sweetness perception in relation to some textural characteristics of hydrocolloid gels[J]. Journal of Texture Studies,1972,3(2):173-185.

