姜黄素作用PTEN/PI3K/AKT通路诱导食管癌EC109细胞凋亡*
李秀娟, 李玉珍, 金春亭, 范 婕, 李海军
(河北北方学院病理教研室, 河北 张家口 075000)
姜黄素作用PTEN/PI3K/AKT通路诱导食管癌EC109细胞凋亡*
李秀娟△, 李玉珍, 金春亭, 范 婕, 李海军
(河北北方学院病理教研室, 河北 张家口 075000)
目的:研究姜黄素作用食管癌的分子机制。方法:体外培养人食管癌细胞(EC109),15~120 μmol/L姜黄素处理后,采用CCK-8法检测姜黄素对细胞的增殖抑制作用,透射电镜观察细胞超微结构,Annexin V-FITC/PI双染激光共聚焦显微镜观察细胞凋亡,流式细胞术分析15~120 μmol/L姜黄素作用EC109细胞后PTEN/PI3K/AKT通路相关蛋白PTEN、AKT、GSK3β和Caspase 3的表达水平。结果:CCK-8检测结果姜黄素能显著抑制EC109细胞的增殖,呈剂量和时间效应关系;透射电镜和激光共聚集显微镜观察发现姜黄素能使EC109细胞发生凋亡;流式细胞仪蛋白水平分析显示姜黄素可增强细胞中PTEN、GSK3β和Caspase 3的表达,抑制AKT的表达。结论:姜黄素抑制EC109细胞的增殖并促进其凋亡的生物学效应与增强PTEN的表达抑制PI3K/AKT信号通路有关。
姜黄素;PTEN/PI3K/AKT通路;食管癌
姜黄素是从姜黄属植物姜黄的根茎中提取的一种植物多酚,由于其抗炎、抗氧化、降血脂、抗动脉硬化及抗肿瘤等广泛的药理作用日益受到研究者的重视[1]。有资料显示[2-3]姜黄素抗肿瘤的作用通过诱导肿瘤细胞凋亡实现,但其发挥生物学作用的精确靶点目前还不十分清楚。肿瘤发生过程中抑癌基因PTEN 的突变使其丧失了调节PI3K/AKT通路的能力,细胞增殖失去控制,从而引起癌变。目前在建立的小鼠模型中已经观察到该通路异常所导致的细胞转化和肿瘤发生[4],但姜黄素诱导食管癌EC109细胞凋亡的过程中是否有该通路的参与还不明确。本研究旨在探讨PTEN/PI3K/AKT通路在姜黄素诱导食管癌EC109细胞凋亡中的作用,进一步明确姜黄素诱导EC109细胞凋亡的作用途径。
1 材料与方法
1.1 材料
姜黄素购自美国Sigma公司,溶解于二甲基亚枫(DMSO)中配成浓度为10 mmol/L的母液,-20℃避光保存。 CCK-8试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技有限公司。鼠抗人单克隆抗体PTEN、鼠抗人单克隆抗体AKT、兔抗人单克隆抗体GSK3β、鼠抗人单克隆抗体Caspase 3及羊抗鼠、羊抗兔FITC-IgG抗体均为Jackson Immunoresearch Laboratiries Inc公司产品。
人食管癌EC109细胞株由河北北方学院生命科学研究中心细胞室提供,细胞复苏后置于含10%胎牛血清的1640培养基中,在37℃、5%CO2及湿度饱和的条件下培养。培养基每24小时更换一次,待细胞生长融合率达到80%时0.25%胰酶消化、传代,选用状态良好处于对数生长期的三代细胞进行实验。
1.2 细胞增殖抑制实验
EC109细胞胰酶消化收集,显微镜下计数后将细胞浓度调整为5×104cells/ml,以每孔200 μl细胞悬液的量接种于96孔板,置于培养箱中24 h待其贴壁后,分别加入浓度为15、30、60、120 μmol/L姜黄素,每组设6个复孔,每孔终体积为200 μl,对照组加入等量培养基,培养箱中继续培养24、48 h。达到相应培养时间后,每孔加入CCK-8溶液10 μl,温育1 h用酶标仪测定各孔570 nm波长处吸光度(OD值),计算细胞抑制率(%)=(1-OD处理组/OD对照组)和半数抑制浓度(IC50),每组实验重复3次。
1.3 透射电镜细胞样品制备
制备浓度为1×105cells/ml细胞悬液,接种于一批50 ml培养瓶中,培养箱中过夜后弃去各瓶中的培养基,处理组加入15~120 μmol/L姜黄素1.5 ml和1.5 ml培养基使终体积为3 ml,对照组加入等量培养基,24 h胰酶消化收集各瓶细胞及上清于离心管中,1 500 r/min离心5 min,弃上清,PBS清洗3次,2.5%戊二醛4℃固定,PBS冲洗,置于1%锇酸1.5 h,梯度丙酮脱水,环氧树脂浸透、包埋,聚合72 h修块、切片、醋酸双氧铀和柠檬铅双染。
1.4 Annexin V-FITC/PI双染激光共聚焦显微镜观察
将浓度为5×104cells/ml的EC109细胞接种于放有盖玻片的6孔板内,细胞贴壁后弃上清加入15~120 μmol/L姜黄素,对照组加等量培养基,24 h后弃上清,PBS清洗,依次分别加入500 μl Buffer缓冲液、5 μl Annexin V-FITC和5 μl PI,避光放置,5~15 min后激光共聚焦显微镜下观察、拍照。
1.5 流式细胞术检测蛋白水平
将浓度为5×104cells/ml细胞悬液接种于培养瓶中,培养箱中过夜后弃去各瓶中的培养基,处理组分别加入15~120 μmol/L姜黄素1.5 ml和1.5 ml培养基,对照组加入等量培养基,24 h后消化收集各瓶细胞及上清于离心管中,1 500 r/min离心7 min,弃上清,PBS清洗2次弃上清,每份样品加入一抗工作液100 μl,37℃水浴30 min,PBS清洗2次弃上清加入二抗工作液100 μl,37℃水浴30 min,PBS清洗2次弃上清,加入1 mlPBS经400目筛网过滤后上机检测。并设PBS代替一抗和二抗的阴性对照,只加二抗的阴性对照及用同型抗体替代抗体作同型对照。
应用Expo3.2ADC对数据进行处理,以荧光指数(FI)表示各蛋白的相对含量,FI=(样品基因蛋白表达的荧光强度-正常样品的荧光强度)/正常样品的荧光强度。
1.6 统计学处理
2 结果
2.1 姜黄素对EC109细胞增殖的抑制作用
15~120 μmol/L姜黄素处理EC109细胞后,细胞增殖均受到不同程度的抑制,呈明显的剂量和时间效应关系,且与对照组相比,差异均有统计学意义(P<0.05)。姜黄素作用24和48 h,EC109细胞株的IC50分别为(63.46±1.82)、(45.37±1.24),即随着处理时间的延长,IC50逐渐减小(P<0.05, 图1)。


2.2 细胞超微结构观察
对照组EC109细胞状态良好,细胞膜完整,可见双层核膜结构,核仁大而圆。15、30 μmol/L姜黄素作用24 h,细胞出现体积缩小,核仁减少等凋亡特征,60、120 μmol/L姜黄素处理后,细胞核仁消失,染色质核膜下聚集成半月形,胞浆空泡化,核膜破裂,凋亡特征明显(图2)。
2.3 Annexin V-FITC/PI双染激光共聚焦显微镜观察细胞凋亡
对照组活细胞不着色,荧光为阴性。15、30 μmol/L姜黄素处理后,Ec-109细胞呈绿色荧光,说明此时细胞仅和Annexin V结合,即处于凋亡早期。60、120 μmol/L姜黄素作用后,细胞主要与PI结合呈红色荧光,此时细胞处于凋亡中晚期(图3)。
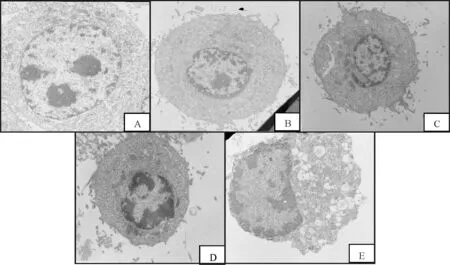
Fig. 2 The ultrastructure of curcumin-treated EC109 cells A: Control; B: 15 μmol/L curcumin; C: 30 μmol/L curcumin; D: 60 μmol/L curcumin; E: 120 μmol/L curcumin

Fig. 3 The cell apoptosis by AnnexinV-FITC/PI double staining A: Control; B: 15 μmol/L curcumin; C: 30 μmol/L curcumin; D: 60 μmol/L curcumin; E: 120 μmol/L curcumin
2.4 流式细胞术检测结果
应用流式细胞术检测姜黄素对EC109细胞PTEN/PI3K/AKT通路上相关蛋白PTEN、AKT、 GSK3β和Caspase 3表达的影响。15~120 μmol/L姜黄素作用EC109细胞24 h后,PTEN、GSK3β和Caspase 3蛋白表达逐渐增多,而AKT表达逐渐减少。与对照组比较,30、60、120 μmol/L姜黄素作用后PTEN蛋白表达增多显著,60、120 μmol/L姜黄素处理后AKT表达下降,GSK3β表达明显升高,15~120 μmol/L姜黄素处理EC109细胞后Caspase 3表达也显著升高,差异均有统计学意义(表1,图4)。


GroupFIPTEN AKT GSK3β Caspase3 01.23±0.121.64±0.081.58±0.071.78±0.12151.36±0.071.56±0.051.76±0.021.98±0.05**301.46±0.03**1.52±0.081.91±0.062.32±0.12**601.57±0.05**1.43±0.06*2.01±0.09**2.53±0.11**1201.83±0.09**1.34±0.06**2.05±0.09**2.76±0.06**
FI: Fluorescence index
*P<0.05,**P<0.01vscontrol(0 μmol/L curcumin)

Fig. 4 The protein level of PTEN,AKT,GSK3β and Caspase 3 by FCM a、c、e、g: The fluorescence expression intensity of PTEN,AKT,GSK3β and Caspase 3 of control; b、d、f、h: The fluorescence expression intensity of PTEN,AKT,GSK3β and Caspase 3 by 120 μmol/L curcumin
3 讨论
姜黄素是从姜黄属植物姜黄、郁金、羲术等活血化瘀药物中出提取出的中药单体,以姜黄含量最大[5],其药理作用十分广泛,主要特性为抗炎、抗氧化和抗肿瘤,在抗肿瘤过程中抗癌谱广,毒副作用小,是一种具有良好应用前景的抗癌新药。姜黄素发挥抗肿瘤作用的机制有: (1)损伤细胞线粒体,使之释放细胞色素C,活化Caspase 3诱导肿瘤细胞凋亡[6];(2)调节多种细胞信号转导途径抑制肿瘤细胞增殖,如NF-κB、Notch-1等[7];(3)抑制肿瘤血管生长因子及其受体从而抑制肿瘤细胞的生长和转移[8];(4)阻断TGF-β1发挥抗肿瘤细胞迁移的作用[9];(5)通过抑制胸腺嘧啶脱氧核苷激酶(TK)活性,阻遏细胞周期,诱导细胞分化等[10]。但PTEN/PI3K/AKT通路在姜黄素诱导食管癌Ec-109细胞凋亡中是否发挥作用还不明确。
本研究CCK-8检测结果发现姜黄素能显著抑制食管癌EC109细胞的增殖,且呈明显的剂量和时间效应关系。透射电镜观察发现随着药物浓度的增加,EC109细胞凋亡的形态特征越来越明显,但最高浓度120 μmol/L姜黄素作用后未形成明显的凋亡小体,这可能和药物浓度偏低有关。Annexin V-FITC/PI双染激光共聚焦显微镜观察发现15~120 μmol/L姜黄素作用EC109细胞后,绿色荧光逐渐减弱,红色荧光逐渐增强,即随着药物浓度的增加,细胞由早期凋亡逐渐发展为晚期凋亡。
本实验流式细胞术检测结果显示姜黄素可增加细胞中PTEN 、GSK3β和Caspase 3蛋白的表达,抑制AKT的表达,其机制为姜黄素作用后上调了抑癌基因PTEN的表达,继而PTEN使PI3K的活化产物PIP3去磷酸化,降低细胞内PIP3的浓度,从而抑制了AKT的激活,使AKT的表达水平降低[11],而AKT抑制使后其下游靶基因GSK3β激活[12],激活的GSK3β进而调节下游相关蛋白Caspase 3[13]的表达。有研究表明Caspase 3被称为“死亡蛋白酶”,是细胞凋亡的生物学标志,可直接降解胞内的结构蛋白和功能蛋白,引起细胞凋亡[14],所以15~120 μmol/L姜黄素处理EC109细胞后Caspase 3表达均显著升高。因此,姜黄素通过调控PTEN/PI3K/AKT通路,激活其下游靶基因Caspase 3诱导了EC109细胞凋亡。
[1] 刘 婕, 唐世孝. 姜黄素抗肝癌分子机制的研究进展[J]. 世界华人消化杂志, 2013, 21(33): 3678-3682.
[2] Kumaravel M, Sankar P, Latha P,etal. Antiproliferative effects of an analog of curcumin in Hep-2 cells: a comparative study with curcumin[J].NatProdCommun, 2013, 8(2): 183-186.
[3] Killian PH, Kronski E, Michalik KM,etal. Curcumin inhibits prostate cancer metastasisinvivoby targeting the inflammatory cytokines CXCL1 and -2[J].Carcinogenesis, 2012, 33(12): 2507-2519.
[4] Ding D, Wei S, Song Y,etal. Osthole exhibits anti-cancer property in rat glioma cells through inhibiting PI3K/Akt and MAPK signaling pathways[J].CellPhysiolBiochem, 2013, 32(6): 1751-1760.
[5] 周俊辉, 郝卯林, 赵 珊, 等. 姜黄素对小鼠肺缺血/再灌注损伤时细胞凋亡及CHOP的影响[J]. 中国应用生理学杂志, 2013, 29(4): 318-323.
[6] 郭立达, 焦振霞, 宋 瑛, 等. 姜黄素诱导结肠癌LoVo细胞凋亡的作用及机制研究[J]. 中国中药杂志. 2013, 38(13): 2191-2196.
[7] Chen J, Wang FL, Chen WD. Modulation of apoptosis-related cell signalling pathways by curcumin as a strategy to inhibit tumor progression[J].MolBiolRep, 2014, 41(7): 4583-4594.
[8] Mondal G, Barui S, Saha S,etal. Tumor growth inhibition through targeting liposomally bound curcumin to tumor vasculature[J].JControlRelease, 2013, 172(3): 832-840.
[9] Mo N, Li ZQ, Li J,etal. Curcumin inhibits TGF-β1-induced MMP-9 and invasion through ERK and Smad signaling in breast cancer MDA- MB-231 cells[J].AsianPacJCancerPrev, 2012, 13(11): 5709-5714.
[10]Guo H, Xu YM, Ye ZQ,etal. Curcumin induces cell cycle arrest and apoptosis of prostate cancer cells by regulating the expression of IkappaBalpha, c-Jun and androgen receptor[J].Pharmazie, 2013, 68(6): 431-434.
[11]郭 琳, 王 强. PI3K、AKT以及PTEN在胃肠道间质瘤中的表达及意义[J]. 现代肿瘤医学, 2012, 20(7): 1401-1405.
[12]Kizhakkayil J, Thayyullathil F, Chathoth S,etal. Modulation of curcumin-induced AKT phosphorylation and apoptosis by PI3K inhibitor in MCF-7 cells[J].BiochemBiophysResCommun, 2010, 394(3): 476-481.
[13]He Y, Zhou A, Jiang W. Toll-like receptor 4-mediated signaling participates in apoptosis of hippocampal neurons[J].NeuralRegenRes, 2013, 8(29): 2744-2753.
[14]况 炜, 陈慧玲, 蒋建平. 菊米提取液对人宫颈癌HeLa细胞生长的抑制作用[J]. 中国应用生理学杂志, 2013, 29(3): 275-279.
Curcumin induces apoptosis by PTEN/PI3K/AKT pathway in EC109 cells
LI Xiu-juan△, LI Yu-zhen, JIN Chun-ting, FAN Jie, LI Hai-jun
(Department of Pathology, Hebei North University, Zhangjiakou 075000, China)
Objective: To study the molecular mechanism of curcumin in human esophageal carcinoma cell line(EC109). Methods: EC109 cells were cultivatedinvitro. When 80%-90% confluence was reached, they were treated with curcumin in different concentrations (15~120 μmol/L). The effects on cell proliferation were examined by CCK-8 colorimetry. The ultrastructure of EC109 cells were detected with transmission electron microscope(TEM). The cells apoptosis was observed with laser confocal microscope(LCM) by AnnexinV-FITC/PI double staining. The proteins level of PTEN, AKT,GSK3β and Caspase 3 were tested by flow cytometry(FCM). Results: CCK-8 test showed that curcumin could inhibit the proliferation of EC109 cells in a time-and concentration-dependent manner. TEM and LCM examinations indicated that curcumin could make EC109 cells apoptosis. The data of FCM showed that curcumin could increase the expression of PTEN, GSK3β and Caspase 3, decreased the expression of AKT. Conclusion: The effects of curcumin on inhibiting proliferation and promoting apoptosis of EC109 cells were related with increased expression of PTEN and inhibition of PI3K/AKT signaling pathway.
curcumin; PTEN/PI3K/AKT pathway; esophageal carcinoma
河北省医学科学研究重点课题计划(ZD20140083);河北省高等学校科学技术研究青年基金项目(QN20131156)
2014-10-17 【修回日期】2015-01-27
R735.1
A
1000-6834(2015)02-174-004
10.13459/j.cnki.cjap.2015.02.021
△【通讯作者】Tel: 18931316332; E-mail: llxxjjuan@126.com

