定量检测囊性纤维化跨膜传导调节因子BA-ELISA方法的建立与评价*
邱 枫, 曾 杰, 李 坤, 陈爱君, 徐万祥, 倪 崖△
(1. 温州医科大学检验医学院、生命科学学院, 浙江 温州 325035; 2. 浙江省医学科学院生殖医学研究中心, 杭州 310013;3. 上海计划生育研究所国家人口和计划生育避孕药物重点实验室, 上海 200032)
定量检测囊性纤维化跨膜传导调节因子BA-ELISA方法的建立与评价*
邱 枫1,2, 曾 杰1,2, 李 坤2, 陈爱君2, 徐万祥3, 倪 崖1,2△
(1. 温州医科大学检验医学院、生命科学学院, 浙江 温州 325035; 2. 浙江省医学科学院生殖医学研究中心, 杭州 310013;3. 上海计划生育研究所国家人口和计划生育避孕药物重点实验室, 上海 200032)
目的:建立一种定量检测囊性纤维化跨膜传导调节因子(CFTR)的生物素-亲和素ELISA(BA-ELISA)方法并评价其可靠性。方法:优选设计CFTR三个表位的大肠杆菌表达抗原,免疫新西兰白兔获得CFTR多克隆抗体,用纯化后的抗体包被酶标板,并用生物素对其标记,从人精子提取CFTR作为抗原,用辣根过氧化物酶偶联的亲和素检测,优化两种抗体浓度及实验参数 ,建立可定量检测CFTR蛋白的双抗体夹心BA-ELISA方法;用临床精子标本评估所建立方法的重复性、特异性等。结果:CFTR包被抗体和生物素化CFTR抗体最适浓度分别为4 μg/ml和 10 μg/ml,最佳封闭液为1% BSA-PBST,抗原与包被抗体最佳反应时间60 min,底物显色最佳时间15 min。批内、批间变异系数分别为2.16%~9.23%和 2.29%~11.71%,包被的CFTR抗体与精子胞浆蛋白无交叉反应,最低检出下限为0.15 ng/ml,标准反应曲线具有良好的线性关系R2=0.962。结论:成功创建了定量检测CFTR蛋白的ELISA方法,具有特异性强、灵敏度高等特点。
CFTR蛋白;CFTR多克隆抗体;生物素-亲和素ELISA
囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator, CFTR)是一种cAMP激活氯离子通道,其基因突变可致常染色体隐性遗传病——囊性纤维化(cystic fibrosis, CF),CF常伴有多种疾病,如胰功能不全、男性不育等。近97%男性CF患者因先天双侧输精管缺失(congenital bilateral absence of the vas deferens, CBAVD)导致梗阻性无精子症[1,2],CBAVD患者CFTR突变率很高,并呈现明显的种族差异性[3];本课题组前期发现CFTR通道蛋白存在于生育男子精子头部且对男性生殖功能和精子受精能力至关重要[4],随后我们进一步证明CFTR蛋白水平与人精子受精能力呈正相关,为评价精子受精能力的一项重要参考指标[5],另外,有些疾病如男性尿毒症患者精子CFTR表达率显著下降,精子CFTR表达率也可作为评价男性尿毒症患者生育力的指标[6]。目前临床上常用来评价精子受精能力的方法仅有精液常规检查等几项,尚缺乏与精子受精相关的更多检测指标,且只靠精液常规等检测方法并不能准确评价精子受精能力,因此创建一种性能可靠定量检测CFTR蛋白的方法非常必要。本研究对设计构建的CFTR工程菌表达抗原免疫兔获得的多克隆抗体进行生物素标记,利用生物素—亲和素系统,建立一种特异性好、灵敏度高、方便快捷检测CFTR蛋白的BA-ELISA方法,为CF诊断治疗、精子质量评价与男性不育临床诊断、精子库精子筛查以及科学研究提供新的检测技术手段。
1 材料与方法
1.1 主要试剂和仪器
兔抗CFTR多克隆血清由本实验室和上海计划生育研究所合作制备,活化生物素、辣根过氧化物酶标记的亲和素、96孔酶标板、BCA蛋白定量试剂盒购自碧云天生物技术研究所; 3,3,5,5,四甲基联苯胺(TMB)、牛血清白蛋白(BSA)购自Sigma公司;生物素化兔抗人CFTR抗体为本实验室制备;HiTrap Protein A抗体纯化柱购自美国GE公司;精液标本由志愿者提供,CFTR抗原从精子中提取;囊性纤维化跨膜电导调节蛋白ELISA参考试剂盒购自BG公司;MK3全自动酶标仪购自Thermo公司;透析袋;电磁搅拌器。
1.2 CFTR抗体的制备和纯化
准备2 ml HiTrap Protein A抗体纯化柱,按说明书纯化抗体,用BCA试剂盒测纯化后抗体浓度。
1.3 生物素标记CFTR抗体的制备
将纯化过的CFTR抗体用0.1 mol/L碳酸氢钠缓冲液(pH 8.0)充分透析后测蛋白浓度。按CFTR抗体与NHSB质量比10∶3加入NHSB溶液(N-羟基琥珀酰亚胺生物素1 mg溶于1 ml二亚基甲砜),室温下持续搅拌、保温2~4 h。加入9.6 μg 1 mol/L NH4Cl,室温搅拌10 min后放在透析袋中,在4℃对PBS充分透析后,用BCA试剂盒测生物素化抗体浓度,置于-20℃保存。
1.4 CFTR蛋白抗原提取及浓度测定
精子标本镜检后离心去精浆,充分洗涤精子;加入少量PBS混匀放入液氮中反复冻融并用1 ml注射器反复吹打直至在显微镜下观察精子破裂程度大于80%,4℃ 13 000 r/min离心10 min,取上清。依据囊性纤维化跨膜电导调节蛋白ELISA参考试剂盒说明书测定以上提取蛋白总浓度及CFTR蛋白浓度。
1.5 CFTR蛋白双抗体夹心ELISA方法的建立与优化
1.5.1 包被抗体浓度和生物素化抗体最适浓度的优化 将纯化的CFTR抗体IgG用pH 9.6 碳酸盐缓冲液分别稀释3个不同浓度,每一浓度包括3个横行,4℃孵育16 h,洗涤;每孔加入100 μl 1% BSA-PBST封闭,37℃孵育1 h;在3个纵行中依次加入以上提取的浓度从大到小的含CFTR蛋白的提取液,第4纵行中加入PBST为阴性对照,37℃孵育1 h,洗涤;生物素化抗体稀释成3个不同浓度,分别加100 μl于每一包被浓度的一个纵行中,37℃孵育1 h,洗涤;每孔加100 μl 1:2 000稀释终浓度为0.5 μg/ml辣根过氧化物酶标记的亲和素,37℃孵育0.5 h,加底物37℃避光显色15 min;加终止液终止反应后在450 nm波长下读取吸光度A值,以阴性对照OD值小于0.1,阳性OD450nm/阴性OD450nm(P/N)最大时的一组作为包被抗体和生物素化抗体的最适工作浓度。
1.5.2 封闭液、抗原与包被抗体最佳反应时间和底物最佳显色时间的优化 按1.5.1方法, CFTR抗原与包被抗体反应,分别采用不同的封闭液封闭酶标板选择最佳封闭液;分别反应不同时间,确定抗原抗体最佳反应时间; 改变底物显色时间,确定底物最佳显色时间;包被抗体和生物素化抗体分别选取1.5.1方法中最适最佳工作浓度,以阴性OD值小于0.1, P/N最大判定以上最佳条件。
1.5.3 重复性试验 批内重复性:检测不同浓度的CFTR蛋白,同时设阴性对照孔,每个浓度重复5孔,读出每孔OD值,计算其孔间变异系数CV%值。
批间重复性:按批内重复性方法,连续5 d测其OD值,计算其板间变异系数CV%值。
1.5.4 特异性试验 用不含CFTR蛋白的精子胞浆蛋白作为抗原与包被抗体反应,在450 nm波长下分别读取CFTR蛋白和精子胞浆蛋白的吸光度A值。1.5.5 标准曲线和最低检测线的确定 已知浓度的CFTR蛋白倍比稀释为5个不同浓度:1.2 ng/ml、0.6 ng/ml、0.3 ng/ml、0.15 ng/ml和0.075 ng/ml分别与包被抗体反应,测定各孔的OD450nm值。取阳性/阴性(P/N)≥2.1时的最大稀释倍数所对应的浓度为待检抗原的最低检出量,并根据CFTR蛋白的量和各自对应的OD450nm做标准曲线,列出回归方程。
2 结果
2.1 提取精子CFTR蛋白抗原的浓度
按囊性纤维化跨膜电导调节蛋白ELISA参考试剂盒说明书操作,所得CFTR蛋白浓度为1.2 ng/ml。
2.2 包被抗体和生物素抗体最适工作浓度
用3种不同浓度的CFTR抗体与3个不同浓度的CFTR生物素抗体两两组合,分别检测以上提取的浓度从大到小含CFTR蛋白的提取液,结果显示当包被抗体浓度为10 μg/ml,生物素抗体浓度为10 μg/ml时P/N值最大,但其线性关系欠佳,故确定包被抗体的最适工作浓度为4 μg/ml,生物素抗体的最适工作浓度为10 μg/ml(表1)。
2.3 最适封闭液、待测抗原与包被抗体最适反应时间和底物最佳显色条件的确定
分别用不同的封闭液进行封闭,最终确定1%BSA-PBST封闭效果最好(表2)。
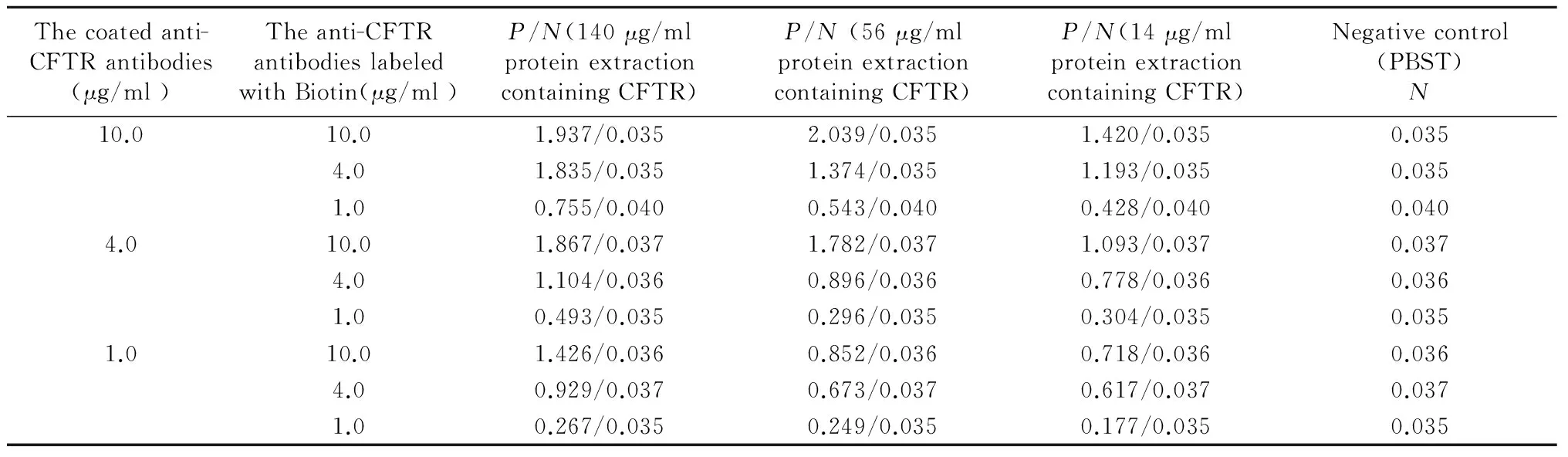
Tab. 1 Optimization of the working concentrations of coated anti-CFTR antibodies and anti-CFTR antibodies labeled with Biotin
CFTR: Cystic fibrosis transmembrane conductance regulator
Pis OD450nmof each well, andNis OD450nmof negative control (PBST)
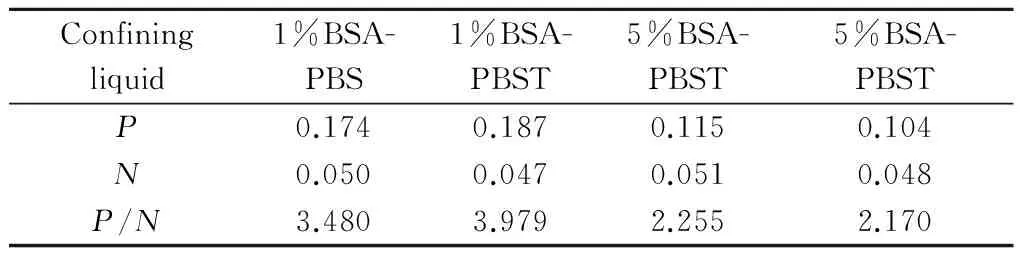
Tab. 2 The optimization of blocking buffers
Pis OD450nmof each well, andNis OD450nmof negative control (PBST)
CFTR抗原与包被抗体反应60 min时P/N值最大,选择60 min为最佳反应时间(表3)。
Tab. 3 The optimization of time during the reaction between CFTR antigen and its coated antibodies
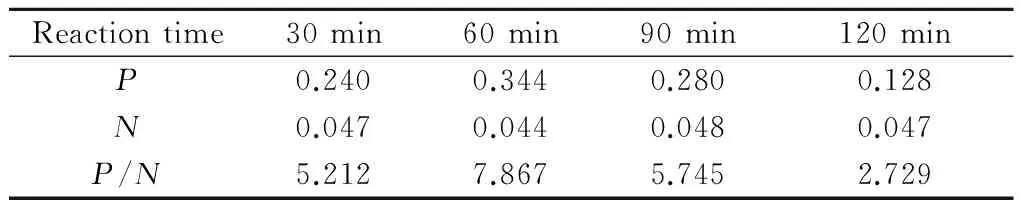
Reactiontime30min60min90min120minP0.2400.3440.2800.128N0.0470.0440.0480.047P/N5.2127.8675.7452.729
Pis OD450nmof each well, andNis OD450nmof negative control (PBST)
对不同底物显色时间的P/N值比较,最终确定15 min为最佳显色时间(表4)。
Tab. 4 Determination for optimum conditions of substrate chromogenic reaction

Chromogenictime10min12min15min20minP0.9500.1030.1240.115N0.5000.0490.0500.050P/N1.9002.0602.4002.300
Pis OD450nmof each well, andNis OD450nmof negative control (PBST)
2.4 重复性试验结果
用同一批制备的抗体包被酶标板,取4份浓度不同的CFTR蛋白样品各测定5孔。其批内CV分别为3.82%、5.02%、9.23%和7.14%。取3份浓度不同的CFTR蛋白连续测定5 d, 批间CV分别为2.29%、5.35%和11.71%。
2.5 双抗体夹心ELISA交叉试验结果
CFTR抗原用PBST稀释为0.3 ng/ml,精子胞浆蛋白浓度为192 μg/ml,用本研究所建立方法检测精子胞浆蛋白呈阴性反应。
2.6 标准曲线和最低检测线的确定
2.6.1 敏感性试验结果 如表5所示,当CFTR抗原浓度为0.075 ng/ml时,P/N值开始小于2.1。即本试验建立的双抗体夹心ELISA方法检测CFTR的最低检出量为0.15 ng/ml。
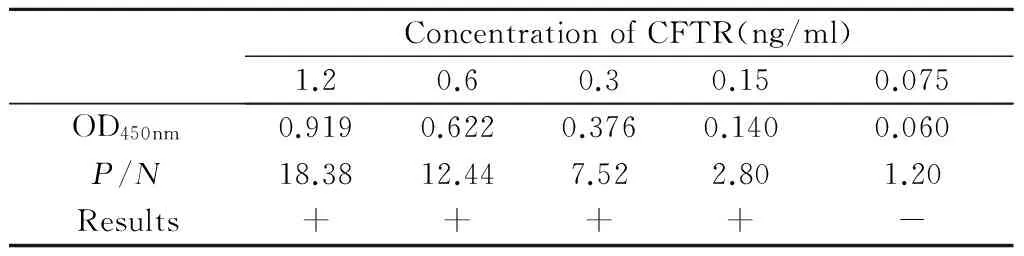
Tab. 5 Results of sensitivity test
WhenP/N>2.1, the result is positive, the value ofNis 0.05
2.7 标准抗原浓度与吸光度的相关性
如图1,回归方程为y=0.7438x+0.0636,相关系数R2=0.9619,可见标准抗原浓度与其OD值显著相关,表明建立的生物素—亲和素双抗体夹心ELISA法定量检测CFTR蛋白含量是可行的。
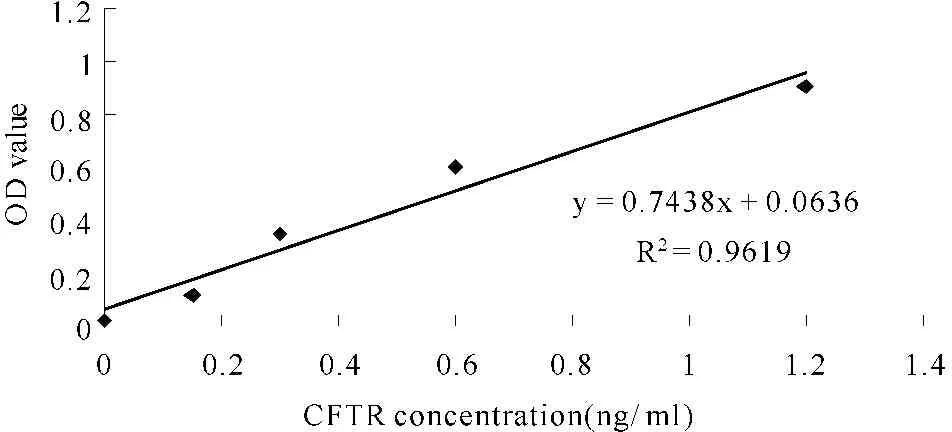
Fig. 1 The correlation of standard antigen concentration and the absorbance
3 讨论
本研究主要采用以下手段提高其检测技术的灵敏度、特异性和可靠性:(1)制备的CFTR抗体含CFTR 3个表位抗原的多克隆抗体,具有与CFTR抗原3个表位特异反应的特点,克服了由于CFTR基因突变造成某一表位失活而使单抗无法识别抗原的问题;(2)3个表位的设计,确保了双抗体夹心法中抗原的结合需要针对两个不同表位的要求;(3)优选的3个表位为已报道的功能肽段,且其长度适合在大肠杆菌BL21(DE3)表达以及表达后的SDS-PAGE分析;(4)制备的多克隆抗血清效价高(1∶512 000),可有效地检测到人精子中的CFTR蛋白,保证定量检测方法的高灵敏度和特异性;(5)利用生物素—亲和素系统具有高灵敏度、高特异性、高稳定性和容易标记等优点,所以本方法克服了目前市场上常用的酶联免疫竞争法敏感性和特异性较差的问题;(6)一般酶联免疫竞争法适合小分子蛋白的检测,而CFTR蛋白为170 KD的大分子蛋白,因此更适合用双抗体夹心法检测。上述优点集合在一起,保证了检测的灵敏和快速,本研究对制备的CFTR 多克隆抗体进行生物素标记,探索了抗体封闭条件、待测抗原反应时间和底物最适作用时间等检测技术参数,进行了实验优化选择,最终创建了针对CFTR检测的生物素—亲和素双抗体夹心ELISA方法。
对本研究建立的BA-ELISA检测CFTR方法进行了性能验证,检测下限为0.15 ng/ml,具有较高的灵敏度;交叉实验,证明具有良好的特异性;批内、批间误差实验,证明具有较好的重复性。本研究成功建立了定量检测CFTR蛋白的BA-ELISA方法,能定量检测出组织和细胞中的CFTR蛋白,且在检测灵敏度和检测阳性率方面均优于常规ELISA方法[7],为CFTR的研究和应用提供了有效的检测手段。
[1] Cuppens H, Cassiman JJ. CFTR mutations and polymorphisms in male infertility [J].IntJAndrol, 2004, 27(5): 251-256.
[2] Wong PY. CFTR gene and male fertility [J].MolHumReprod, 1998, 4(2): 107-110.
[3] Yu J, Chen Z, Ni Y,etal. CFTR mutations in men with congenital bilateral absence of the vas deferens (CBAVD): a systemic review and meta-analysis [J].HumReprod, 2012, 27(1): 25-35.
[4] Xu WM, Shi QX, Chen WY,etal. Cystic fibrosis transmembrane conductance regulator is vital to sperm fertilizing capacity and male fertility [J].ProcNatlAcadSciUSA, 2007, 104(23): 9816-9821.
[5] Li CY, Jiang LY, Chen WY,etal. CFTR is essential for sperm fertilizing capacity and is correlated with sperm quality in humans [J].HumReprod, 2010, 25(2): 317-327.
[6] Xu HM, Li HG, Xu LG,etal. The decline of fertility in male uremic patients is correlated with low expression of the cystic fibrosis transmembrane conductance regulator protein (CFTR) in human sperm [J].HumReprod, 2012, 27(2): 340-348.
[7] 孔令青, 李 勇, 高 洪. 生物素—亲和素标记技术[J]. 动物医学进展, 2008, 29(4): 100-102.
Establishment and evaluation of methods for determinating cystic fibrosis transmembrane conductance regulator quantitatively
QIU Feng1, 2, ZENG Jie1,2, LI Kun2, CHEN Ai-jun2, XU Wan-xiang3, NI Ya1,2△
(1. School of Medical Laboratory Science, School of Life Sciences, Wenzhou Medical University, Wenzhou 325035; 2. Center of Reproductive Medicine, Zhejiang Academy of Medical Sciences, Hangzhou 310013; 3. National Population and Family Planning Key Laboratory of Contraceptive Drugs and Devices, Shanghai Institute of Planned Parenthood Research, Shanghai 200032, China)
Objective: To establish and evaluate a BA-ELISA method for the quantitative detection of cystic fibrosis transmembrane conductance regulator (CFTR) protein.Methods: We deliberately selected three tables of CFTR and made the synthetic peptide be expressed in E.coli, then used the antigen to immunize rabbits to obtain the anti-CFTR polyclonal serum. After that, 96 well plates were coated with the purified antibody against CFTR. The antigen CFTR which was extracted from human sperm was detected by anti-CFTR antibody labeled with biotin, horseradish peroxidase conjugated avidin, and the substrate. The concentrations of two kinds of antibodies and the experiment parameters were optimized. Thereby, the double antibody sandwich BA-ELISA method for the quantitative detection of CFTR protein was established. Furthermore, the reproducibility, specificity and so on were evaluated by clinical specimens of sperm. Results: The optimal concentration of coated anti-CFTR IgG was 4 μg/ml, while the biotin labeled anti-CFTR IgG was 10 μg/ml; the optimal blocking buffer was 1%BSA-PBST, the optimal time of the reaction between antigen and antibody was 60 min, the optimal chromogenic time was 15 min, the intra-assay and inter-assay coefficient were 2.16%~9.23% and 2.29%~11.71% respectively; The lowest detectable limit was 0.15 ng/ml; the standard curve had a good linear correlation of R2=0.962. Conclusion: The BA-ELISA method for the quantitative detection of CTFR protein is successfully established, and it is demonstrated that the method has strong specificity, high sensitivity and good reproducibility. It provides the basis and evidence of the further application of the method.
CFTR protein; anti-CFTR polyclonal serum; biotin-avidin ELISA
浙江省重点科技创新团队项目(2012R10048-07);浙江省科技计划项目(2011C23046,2013C31066,2012F10004)
2014-10-24 【修回日期】2015-01-30
R392-33
A
1000-6834(2015)02-154-004
10.13459/j.cnki.cjap.2015.02.016
△【通讯作者】Tel: 0571-88215505; E-mail: niya99@126.com

