羟基乙酰化姜黄素诱导的声动力治疗对巨噬细胞凋亡与坏死的影响*
杨力明, 梁会娟, 彭成海, 程佳丽, 王 欢, 翁丽清, 李志韬, 田 野,
(1. 哈尔滨医科大学基础医学院 病生教研室, 黑龙江 哈尔滨 150081; 2. 哈尔滨工业大学 物理凝聚态实验室, 黑龙江 哈尔滨 150001;3. 哈尔滨医科大学附属第四医院 急诊内科, 黑龙江 哈尔滨 150001; 4. 哈尔滨医科大学附属第一医院 心内科, 黑龙江 哈尔滨 150001)
羟基乙酰化姜黄素诱导的声动力治疗对巨噬细胞凋亡与坏死的影响*
杨力明1△, 梁会娟2, 彭成海3, 程佳丽4, 王 欢4, 翁丽清4, 李志韬1, 田 野1,4
(1. 哈尔滨医科大学基础医学院 病生教研室, 黑龙江 哈尔滨 150081; 2. 哈尔滨工业大学 物理凝聚态实验室, 黑龙江 哈尔滨 150001;3. 哈尔滨医科大学附属第四医院 急诊内科, 黑龙江 哈尔滨 150001; 4. 哈尔滨医科大学附属第一医院 心内科, 黑龙江 哈尔滨 150001)
目的:探讨羟基乙酰化姜黄素(HAC)介导的声动力治疗对人急性单核细胞白血病细胞核(THP-1)源巨噬细胞凋亡的影响。方法:体外诱导 THP-1源巨噬细胞,通过单纯药物和单纯超声对细胞存活率的影响优化出声动力治疗的最适条件。将细胞分为4组(1×105cells/ml):对照组、单纯超声组、单纯HAC组和声动力治疗组。应用声动力体外治疗巨噬细胞,药物HAC终浓度为5 μg/ml,超声强度为0.5 W/cm2,超声时间为5 min。不同治疗方法后用无血清培养液培养6 h,用CCK-8法测定细胞存活率的变化,用Annexin V/PI法测定细胞凋亡、坏死变化。结果:CCK-8法测得声动力治疗后,细胞存活率明显下降(P<0.01), Annexin V/PI法测得声动力治疗后,细胞凋亡率和坏死率均升高,凋亡/坏死比升高 (P<0.01)。结论:羟基乙酰化姜黄素介导的声动力治疗对THP-1巨噬细胞的凋亡有明显的诱导效应。
羟基乙酰化姜黄素;声动力治疗;巨噬细胞;凋亡
动脉粥样硬化是一种慢性炎症性心血管疾病,近年来已经成为危害人类健康最严重的疾病[1]。越来越多的研究表明巨噬细胞在动脉粥样硬化病情发展过程中起到重要作用[2, 3],因此将巨噬细胞作为治疗的靶细胞可能会成为治疗动脉粥样硬化的有效方法。
本课题组以往的实验结果表明光动力治疗可有效的诱导巨噬细胞凋亡,从而抑制动脉粥样硬化斑块进展[4]。光动力治疗是通过光激活光敏剂产生细胞毒性作用于靶细胞,但是光动力治疗存在光穿透深度较浅等问题[5],因此光动力治疗存在一定局限性。
声动力治疗(sonodynamic therapy, SDT)是在光动力治疗的基础上发展起来的一种全新无创治疗方法,通过具有较强穿透能力的低频超声激活聚集在靶组织内的声敏剂从而杀伤靶组织[6]。贮存在靶细胞中的声敏物质经超声处理后,吸收能量发生电子跃迁, 从低能态激发到高能态。当回到低能态时,释放出具有细胞毒性的氧基自由基作用于靶组织。早在1989年Umemura等就开始了SDT机理的探索,目前使用的声敏剂主要是光敏剂,但光敏剂在临床研究中表现出延迟性皮肤光毒性,因此本课题组通过使用中药声敏剂姜黄素用于SDT来避免光毒性。之前研究证实,本课题组使用姜黄素作为声敏剂可诱导巨噬细胞凋亡,但使用姜黄素存在药物剂量大,稳定性较弱等弊端。本室通过对姜黄素的羟基进行乙酰化修饰后得到一种新的药物-羟基乙酰化姜黄素(hydroxyl acetylated curcumin, HAC),与姜黄素相比,HAC的稳定性更强,更有利用于SDT。
本实验通过使用HAC作为声敏剂介导的SDT在体外作用于巨噬细胞,检测其对细胞的影响。
1 材料与方法
1.1 细胞系
人急性单核细胞白血病细胞株(THP-1)购自上海中科院细胞库。
1.2 药物及试剂
培养液:胎牛血清和(FBS)和培养液(HyClone公司);青霉素-链霉素溶液(100X)(Beyotime公司);终浓度为RPMI 1640含10% FBS,青霉素100 μg/ml链霉素100 μg/ml。声敏剂:羟基乙酰化姜黄素(HAC)由哈尔滨工业大学提供。胰酶消化液由碧云天公司提供。佛波酯(PMA)由美国La Jolla 公司提供。CCK-8试剂盒由碧云天公司提供。
1.3 主要仪器
声动力治疗仪由哈尔滨工业大学提供。净化工作台(苏州安泰空气技术公司,中国)。细胞培养箱(SANYO公司,日本)。低温离心机(Beckman公司,美国)。酶标仪(BioTek,美国)。流式细胞仪(Becton-Dickinson,美国) 电子分析天平(AL104型,中国)
1.4 溶液的配制
磷酸盐缓冲液(phosphate buffered saline,PBS):Na2HPO4·12H2O 2.89 g、KH2PO40.2 g、NaCl 8.0 g、KCl 0.2 g,将以上试剂依次溶于1 L去离子水中,调pH到7.4,高温高压灭菌后4℃保存。HAC溶液的配制:在避光条件下,将1 mg HAC 溶于1 ml DMSO后充分混匀,是储存浓度为1 mg/ml的储存液,-20 ℃保存。取无血清RPMI 1640培养液加入相应体积的HAC储存液配制成相应浓度的HAC,充分溶解混匀。每次取用时,在每1 ml的培养液中加入5 μl的储存液,使用终浓度达5 μg/ml。
1.5 THP-1细胞的培养及诱导分化
将THP-1细胞1×105cells/ml,以含10%胎牛血清、100 μg/ml链霉素、100 μg/ml青霉素的RPMI 1640液,于37°C、5% CO2及饱和湿度的培养箱中传代培养。收集细胞,加入含有100 ng/ml PMA的培养液于96孔板、24孔板或35 mm的培养皿中培养,72 h后,诱导分化为巨噬细胞。PBS洗3遍细胞去除PMA,用无血清培养液继续培养。实验分组为对照组、HAC组、超声组以及HAC结合超声(SDT)组。
1.6 单纯HAC治疗
弃上清,PBS冲洗3遍,设置单纯对照组、不同药物浓度组(μg/ml: 1、2.5、5、7.5、10、15、20、30、40、50),药物作用时间均为4 h。5 μg/ml浓度药物不同作用时间组(5 min、15 min、30 min、45 min、1 h、2 h、3 h、4 h、5 h时)。每组6个孔。治疗后用PBS洗涤2遍后,加入500 μl的纯1640培养液进行培养6 h。
1.7 单纯超声治疗
弃上清,PBS冲洗3遍,设置单纯对照组和不同超声时间组(min: 1、3、5、10、15)。每组6个孔超声强度为0.5 W/cm2。治疗后用PBS洗涤2遍后,加入500 μl的纯1640培养液进行培养6 h。
1.8 声动力治疗
弃上清,PBS冲洗3遍,设置单纯对照组(不加HAC也不进行超声治疗)、单纯超声组、单纯HAC组、SDT(药物作用4 h后超声作用)组,每组6个孔,前两组每皿中加入2 ml无血清RPMI 1640培养液,后两组每皿中加入含有HAC的无血清RPMI 1640培养液,皿中HAC终浓度均为5 μg/ml。在37℃、5%CO2及饱和湿度条件下避光孵育4 h。随后开始进行SDT治疗,根据前期实验,我们选择超声强度为0.5 W/cm2,治疗时间为5 min。治疗后用PBS洗涤2遍后,加入500 μl的纯1640培养液进行培养6 h。
1.9 CCK-8检测细胞存活率
配制CCK-8溶液,取CCK-8原液与无血清RPMI 1640培养液按体积比1∶9配制所需体积工作液。不同治疗后的细胞孵育6 h后弃上清,PBS冲洗一遍后,加入100 μl工作液,在37℃、5% CO2及饱和湿度条件下避光孵育2 h。随后将96孔板放入酶标仪,调制所需参数,在波长为450 nm条件下读取OD值,记录。
1.10 流式细胞检测细胞凋亡率
实验分成4组:对照组(control):未加任何处理;单纯药物组(HAC):加入5 μg/ml HAC;单纯超声组(ultrasound):用0.5 W/cm2强度的超声处理5 min;声动力组(SDT)。治疗后6 h弃去上清。
步骤:(1)用去离子水将10×Binding Buffer稀释成1×Binding Buffer;(2)细胞收集。用0.25%的胰酶消化,镜下看细胞变圆,大部分脱落后,用含血清的培养液终止消化,用吸管吹打下剩余的贴壁细胞,于室温2 000 r/min离心5~10 min,收集细胞;(3)细胞洗涤:用预冷PBS(4 ℃)重悬细胞一次,2 000 r/min离心5~10 min,洗涤细胞;(4)加入300 μl的Binding Buffer 悬浮细胞;(5)Annexin V-FITC标记:加入5 μl的Annexin V-FITC混匀后,避光,室温孵育15 min;(6)PI标记:上机前5 min再加入5 μl的PI染色;(7)上机前,补加200 μl的1×Binding Buffer;(8)上机检测。
1.11 统计学分析
2 结果
2.1 细胞存活率变化
分组为对照组(0 μg/ml)和不同浓度HAC,作用4 h后,随着药物浓度的升高,细胞存活率逐渐降低。当药物浓度为50 μg/ml时,细胞存活率为(45.73±4.55)% (P<0.01)。药物浓度为5 μg/ml时,细胞存活率(96.24±3.51)%同对照组相比没有出现明显下降,而药物浓度为7.5 μg/ml时,细胞存活率降低为(93.14±5.17)% (P<0.05),药物浓度为10 μg/ml时,细胞存活率明显下降至(82.91±5.34)% (P<0.01,图1)。

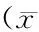
用5 μg/ml的HAC作用不同时间(5 min、15 min、30 min、45 min、1 h、2 h、3 h、4 h、5 h)后与对照组(0 min)相比结果表明,药物在5 h内对细胞存活率没有出现明显影响,当药物作用5 h后,细胞存活率仍为(94.45±3.41)% (图2)。表明HAC作用直至5 h内对THP-1 细胞存活率没有明显影响。 单纯超声作用不同时间(1 min、3 min、5 min、10 min、15 min)与对照组(0 min)相比结果表明,超声对细胞存活率没有明显影响,当超声作用15 min 时,细胞存活率(97.69±3.86)%没有明显下降(图3)。



HAC 作用4 h后,通过超声作用不同时间(1 min、3 min、5 min、10 min、15 min)后结果表明,药物结合超声作用治疗后细胞存活率明显降低,当超声时间为15 min时,细胞存活率降低至(61.79±4.63)% (P<0.01,图4)。

Fig. 4 The cell viability of THP-1 macrophages incubated with HAC after ultrasound exposure for 0, 1, 3, 5, 10 and 15 min**P<0.01vscontrol (0 min)
同对照组(100±3.37)%相比,单纯5 μg/ml HAC作用4 h(97.26±3.97%,P>0.05),单纯超声作用15 min(96.72±3.85)%细胞存活率没有出现明显变化,声动力治疗(SDT)组(63.17±3.72)% (P<0.01)细胞存活率明显降低 (图5)。

Fig. 5 The cell viability of THP-1 macrophages in control, ultrasound, HAC and SDT SDT: Sonodynamic therapy**P<0.01vscontrol
2.2 细胞凋亡坏死变化
对照组,5 μg/ml HAC孵育细胞4 h组,超声作用15 min组和5 μg/ml HAC孵育细胞4 h后进行声动力治疗,6 h后,经AnnexinV/PI染色,流式细胞仪检测细胞凋亡率。坏死率结果表明,单纯HAC(2.82%±0.29%)和单纯超声组(2.89%±0.79%)与对照组(2.63%±0.37%)相比没有明显差异,而声动力治疗组坏死率有升高趋势(4.19%±0.28%)。单纯HAC(5.53%±0.64%)和单纯超声组(6.39%±0.61%)的细胞凋亡率与对照组(5.02%±0.45%)相比没有明显差异,而声动力治疗组凋亡率明显升高(13.89%±1.07%)。同时,凋亡坏死比值结果发现,单纯HAC(2.07±0.16)和单纯超声组(2.39±0.37)与对照组(2.01±0.11)相比没有明显差异,声动力治疗组凋亡坏死比明显升高(3.39±0.21)。

Fig. 6 The percentage of apoptotic and necrotic of THP-1 macrophages and apoptosis/necrosis ratio in control, ultrasound, HAC and SDT**P<0.01vscontrol
3 讨论
动脉粥样硬化是危害人类健康最严重的疾病之一。动脉粥样硬化不稳定斑块的突发破裂是导致急性心血管事件的最重要原因[7]。在斑块的形成和发展过程中,巨噬细胞都起到非常重要的作用[8, 9]。在斑块形成早期巨噬细胞可促使低密度脂蛋白(LDL)氧化形成氧化低密度脂蛋白(ox-LDL),并通过表面的清道夫受体吞噬ox-LDL形成泡沫细胞,从而形成脂纹。在斑块的进展期,巨噬细胞通过释放基质金属蛋白酶等物质破坏斑块的纤维帽,导致斑块破裂。因此本课题组认为将巨噬细胞作为治疗的靶细胞将有效稳定斑块,从而降低动脉粥样硬化的危害。
声动力治疗是上世纪90年代由日本学者Umemura等在光动力治疗的基础上提出的一种全新治疗方法[10]。本课题组Peng C等人已经证实,光动力治疗可以通过诱导巨噬细胞凋亡有效抑制动脉粥样硬化斑块进展[4],但是光动力治疗存在光穿透深度浅的问题。声动力治疗主要利用超声在组织中衰减系数低、穿透能力强等特点作用于深部的靶组织同时对周围组织无明显影响,激活聚集在靶组织内的声敏剂产生活性氧等物质而杀伤靶组织,因此将声动力治疗用于抑制动脉粥样硬化斑块进展具有广阔的前景。本课题组前期研究表明姜黄素介导的声动力治疗可导致THP-1巨噬细胞凋亡[11]。姜黄素是从姜黄等植物的根茎中提取出的一种化学成分,具有抗炎、抗氧化、抑制肿瘤生长等作用[12,13]。由于姜黄素的羟基基团不稳定,本实验中对姜黄素的羟基进行乙酰化修饰,得到一种更稳定的新型声敏剂-羟基乙酰化姜黄素 (HAC),声动治疗时HAC的剂量明显低于姜黄素。前期实验已经证实HAC可作为光敏剂应用于光动力治疗。然而光动力治疗存在一定局限性,而与光相比,低强度超声的穿透更强,因此本实验使用超声作用于HAC,解决了光穿透深度浅的问题。
本实验使用不同浓度HAC作用于THP-1巨噬细胞4 h后,通过CCK-8检测发现,随药物浓度升高细胞存活率逐渐降低,其中5 μg/ml浓度对细胞存活率没有明显影响,而7.5 μg/ml以及10 μg/ml浓度均导致细胞存活率明显下降。使用5 μg/ml药物作用于细胞不同时间后发现5 h内细胞存活率均没有明显变化,因此判断该浓度是声动力治疗的最适浓度。同时使用单纯超声作用于细胞不同时间,发现15 min内,超声对细胞存活率没有明显影响。而在药物作用细胞4 h后,通过超声作用15 min发现细胞存活率明显下降,说明HAC在超声作用下可有效导致THP-1巨噬细胞死亡。单纯HAC以及单纯超声对细胞均没有出现明显影响,声动力治疗后细胞凋亡率和坏死率均明显增多,同时凋亡坏死比值明显升高,因此,HAC介导的声动力治疗主要是通过诱导凋亡的方式降低细胞存活率。
临床研究发现斑块内发生坏死会产生大量促炎症因子加剧斑块内炎症反应,使斑块逐渐发展成为易损斑块[14]。同坏死相比,凋亡的死亡方式更有利于斑块的稳定[15]。HAC介导的声动力治疗可有效诱导巨噬细胞凋亡说明HAC可能是一种全新的声敏剂有效应用于动脉粥样硬化的治疗。
动脉粥样硬化是全身性疾病,其发生和发展过程都受到多方面因素影响[16],目前治疗动脉粥样硬化的方法都存在一定的弊端,因此寻找一种有效治疗动脉粥样硬化的新方法势在必行。本实验中采用了THP-1诱导的巨噬细胞模型,证实HAC介导的声动力治疗在体外可有效诱导巨噬细胞凋亡,拟进一步尝试其它的巨噬细胞模型,但这种全新的方法在动物模型上的实验研究、能否在临床上应用以及其诱导凋亡的具体机制需要我们进一步研究和探讨。
[1] Lotta LA. Genome-wide association studies in atherothrombosis[J].EurJInternMed, 2010, 21(2): 74-78.
[2] Estronca LM, Silva JC, Sampaio JL,etal. Molecular etiology of atherogenesis—invitroinduction of lipidosis in macrophages with a new LDL model[J].PLoSOne, 2012, 7(4): e34822.
[3] Kzhyshkowska J, Neyen C, Gordon S. Role of macrophagescavenger receptors in atherosclerosis[J].Immunobiology, 2012, 217(5): 492-502.
[4] Peng C, Li Y, Liang H,etal. Detection and photodynamic therapy of inflamed atherosclerotic plaques in the carotid artery of rabbits[J].JPhotochemPhotobiolB, 2011, 102(1): 26-31.
[5] Cheng J, Sun X, Guo S,etal. Effects of 5-aminolevulinic acid-mediated sonodynamic therapy on macrophages[J].IntJNanomedicine, 2013, 8: 669-676.
[6] Lv Y, Fang M, Zheng J,etal. Low-intensity ultrasound combined with 5-aminolevulinic acid administration in the treatment of human tongue squamous carcinoma[J].CellPhysiolBiochem, 2012, 30(2): 321-333.
[7] Rossi A, Franceschini L, Fusaro M,etal. Carotid atheros-clerotic plaque instability in patients with acute myocardial infarction[J].IntJcardiol, 2006, 111(2): 263-266.
[8] De Meyer I, Martinet W, De Meyer GR. Therapeutic strategies to deplete macrophages in atherosclerotic plaques[J].BrJClinPharmacol, 2012, 74(2): 246-263.
[9] Guo S, Sun X, Cheng J,etal. Apoptosis of THP-1 mac-rophages induced by protoporphyrin IX-mediated sonodynamic therapy[J].IntJNanomedicine, 2013, 8: 2239-2246.
[10]Umemura S, Yumita N, Nishigaki R,etal. Mechanism of cell damage by ultrasound in combination with hematoporphyrin[J].JpnJCancerRes, 1990, 81(9): 962-966.
[11]Wang F, Gao Q, Guo S,etal. The sonodynamic effect of curcumin on THP-1 cell-derived macrophages[J].BiomedResInt, 2013: 737264.
[12]殷广梅, 喻林升, 吴淑珍, 等。姜黄素对大鼠脑缺氧缺血损伤时脑组织MDA变化、caspase-3表达及细胞凋亡的影响[J]. 中国应用生理学杂志, 2010, 26(4): 504-506.
[13]周俊辉, 郝卯林, 赵 珊, 等。姜黄素对小鼠肺缺血/再灌注损伤时细胞凋亡及CHOP的影响[J]. 中国应用生理学杂志, 2013, 29(4): 318-323.
[14]Martinet W, Verheye S, De Meyer GR. Selective depletion of macrophages in atherosclerotic plaquesviamacrophage-specific initiation of cell death[J].TrendsCardiovascMed, 2007, 17(2): 69-75.
[15]Tabas I. Macrophage death and defective inflammation resolution in atherosclerosis[J].NatRevImmunol, 2010, 10(1): 36-46.
[16]Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J].Nature, 2011, 473(7347): 317-325.
Effects of hydroxyl acetylated curcumin induced sonodynamic therapy on viability, apoptosis and necrosis of THP-1 macrophages
YANG Li-ming1, LIANG Hui-juan2, PENG Cheng-hai3, Cheng Jia-li4, WANG Huan4, WENG Li-qing4,
LI Zhi-tao4, TIAN Ye1,4(1. Department of Pathophysiology, Harbin Medical University, Harbin 150081; 2. Laboratory of Sono- and Photo-theranostic Technologies,Harbin Institute of Technology, Harbin 150001; 3. Department of Emergency Medicine, the Forth Affiliated Hospital,Harbin Medical University, Harbin 150001; 4. Department of Cardiology, the First Affiliated Hospital, Harbin Medical University, Harbin 150001, China)
Objective: We aim to investigate the sonodynamic effect induced by hydroxyl acetylated curcumin (HAC) on THP-1 macrophages. Methods: THP-1 derived macrophages(1×105per milliliter)were cultured with HAC at a concentration of 5 μg/ml for 4 h and then exposed to pulse ultrasound treatment (0.5 W/cm2) for 5 min. Six hours later, cell viability analysis was performed with CCK-8 assay, apoptosis and necrosis analysis were detected with Annexin V/PI staining by flow cytometery. Results: The cell viability of THP-1 macrophage decreased significantly in the group treated with the combination of HAC and ultrasound (P<0.01), and HAC-SDT induced both apoptosis and necrosis in THP-1 macrophages, the apoptotic rate was higher than the necrotic rate with appropriate conditions, the maximum apoptosis/necrosis ratio was detected in sonodynamic therapy(SDT) group (P<0.01). Conclusion: hAC-SDT was effective to induce THP-1 macrophages apoptosis.
hydroxyl acetylated curcumin(HAC); sonodynamic therapy (SDT); macrophage; apoptosis
黑龙江省教育厅科学技术研究项目资助(11551151)
2014-10-13 【修回日期】2015-02-13
R3
A
1000-6834(2015)02-102-005
10.13459/j.cnki.cjap.2015.02.002
△【通讯作者】Tel: 0451-86674548; E-mail: limingyang@ems.hrbmu.edu.cn

