激活PPARα缓解PPARγ诱导的小鼠脂肪肝
白亮,王蓉,罗肖,赵四海,刘恩岐
(西安交通大学医学部1.心血管研究中心动脉粥样硬化与脂代谢研究室;2.医学实验动物中心;3.基础医学院生理学与病理生理学系,西安 710061)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种无过量饮酒史,以肝细胞脂肪变性和脂肪贮积为特征的临床病理综合征。肝脏脂肪代谢长期紊乱,会逐渐发展为非酒精性肝炎、肝硬化,最终导致肝癌,严重威胁人类健康。因而,探索调控肝脏脂肪代谢和系统能量平衡的分子机制对脂肪肝疾病的防治意义深远。
研究表明,肝脏脂肪代谢主要受过氧化物酶体增殖子激活受体(peroxisome proliferator-activated receptor,PPARs)调控[1,2]。PPARs 核受体超家族有三个成员:PPARα、PPARβ/δ 和 PPARγ[3]。PPARα在脂肪酸氧化代谢活跃的组织如肝、肾、心脏、小肠和骨骼肌中高表达,主要参与能量消耗[4]。文献已报道,PPARα是脂肪酸的敏感器,通过调控线粒体、过氧化物酶体和微粒体氧化代谢系统影响肝脏脂质代谢[5,6]。PPARα 失活,能量消耗减少,最终导致脂肪肝和肝炎[7,8]。
与PPARα作用相反,PPARγ主要参与能量储存,是脂肪细胞分化、脂肪生成以及能量代谢的关键调控子[3,9]。PPARγ在脂肪组织高表达,在肝脏组织表达较低,但其在肝脏脂肪生成中也发挥重要调控作用[10,11]。PPARγ的表达升高是脂肪肝的一个重要指标。研究发现,在一些小鼠动物模型中,如ob/ob和 PPARα-/-小鼠脂肪肝中,PPARγ 的表达显著升高[12-14]。外源表达PPARγ导致小鼠生成脂肪肝,并诱导脂肪特异性基因和成脂相关基因的大量表达[11]。那么,激活PPARα是否会影响PPARγ对肝脏脂肪代谢的调控,目前尚不清楚。
本研究发现,野生型小鼠先给予PPARα激动剂Wy-14,643,再给予 Ad/PPARγ 刺激,小鼠肝脏脂肪变性明显减轻,表明激活 PPARα能够有效缓解PPARγ诱导的小鼠肝脏脂肪变。本实验为研究肝脏脂肪代谢平衡提供了新的线索,为非酒精性脂肪肝的预防与治疗提供了新的研究思路。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF级野生型小鼠(C57BL/6J,wild type,WT),4~5周龄,体重18~20 g,购于西安交通大学医学部医学实验动物中心【SCXK(陕)2012-003】,实验在西安交通大学医学部医学实验动物中心屏障动物房进行【SYXK(陕)2012-005】。12 h/12 h光照/黑暗交替,自由饮水。
实验分为4组,每组3~4只小鼠。第1组,即正常饮食(Teklad#7904;Harlan-Teklad,Indianapolis,IN)组;第2 组小鼠给予 0.125%Wy-14,643 的饮食8 d;第3组小鼠通过尾静脉注射给予Ad/PPARγ(病毒浓度为1 ×1011vp,体积为300 μL)5 d;第4组小鼠预先给予0.125%Wy-14,643的饮食3 d,再尾静脉注射给予Ad/PPARγ 5 d。所有动物处理程序均符合美国NIH实验动物管理法。
1.1.2 主要试剂、实验材料
Wy-14,643 购自美国 Sigma 公司;Ad/PPARγ病毒原液来自美国西北大学Feinberg医学院Janardan K.Reddy教授实验室。
1.2 实验方法
1.2.1 苏木素-伊红(H&E)染色法
取一小块肝脏组织,经4%甲醛固定24~48 h,常规石蜡包埋,4 μm切片。按以下步骤脱蜡染色:二甲苯(I)5 min,二甲苯(II)5 min,二甲苯(III)5 min;100%乙醇3 min,95%乙醇3 min,80%乙醇3 min,蒸馏水冲洗3 min;苏木素染色3 min,流水冲洗3 min;盐酸乙醇分化10 s,自来水冲洗3 min;0.2%氨水返蓝10 s,自来水冲洗3 min;伊红染色30 s,然后进行脱水和透明,即80%乙醇3 min,95%乙醇 3 min,100%乙醇(I)3 min,100% 乙醇(II)3 min;二甲苯10 min,中性树脂封片、照相。
1.2.2 油红O染色法
从-80℃冰箱取出肝脏冰冻切片(5 μm)置于室温5 min,4%的冰甲醛固定5 min,蒸馏水轻轻冲洗3次,放入100%丙二醇5 min(避免水进入油红O染液),0.5%的油红O染液60℃ 8 min。之后,用85%丙二醇洗涤5 min,蒸馏水轻轻冲洗3次。最后,用苏木精复染5 s,自来水冲洗3 min,蒸馏水洗涤2次,甘油明胶封片、照相。
1.2.3 统计学分析
实验数据利用GraphPad Prism软件(GraphPad Software Inc.,San Diego,CA,USA)中的 One-way ANOVA进行分析,用Tukey检验法比较不同处理之间的差异。
2 结果
2.1 大体形态学及肝脏/体重比变化
正常对照组小鼠肝脏形态正常,肝脏与体重比平均为5.5%(图1A和E);当给予PPARα激动剂Wy-14,643处理8 d,小鼠肝脏出现肥大,肝脏与体重比平均为10.8%,表现明显的过氧化物酶体增殖反应(图1B和E);野生型小鼠尾静脉注射1×1011Ad/PPARγ 5 d,小鼠肝脏体积显著增大,肝脏与体重比平均为14.6%,呈现典型脂肪肝(图1C和E);预先给予小鼠PPARα激动剂Wy-14,643处理 3 d,再给予Ad/PPARγ刺激5 d,小鼠肝脏增大更加显著,肝脏与体重比高达17.3%,但脂肪肝表型减弱(图1D和E)。
2.2 病理组织形态学分析
为了进一步分析PPARα激活后对PPARγ刺激的小鼠脂肪肝的作用,我们进行了H&E和油红O染色分析。H&E染色和油红O染色揭示,正常对照组小鼠肝脏组织形态正常,肝细胞中几乎无脂肪积聚(图2A和3A),而Wy-14,643处理组小鼠肝细胞增殖明显,肝细胞中也几乎无脂肪积聚(图2B和3B)。相反,Ad/PPARγ处理组小鼠肝细胞中聚集大量的脂肪(图2C和3C)。与Ad/PPARγ处理组相比,用 PPARα 激动剂 Wy-14,643预处理,再用Ad/PPARγ刺激,小鼠肝细胞中脂滴聚集明显减少(图2D和3D)。
3 讨论
机体内三大脂肪酸氧化系统:线粒体β氧化、过氧化物酶体β氧化和微粒体ω氧化系统均受PPARα 调控[6,8]。研究表明,PPARα 通过上调脂肪酸氧化能力来控制脂肪酸摄入,进而调控肝脏能量消耗[1,6,8]。而另一核受体成员 PPARγ 是脂肪生成的关键调控子,外源表达PPARγ能够促进脂肪细胞分化,促进肝脏脂肪变性[10,11]。本研究发现,给予PPARα激动剂 Wy-14,643 预处理,再给予 Ad/PPARγ刺激,小鼠肝脏脂肪变性明显减轻,提示激活PPARα能够缓解PPARγ诱导的脂肪肝,为进一步研究PPARα与PPARγ之间的网络调控奠定了实验基础,同时为临床预防与治理脂肪肝疾病提供了实验基础。
PPARα通过上调脂肪酸氧化代谢,进而促进能量消耗[1]。研究表明,给小鼠PPARα激动剂—Wy-14,643能够逆转日粮诱导的肝脏纤维化和脂肪性肝炎[15]。同样,给大鼠注射PPARα激动剂—氯贝特类药物,可抵抗蛋氨酸胆碱缺失日粮诱导的脂肪性肝炎,且使肝脏纤维化发生逆转[16]。相反,PPARα-/-小鼠在长期禁食状态下呈现出严重的脂肪肝,主要是由于脂肪酸氧化代谢能力下降,不能有效氧化代谢进入肝脏的脂肪酸[7]。而且,饲喂蛋氨酸胆碱缺失日粮的PPARα-/-小鼠表现出严重的脂肪性肝炎[17]。与上述结果相一致,我们给野生型小鼠饲喂含有Wy-14,643的日粮,从肝脏大体形态以及组织学观察发现,Wy-14,643有效地激活了PPARα,推测其有效启动了脂肪酸氧化系统。
PPARγ通过刺激成脂关键基因的表达,促进成熟脂肪细胞脂质的生成和储存。研究发现,在ob/ob和PPARα-/-小鼠脂肪肝中,PPARγ的表达显著升高[12-14]。外源表达 PPARγ能促进 NIH3T3成纤维细胞向脂肪细胞分化并诱导生脂基因表达[11,18]。肝脏高表达PPARγ刺激小鼠形成脂肪肝,并诱导脂肪特异性基因和成脂相关基因的强烈表达[10]。相反,ob/ob和脂肪萎缩的AZIP小鼠背景下,肝脏特异性敲除 PPARγ 能显著地缓解脂肪肝症状[19,20]。与上述结果一致,我们发现,给小鼠尾静脉注射Ad/PPARγ,肝脏增大,肝细胞出现脂肪变,表明外源表达PPARγ促进脂肪肝的形成,提示肝脏脂肪合成代谢增加,肝脏能量存储增多。那么,PPARα与PPARγ的作用会不会相互抵消呢?
本研究中,预先给小鼠饲喂含有Wy-14,643的日粮,激活PPARα,启动其调控的脂肪酸氧化系统,再给小鼠尾静脉注射Ad/PPARγ,外源表达PPARγ,刺激肝脏脂肪变性。肝脏大体形态和组织形态学表明激活PPARα可以有效减缓PPARγ诱导的脂肪肝。然而,有关脂肪形成、脂肪酸氧化系统相关基因及蛋白的表达需要进一步研究,以阐明激活PPARα缓解PPARγ诱导脂肪变的分子机制。
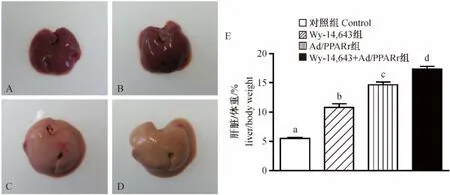
注:A.野生型小鼠肝脏;B.Wy-14,643处理组小鼠肝脏;C.Ad/PPARγ处理组小鼠肝脏;D.Wy-14,643+Ad/PPARγ处理组小鼠肝脏;E,肝脏重量与体重百分比,不同字母表示差异有显著性(采用 Tukey方法进行多重比较,其中,Control vs.Wy-14,643,Control vs.Ad/PPARγ,Control vs.Wy-14,643+Ad/PPARγ,Wy-14,643 vs.Ad/PPARγ,Wy-14,643 vs.Wy-14,643+Ad/PPARγ,P < 0.01;Ad/PPARγ vs.Wy-14,643+Ad/PPARγ,P <0.05)。图1 小鼠肝脏大体形态及重量变化Note.A.A wild-type mouse;B.A mouse treated with Wy-14,643;C.A mouse treated with Ad/PPARγ;D.A mouse liver treated with Wy-14,643+Ad/PPARγ;E.Liver to body weight ratio.The different letter shows significant difference(Tukey’s multiple comparison test,Control vs.Wy-14,643,Control vs.Ad/PPARγ,Control vs.Wy-14,643+Ad/PPARγ,Wy-14,643 vs.Ad/PPARγ,Wy-14,643 vs.Wy-14,643+Ad/PPARγ,P <0.01;Ad/PPARγ vs.Wy-14,643+Ad/PPARγ,P <0.05).Fig.1 Gross changes of the mouse livers.
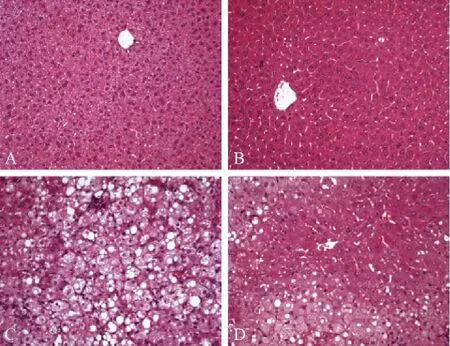
注:A.野生型小鼠肝脏;B.Wy-14,643处理组小鼠肝脏;C.Ad/PPARγ 处理组小鼠肝脏;D.Wy-14,643+Ad/PPARγ 处理组小鼠肝脏。图2 各组小鼠肝脏病理组织(H&E染色,×20)Note.A.A wild-type mouse;B.A mouse treated with Wy-14,643;C.A mouse treated with Ad/PPARγ;D.A mouse liver treated with Wy-14,643+Ad/PPARγ.Fig.2 Histological appearance of the liver tissues.H&E staining,×20
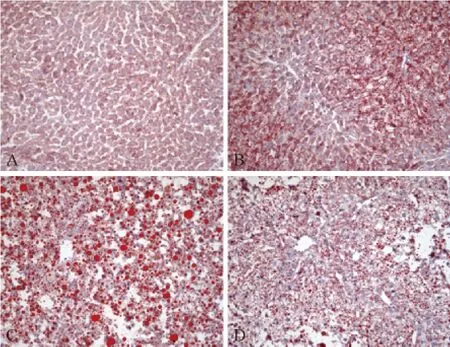
注:A.野生型小鼠肝脏;B.Wy-14,643处理组小鼠肝脏;C.Ad/PPARγ 处理组小鼠肝脏;D.Wy-14,643+Ad/PPARγ 处理组小鼠肝脏。图3 各组小鼠肝脏病理组织(油红O染色,×20)Note.A.A wild-type mouse;B.A mouse treated with Wy-14,643;C.A mouse treated with Ad/PPARγ;D.A mouse treated with Wy-14,643+Ad/PPARγ.Fig.3 Histological appearance of the mouse liver.Oil red O staining,×20
[1]Misra P,Reddy JK.Peroxisome proliferator-activated receptor-alpha activation and excess energy burning in hepatocarcinogenesis[J].Biochimie,2014,98:63 -74.
[2]Vluggens A,Reddy JK.Nuclear receptors and transcription factors in the development of fatty liver disease[J].Curr Drug Metab,2012,13(10):1422-1435.
[3]Wang YX.PPARs:diverse regulators in energy metabolism and metabolic diseases[J].Cell Res,2010,20(2):124 -137.
[4]Kliewer SA,Forman BM,Blumberg B,et al.Differential expression and activation of a family of murine peroxisome proliferator-activated receptors[J].Proc Natl Acad Sci U S A,1994,91(15):7355-7359.
[5]Gao Q,Jia Y,Yang G,et al.PPARα deficient ob/ob obese mice become more obese and manifest severe hepatic steatosis due to decreased fatty acid oxidation [J].Am J Pathol,2015,185(5):1396-408
[6]Rao MS,Reddy JK.PPARα in the pathogenesis of fatty liver disease[J].Hepatology,2004,40(4):783 -786.
[7]Hashimoto T,Cook WS,Qi C,et al.Defect in peroxisome proliferator-activated receptor alpha-inducible fatty acid oxidation determines the severity of hepatic steatosis in response to fasting[J].J Biol Chem,2000,275(37):28918-28928.
[8]Pawlak M,Lefebvre P,Staels B.Molecular mechanism of PPARα action and its impact on lipid metabolism,inflammation and fibrosis in non-alcoholic fatty liver disease [J].J Hepatol,2015,62(3):720-733.
[9]Janani C,Ranjitha Kumari BD.PPAR gamma gene—a review[J].Diabetes Metab Syndr,2015,9(1):46 -50.
[10]Bai L,Jia Y,Viswakarma N,et al.Transcription coactivator mediator subunit MED1 is required for the development of fatty liver in the mouse[J].Hepatology,2011,53(4):1164 -1174.
[11]Tontonoz P,Hu E,Spiegelman BM.Stimulation of adipogenesis in fibroblasts by PPAR gamma 2,a lipid-activated transcription factor[J].Cell,1994,79(7):1147 -1156.
[12]Costet P,Legendre C,More J,et al.Peroxisome proliferator-activated receptor alpha-isoform deficiency leads to progressive dyslipidemia with sexually dimorphic obesity and steatosis[J].J Biol Chem,1998,273(45):29577-29585.
[13]Memon RA,Tecott LH,Nonogaki K,et al.Up-regulation of peroxisome proliferator-activated receptors(PPAR-alpha)and PPAR-gamma messenger ribonucleic acid expression in the liver in murine obesity:troglitazone induces expression of PPAR-gamma-responsive adipose tissue-specific genes in the liver of obese diabetic mice[J].Endocrinology,2000,141(11):4021 -4031.
[14]Vidal-Puig A,Jimenez-Linan M,Lowell BB,et al.Regulation of PPAR gamma gene expression by nutrition and obesity in rodents[J].J Clin Invest,1996,97(11):2553 -2561.
[15]Ip E,Farrell G,Hall P,et al.Administration of the potent PPARalpha agonist,Wy-14,643,reverses nutritional fibrosis and steatohepatitis in mice[J].Hepatology,2004,39(5):1286 -1296.
[16]Rao MS,Papreddy K,Musunuri S,et al.Prevention/reversal of choline deficiency-induced steatohepatitis by a peroxisome proliferator-activated receptor alpha ligand in rats [J].In Vivo,2002,16(2):145-152.
[17]Kashireddy PV,Rao MS.Lack of peroxisome proliferator-activated receptor alpha in mice enhances methionine and choline deficient diet-induced steatohepatitis[J].Hepatol Res,2004,30(2):104-110.
[18]Rosen ED,Sarraf P,Troy AE,et al.PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro[J].Mol Cell,1999,4(4):611-617.
[19]Gavrilova O,Haluzik M,Matsusue K,et al.Liver peroxisome proliferator-activated receptorgamma contributesto hepatic steatosis,triglyceride clearance,and regulation of body fat mass[J].J Biol Chem,2003,278(36):34268-34276.
[20]Matsusue K,Haluzik M,Lambert G,et al.Liver-specific disruption of PPARgamma in leptin-deficient mice improves fatty liver but aggravates diabetic phenotypes[J].J Clin Invest,2003,111(5):737-747.

