不同小鼠品系囊胚受体对C57BL/6胚胎干细胞种系嵌合效率的影响
周舒雅,左琴,刘甦苏,王辰飞,李保文,贺争鸣,范昌发
(1.中国食品药品检定研究院实验动物资源研究所,国家啮齿类实验动物种子中心,北京 100050;2.北京百奥赛图基因生物技术有限公司,北京 101111)
转基因技术目前已经成为基因功能研究和药物开发筛选中不可或缺的工具。尤其,近年转基因技术飞速发展[1-6],其中通过同源重组(homologous recombination,HR)的基因打靶技术最为成熟,几乎能够满足对任何基因不同时间、空间修饰表达的要求,应用最为广泛。C57BL/6背景的胚胎干细胞(embryonic stem cells,ESC)被认为是用于同源重组的最佳选择,其纯背景使所获得的基因打靶动物省去了回交到C57BL/6的时间,从而也避免了由背景不纯引起的不稳定结果[7-9]。为了获得C57BL/6 ES细胞的种系遗传(germline transmission,GLT),传统认为BALB/c品系作为囊胚供体效率最高[9-13]。然而,BALB/c胚胎获得效率很低,并且对激素超数排卵不敏感[14],所获的胚胎均一性较差,相对于其他品系发育延迟[11,13],因此,制约了利用 C57BL/6 ES 细胞制备打靶小鼠的效率。有研究尝试通过体外成熟或者利用C3H×BALB/c的杂交胚胎等方法提高胚胎获得的效率[11],然而受BALB/c品系本身特性限制,很难有较大的提高。近年也有利用C57BL/6[15]及其Tyr基因突变的白化品系作为胚胎供体的研究,包括C57BL/6-Tyrc-Brd、C57BL/6N-TyrcWTSI 和 C57BL/6NTac-Atm1.1ArteTyrtm1Arte等[16-18]。然而,其中C57BL/6J和 C57BL/6-Tyrc-Brd 在F1代中不能通过毛色判断是否成功种系遗传。据近期报道,C57BL/6N-TyrcWTSI和C57BL/6NTac-Atm1.1ArteTyrtm1Arte具有通过毛色区分种系遗传与否的能力,并且对激素超排敏感,但是目前国内尚无可用资源。本研究通过在多个不同基因修饰ES细胞的种系嵌合实验中,尝试使用 ICR、B6(Cg)-Tyrc-2J等未见报道的小鼠品系作为囊胚供体,与BALB/c品系的种系嵌合效率相比较,从而为通过同源重组如何高效的制作基因打靶动物提供有益的参考。
1 材料和方法
1.1 实验动物
SPF级BALB/c小鼠233只,体重16~18 g,6周龄;SPF级ICR小鼠115只,体重20~22 g,6周龄;SPF 级 B6(Cg)-Tyrc-2J小鼠 255 只,体重 16 ~ 18 g,6周龄;SPF级KM 小鼠30只,体重20~22 g,6周龄。本实验所用实验动物均由国家啮齿类实验动物种子中心提供并饲养【SCXK(京)2009-0017】【SCXK(京)2014-0013】。无菌手术在中国食品药品检定研究院动物实验设施进行【SYXK(京)2011-0018】。
本实验在中国食品药品检定研究院实验动物伦理委员会监督下进行。
1.2 胚胎干细胞
C57BL/6J ES细胞系 B6-1-6由北京百奥赛图生物技术有限公司提供。根据不同目的基因构建的打靶质粒经酶切及测序鉴定后,线性化并用于ES细胞电转染。经G418筛选,以及基因组PCR检测、Southern blot鉴定,以及核型检测,筛选出阳性打靶ES细胞。经鉴定的阳性打靶ES细胞复苏并传代后,经0.25%的胰酶消化成单细胞悬液置于冰盒,用于囊胚显微注射。
1.3 试剂与仪器
M2(M7167-100ML,SIGMA),KSOM(MR-121-D,Millipore),0.7%戊巴比妥钠溶液(Sigma),PMSG(孕马血清促性腺激素,宁波激素二厂),hCG(人绒毛膜促性腺激素,宁波激素二厂),石蜡油(M8410,Sigma)
显微操作仪(1X71,Olympus),体式显微镜(SMZ645,Nikon),CO2培养箱(8000DH,Thermo),持卵针(5175240006,Eppendorf)和注射针(930001040,Eppendorf)。
1.4 受体囊胚的采集
以 BALB/c 品系、ICR 系以及 B6(Cg)-Tyrc-2J品系小鼠为囊胚供体鼠。采用4~6周龄雌性小鼠,向小鼠腹腔注射孕马血清促性腺激素(PMSG)10 U,46~48 h后腹腔注射人绒毛膜促性腺激素(hCG)10U。注射后与同品系雄鼠合笼交配,第2天早检栓,计作0.5 d。
取用超数排卵或者自然排卵的3.5 d雌鼠,9∶00-10∶00,颈椎脱臼处死后取子宫,用 M2 培养液冲洗子宫回收囊胚,并移入覆盖石蜡油的KSOM液滴中,置37℃、5%CO2培养箱中培养备用。
1.5 显微注射[14]
13∶00-16∶00进行囊胚显微注射。在培养皿中央准备M2注射液滴并覆盖石蜡油,将ES细胞悬液及囊胚分别移入注射液滴,以斜口注射针吸取10~15个形态良好的ES细胞,沿滋养层细胞间隙注射到囊胚腔中,用KSOM溶液洗涤后移入KSOM培养液滴中,置37℃、5%CO2培养箱中培养恢复1~2 h后进行胚胎移植。
1.6 胚胎移植及嵌合鼠获得
选用KM小鼠做假孕母鼠,挑选发情前期和发情期雌鼠,1∶1与结扎雄鼠交配,次日检栓,单笼饲养备用,见栓当天为0.5 d,子宫移植用2.5 d假孕鼠。用0.7%戊巴比妥钠溶液麻醉假孕鼠后,行背部手术将显微注射恢复后的囊胚10~16个单侧移植到假孕2.5 d的小鼠子宫,单笼饲养至妊娠第20天分娩。在小鼠出生7~10 d后可由毛色判定是否嵌合鼠,白色被毛来自于供体白化小鼠,黑色被毛来自于提供ES细胞的C57BL/6J小鼠。
1.7 嵌合鼠交配及打靶小鼠的获得
嵌合鼠饲养至6~8周龄,嵌合鼠中雄鼠与野生型C57BL/6J雌鼠交配,如果ES细胞进入嵌合鼠种系分化为生殖细胞,即可遗传给子代小鼠,并表现为全黑的毛色。对黑色小鼠进行基因型检测,以确定阳性打靶小鼠。
1.8 数据统计
试验数据中两个数据间差异分析采用卡方检验(χ2),多组数据间差异分析采用SPSS 19.0软件及Graphpad Prism 5.02软件进行单因素方差分析(One-Way-ANOVA)。
2 实验结果
2.1 不同品系囊胚受体的获得
我们选取了近交系 BALB/c,B6(Cg)-Tyrc-2J,以及封闭群ICR小鼠作为囊胚供体小鼠,交配后第3.5天囊胚用于胚胎干细胞的注射。其中由于据报道BALB/c品系对激素诱导超数排卵不敏感,因此同时比较了自然排卵所获得的胚胎。如表1所示,ICR品系在囊胚采集方面效率最高,平均每只动物可获得可用囊胚6.03个,与其他品系和排卵方法相比呈现ICR激素超排>BALB/c自然排卵>B6(Cg)-Tyrc-2J激素超排 > BALB/c 激素超排的趋势。其中对于BALB/c品系,激素超排尚不如自然排卵效率高(0.82囊胚/只 vs 2.91囊胚/只)。而对于ICR来说,不但相当动物量情况下胚胎总数多,而且可用于注射的囊胚占胚胎总数的比例也显著高与其他品系,因此平均每只动物的可用囊胚数明显高于其他品系。并且,在第3.5天13:00观察胚胎,如图1所示,ICR囊胚相较于其他两个品系的囊胚腔体扩张更大,发育较均一;BALB/c胚胎有脱透明带现象,且发育不均一。
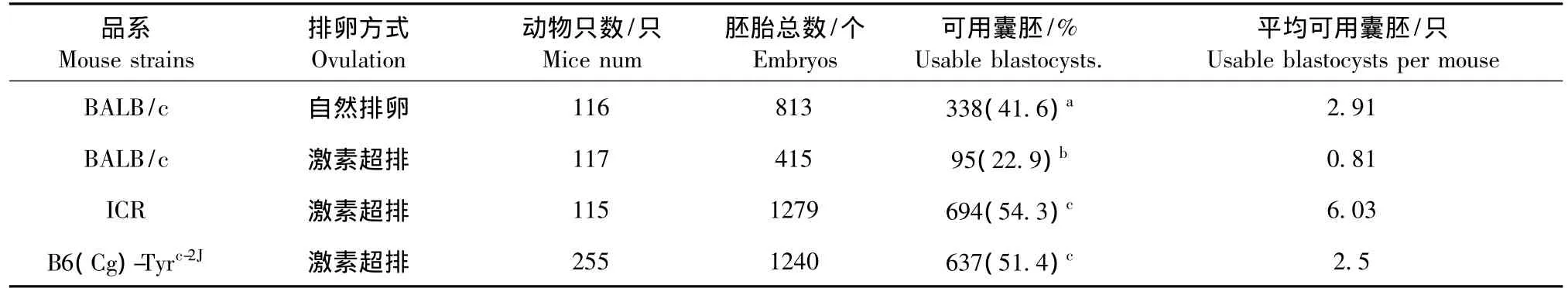
表1 不同品系囊胚获得效率比较Tab.1 Comparison of the derivation efficiency of blastocysts among the three mouse strains
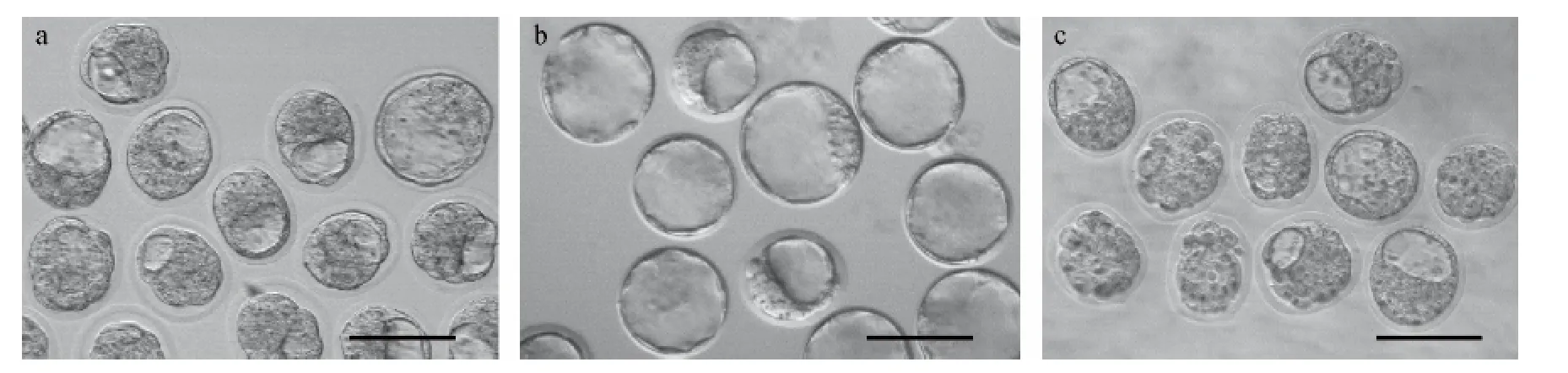
注:a.BALB/c品系小鼠3.5 d囊胚;b.ICR品系小鼠3.5 d囊胚;c.B6(Cg)-Tyrc-2J品系小鼠3.5 d囊胚。标尺=100 μm。图 1 BALB/c、ICR 和 B6(Cg)-Tyrc-2J小鼠 3.5 d 囊胚的形态Note:a.Blastocysts from BALB/c mice at3.5 dpc(days post coitus);b.Blastocysts from ICR mice at 3.5 dpc;c.Blastocysts from B6(Cg)-Tyrc-2Jmice at 3.5 dpc.Bar=100 μm.Fig.1 Morphology of blastocysts from BALB/c mice,ICR mice and B6(Cg)-Tyrc-2Jmice at 3.5 dpc.
2.2 不同品系囊胚受体对嵌合体小鼠获得效率的影响
为了比较囊胚遗传背景对嵌合鼠获得效率以及种系遗传效率的影响,在三个不同基因修饰的ES细胞囊胚嵌合实验中,均采用了BALB/c、ICR和B6(Cg)-Tyrc-2J三种囊胚作为 ES细胞受体。由于三种ES细胞各自对不同的基因进行了修饰,而所修饰的基因可能会影响嵌合的效率,因此表2~4分别比较了注射相同ES细胞的情况下,不同囊胚受体对嵌合鼠率以及种系遗传率的影响。其中,B6(Cg)-Tyrc-2J作为囊胚受体时,仅ES细胞Ai3K获得了嵌合鼠,但也未能种系遗传,未获得阳性打靶动物(表2-4)。而近交系BALB/c与封闭群ICR相比较,仅ES细胞Ai3K在利用 ICR获得嵌合鼠的效率明显高于BABL/c(表3),在TLX3和SL的实验中,二者嵌合鼠率没有显著差异(表2,4)。进而,我们通过单因素方差分析,统计 BALB/c、ICR和 B6(Cg)-Tyrc-2J三种囊胚嵌合鼠获得率均值的差异有显著性,如图2所示,BALB/c和ICR囊胚在获得嵌合鼠的效率方面没有明显差异(P>0.05)。
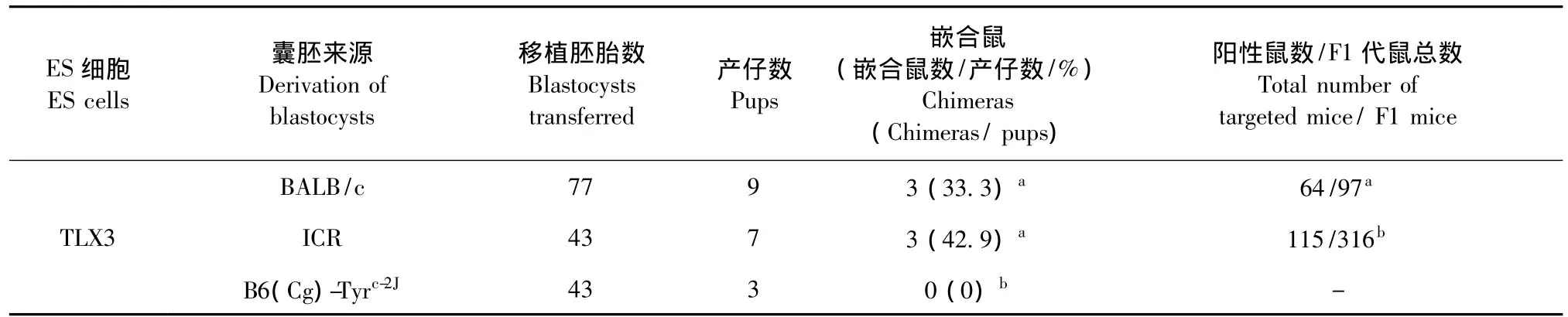
表2 不同囊胚作为TLX3-ES细胞受体所得嵌合鼠率及种系遗传率Tab.2 Chimeras derivation and germline transmission efficiency of TLX3-ES cells with blastocysts of the three mouse strains as microinjection recipients
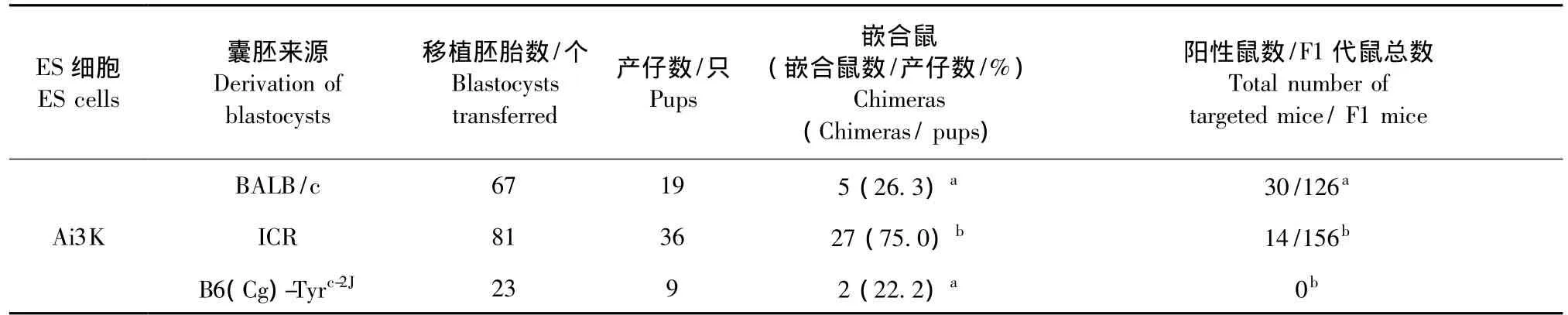
表3 不同囊胚作为Ai3K-ES细胞受体所得嵌合鼠率及种系遗传率Tab.3 Chimeras derivation and germline transmission efficiency of Ai3K-ES cells with blastocysts of the three different mouse strains as microinjection recipients
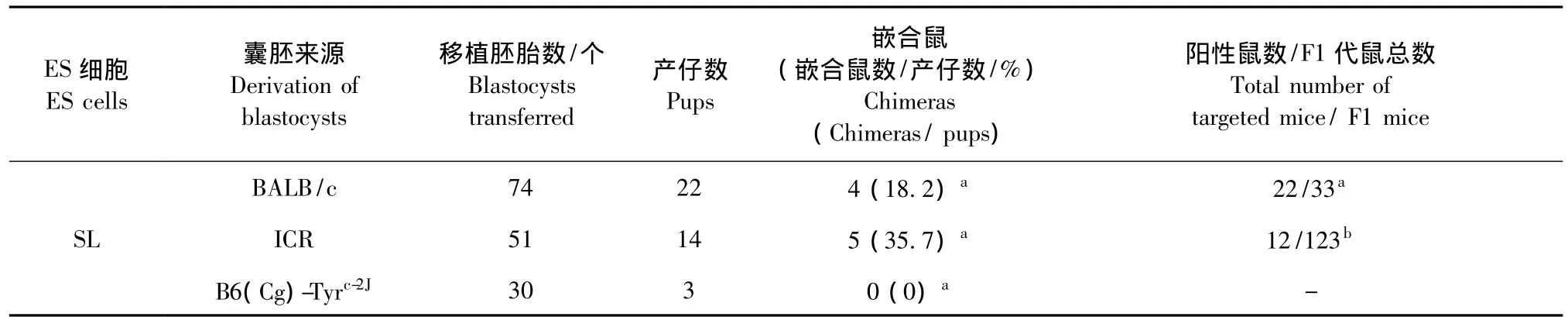
表4 不同囊胚作为SL-ES细胞受体所得嵌合鼠率及种系遗传率Tab.4 Chimeras derivation and germline transmission efficiency of SL-ES cells with blastocysts of the three different mouse strains as microinjection recipients
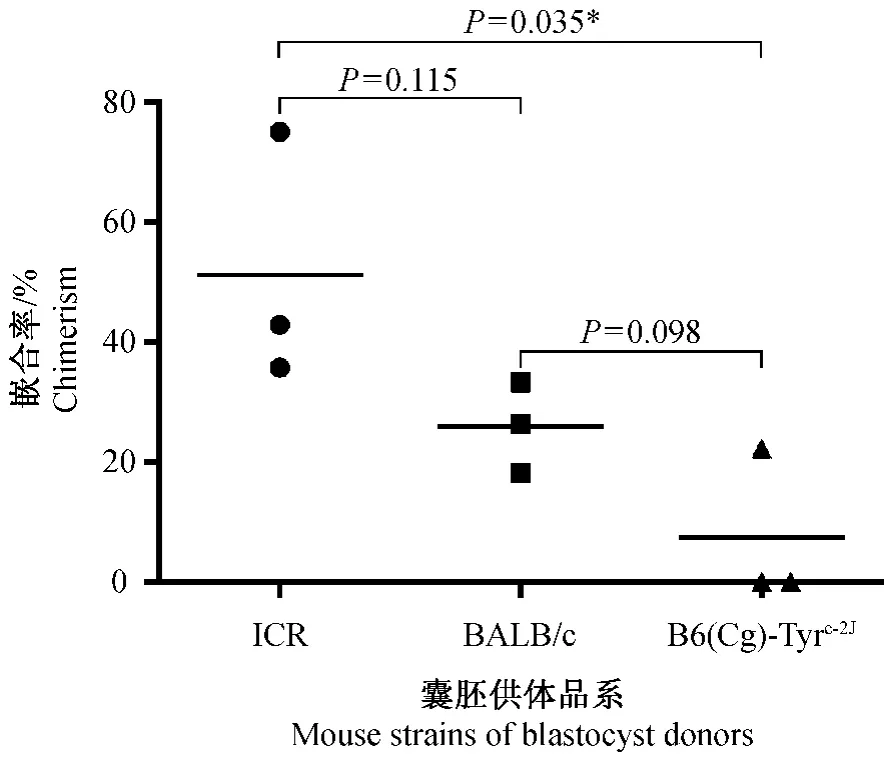
注:*代表二者在P<0.05的水平差异有显著性。图 2 ICR、BALB/c 和 B6(Cg)-Tyrc-2J三种囊胚嵌合鼠获得率显著性分析Note.*indicates that difference is significant at P<0.05 level.Fig.2 Significance analysis of blastocyst derivation efficiency among ICR,BALB/c and B6(Cg)-Tyrc-2Jmice
2.3 不同品系囊胚受体对种系遗传效率的影响
ES细胞的种系遗传是影响基因打靶小鼠获得的关键环节。ES细胞注射到BALB/c和ICR囊胚中均可获得黑白相间嵌合鼠,其中ES细胞可进入种系分化为精子,进而再与野生型C57BL/6雌鼠交配后,表现为黑毛色的小鼠(如图3)。本研究比较了BALB/c和ICR囊胚作为ES细胞受体对种系遗传效率的影响。在TLX3,Ai3K和SL三种ES细胞中,利用BALB/c囊胚的种系遗传率均显著高于ICR囊胚(P<0.05)(如表2-4)。通过对BALB/c和ICR两组数据进行统计分析,如图4,可以更直观地看到使用BALB/c囊胚和ICR囊胚在种系遗传效率上的差异。

注:黑色小鼠为来源于C57BL/6 ES细胞种系遗传的后代。图3 嵌合鼠以及与C57BL/6雌鼠交配后代Note.The black coated pups are derived from germline transmission of C57BL/6 ES cells.Fig.3 Pups of male chimera mated with C57BL/6 female mice
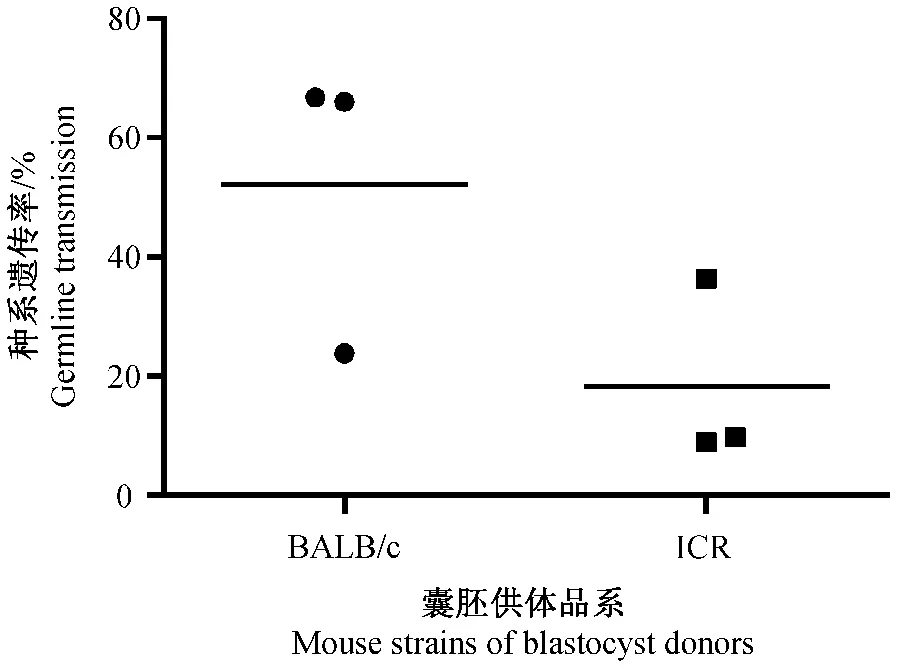
图4 ICR和BALB/c囊胚对C57BL/6 ES细胞种系遗传效率的影响Fig.4 Effect of ICR and BALB/c blastocysts on germline transmission efficiency of C57BL/6 ES cells
3 讨论
由于C57BL/6近交系小鼠遗传背景信息丰富且清楚,因此在基因打靶小鼠模型的应用中被生物学和医学研究所广泛接受[12]。虽然129品系的胚胎干细胞由于稳定和易于种系嵌合等因素而更为常用[8],但是不可避免地需要在获得打靶动物后回交到C57BL/6品系,因此十分耗时耗力。而直接通过C57BL/6胚胎干细胞同源重组制作基因打靶小鼠能够极大地缩短周期。
对于 C57BL/6胚胎干细胞,传统研究认为BALB/c小鼠较适合作 ES细胞注射的囊胚供体[10]。然而BALB/c胚胎有发育延迟,透明带脆性强等特点,影响操作效率。因此有研究尝试其他品系的囊胚,包括 C3H ×BALB/c杂交胚胎[19],以及近期培育出的 C57BL/6N 白化突变品系[16-18]。我们尝试用ICR品系和白化的 B6(Cg)-Tyrc-2J品系胚胎来替代BALB/c囊胚,三者均可通过F1代毛色判断出是否成功种系遗传。在与整体效率相关的三个环节——囊胚采集、囊胚注射获得嵌合鼠,以及种系遗传获得打靶动物中,我们分别比较了不同品系的囊胚对其影响。其中,与之前文献报道相符[11],利用BALB/c囊胚作受体在种系遗传中效率确实明显高于其他品系囊胚。然而,在囊胚获得方面,由于BALB/c小鼠对激素超排不敏感,较难获得大量的、发育均一的囊胚,因此ICR品系较之具有明显优势。在嵌合鼠获得效率上,ICR与BALB/c没有显著差异。同时,我们也尝试比较了 B6(Cg)-Tyrc-2J品系,本研究中三种ES细胞在其中的嵌合效率较低,未能获得种系遗传。总体而言,除BALB/c小鼠外,ICR小鼠作为囊胚供体也能够以较高的效率获得C57BL/6胚胎干细胞的种系遗传,因而可以作为C57BL/6胚胎干细胞囊胚注射中较好的选择。
[1]Geurts AM,Cost GJ,Freyvert Y,et al.Knockout rats via embryo microinjection of zinc-finger nucleases [J].Science,2009.325(5939):433.
[2]Tesson L,Usal C,Menoret S,et al.Knockout rats generated by embryo microinjection of TALENs[J].Nat Biotechnol,2011.29(8):695-696.
[3]Mali P,Yang L,Esvelt KM,et al.RNA-guided human genome engineering via Cas9 [J].Science,2013.339(6121):823 -826.
[4]Ran FA,Hsu PD,Wright J,et al.Genome engineering using the CRISPR-Cas9 system[J].Nat Protoc,2013.8(11):2281-2308.
[5]Tong C,Li P,Wu NL,et al.Production of p53 gene knockout rats by homologous recombination in embryonic stem cells[J].Nature,2010.467(7312):211-213.
[6]马元武,马婧,路迎冬,等.利用CRISPR/Cas9敲除大鼠胰岛素受体底物1(Irs1)基因[J].中国比较医学杂志,2014(03):55-60.
[7]Gerlai R,Gene-targeting studies of mammalian behavior:is it the mutation or the background genotype?[J].Trends Neurosci,1996.19(5):177 -181.
[8]Simpson EM,Linder CC,Sargent EE,et al.Genetic variation among 129 substrains and its importance for targeted mutagenesis in mice[J].Nat Genet,1997.16(1):19 - 27.
[9]Auerbach W,Dunmore JH,Fairchild-Huntress V,et al.Establishment and chimera analysis of 129/SvEv- and C57BL/6-derived mouse embryonic stem cell lines [J].Biotechniques,2000.29(5):1024-1028,1030,1032.
[10]Ledermann B,Burki K.Establishment of a germ-line competent C57BL/6 embryonic stem cell line [J].Exp Cell Res,1991.197(2):254-258.
[11]Lemckert FA,Sedgwick JD,and Korner H.Gene targeting in C57BL/6 ES cells.Successful germ line transmission using recipient BALB/c blastocysts developmentally matured in vitro[J].Nucleic Acids Res,1997.25(4):917 -918.
[12]Ware CB,Siverts LA,Nelson AM,et al.Utility of a C57BL/6 ES line versus 129 ES lines for targeted mutations in mice[J].Transgenic Res,2003.12(6):743-746.
[13]Schuster-Gossler K,Lee AW,Lerner CP,et al.Use of coisogenic host blastocysts for efficient establishment of germline chimeras with C57BL/6J ES cell lines[J].Biotechniques,2001.31(5):1022-1024,1026.
[14]Nagy A,M.Gertsenstein,K.Vintersten.Manipulating the Mouse Embryo:A Laboratory Manual[M].New York:Cold Spring Harbor Laboratory Press,2003.453-506.
[15]Fielder TJ,Yi CS,Masumi J,et al.Comparison of male chimeric mice generated from microinjection of JM8.N4 embryonic stem cells into C57BL/6J and C57BL/6NTac blastocysts[J].Transgenic Res,2012.21(6):1149-1158.
[16]Pettitt SJ,Liang Q,Rairdan XY,et al.Agouti C57BL/6N embryonic stem cells for mouse genetic resources[J].Nat Methods,2009.6(7):493-495.
[17]Ryder E,Wong K,Gleeson D,et al.,Genomic analysis of a novel spontaneous albino C57BL/6N mouse strain [J].Genesis,2013.51(7):523-528.
[18]Zevnik B,Uyttersprot NC,Perez AV,et al.C57BL/6N albino/agouti mutant mice as embryo donors for efficient germline transmission of C57BL/6 ES cells[J].PLoS ONE,2014.9(3):e90570.
[19]Pacholczyk G,Suhag R,Mazurek M,et al.Generation of C57BL/6 knockout mice using C3H x BALB/c blastocysts[J].Biotechniques,2008.44(3):413-416.

