DSAEK手术植片厚度和大小对角膜内皮细胞密度的远期影响
顾绍峰 彭荣梅 肖格格 冯云 洪晶
北京大学第三医院眼科 眼部神经损伤的重建保护与康复北京市重点实验室,北京 100191
角膜后弹力层剥除联合自动角膜刀取材内皮移植术(Descemet stripping automated endothelial keratoplasty,DSAEK)具有排斥反应少、学习曲线短、手术风险小、术后视力恢复快等优点,彻底推动了角膜内皮移植手术在全球的广泛开展,并取代传统的穿透角膜移植术成为目前治疗角膜内皮疾病的主要方法[1]。然而随着手术技术的日臻成熟,对手术效果的要求也越来越高。有研究发现,供体角膜内皮移植片越薄,则术后视力恢复越好,内皮细胞丢失率越低[2-3]。因而在传统的DSAEK基础上,发展出了薄植片手术方案,如超薄DSAEK[4]。但这一结论目前仍存在很多争议,有大量研究发现供体植片厚度与术后视力、角膜内皮细胞密度(endothelial cell density,ECD)无关[5-7],甚至有研究认为薄植片会增加角膜内皮细胞的丢失[8]。而中国人的眼部解剖结构与欧美等人群存在明显差异。国外报道的DSAEK手术供体植片多为大植片,直径多为8.5 mm或以上[9],国内DSAEK手术的供体植片则多为小植片(直径多为8.0 mm或以下)。而关于小植片DSAEK手术移植片厚度和大小对术后ECD的影响尚未见报道。本研究拟探讨国内DSAEK术后2年供体植片的厚度和大小对ECD的影响,为符合国人眼部特点的小植片DSAEK手术提供研究基础。
1 资料与方法
1.1 一般资料
采用系列病例观察研究,收集2013年1月至2017年12月因角膜内皮功能失代偿在北京大学第三医院眼科中心行DSAEK手术的患者134例144眼,年龄4~88岁,平均(52.2±20.2)岁。其中男65例73眼,女69例71眼;右眼74眼,左眼70眼;术前平均眼压(15.4±5.3)mmHg(1 mmHg=0.133 kPa)。所有患者均完成2年随访且资料完整。导致角膜内皮失代偿的原因包括Fuchs角膜内皮营养不良14眼、其他类型角膜内皮营养不良11眼、白内障摘出术后54眼、抗青光眼术后19眼、玻璃体切割术后7眼、角膜移植术后20眼、眼外伤6眼和其他病因13眼。因术后3个月角膜供体中央植片厚度(central graft thickness,CGT)基本稳定,故根据术后3个月CGT将患者分为薄植片组45眼、中等厚植片组66眼和厚植片组33眼,分别为供体CGT<100 μm、≥100~<150 μm和≥150 μm。按照角膜环钻切割的供体植片大小分为小植片组31眼和大植片组113眼,供体植片直径分别为≥7~<8 mm和≥8~<9 mm。本研究遵循《赫尔辛基宣言》,经北京大学第三医院伦理委员会审核批准(批文号:IRB00006761-2008025),所有患者术前均签署知情同意书。
1.2 方法
1.2.1供体ECD检查 术前采用角膜内皮镜(HAI EB-3000XYZ,美国HAI Laboratories公司)测量供体ECD。将眼库标准化处理的供体角膜移植片放入装有保存液的玻璃瓶中,并放入HAI EB-3000XYZ型内皮显微镜的固定槽中,调节镜头位置,使内皮细胞显示清晰,选定50~100个细胞,使用机器自带内皮分析软件(HAI CAS EB 2.10)对供体角膜ECD进行分析。
1.2.2活体角膜激光扫描共聚焦显微镜检查 术后1、3、6、12和24个月,采用海德堡活体角膜激光扫描共聚焦显微镜(HRT3/RCM,德国Heidelberg公司)测量ECD。放大倍数为800倍,分辨率为1 μm,观察视野为380 μm×380 μm。检查前使用4 g/L盐酸奥布卡因(日本参天制药株式会社)对受检眼进行表面麻醉1次,点用Vidisic眼凝胶(美国博士伦公司),并盖上一次性无菌角膜接触帽。调整操纵台高度固定受检者下颌和前额,调整物镜位置,使角膜接触帽与角膜中央轻微接触,预设其接触的焦平面深度为0 μm。转动焦平面调节环,获得不同深度不同层次的图像。检查结束后,选取清晰的图像存盘。检查另一眼需换用新的无菌帽。使用设备自带软件对图像进行分析并计算ECD。根据术后不同时间点ECD及其相对应的术前供体ECD,计算角膜内皮细胞丢失率,角膜内皮细胞丢失率=(术前供体ECD-术后ECD)/术前供体ECD。
1.2.3角膜中央总厚度和供体CGT测量 采用眼前节光相干断层扫描仪AS-OCT(Visante OCT,德国Carl Zeiss公司)测量术前及术后角膜中央总厚度(central corneal thickness,CCT)和供体CGT。患者下颌置于下颌托上,注视镜头内的注视目标。调整患者固视角,使视轴与眼轴一致。采用AS-OCT高分辨率角膜模块进行测量。扫描过程中,单击瞳孔中央至最佳校准即可取像,采用设备自带软件对图像进行分析。将测量光标移动至角膜中央位置,坐标显示为(0,0),测量顶点角膜上皮层至内皮层的厚度为CCT。内皮移植术后,供体移植片与受体植床之间存在高反光界面。同样将测量光标移至角膜中央(0,0)位置,测量高反光界面至内皮层的厚度即为供体CGT。
1.3 统计学方法
采用SPSS 23.0统计学软件(美国IBM公司)进行统计分析。计量资料数据经Shapiro-Wilk检验证实不符合正态分布,以M(Q1,Q3)表示。手术前后各时间点CCT及手术后各时间点供体CGT总体比较采用Kruskal-WallisH检验,两两比较采用Wilcoxon符号秩检验;采用Spearman相关系数分析术后24个月ECD与术前供体ECD、CGT及植片大小的关系;采用Kruskal-WallisH检验分析不同厚度植片组术前供体ECD以及术后各观察时间点3个组角膜内皮细胞丢失率的差异;采用Mann-WhitneyU检验分析不同大小植片组术前供体ECD、术后3个月供体CGT以及术后各观察时间点角膜内皮细胞丢失率的差异。采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 手术前后CCT和手术后供体CGT比较
术前及术后1、3、6、12、24个月CCT分别为797.5(722.5,910.0)、641.5(590.5,730.0)、619.5(577.0,691.5)、625.0(572.5,699.0)、627.0(584.5,692.5)和623.0(578.0,692.0)μm,总体比较差异有统计学意义(H=259.008,P<0.001),其中术后各时间点CCT明显薄于术前,术后1、3、6、12、24个月的CCT分别与术前CCT相比,差异均有统计学意义(均P<0.05)。
术后1、3、6、12和24个月供体CGT分别为129.0(90.8,160.8)、115.5(93.0,146.0)、115.5(89.0,151.0)、112.5(94.3,146.8)和114.0(89.0,144.5)μm,总体比较差异有统计学意义(H=37.369,P<0.001),其中术后1个月供体CGT与术后3个月相比差异有统计学意义(P<0.001),术后3个月供体CGT分别与术后6个月、12个月、24个月相比,差异均无统计学意义(均P>0.05)。
2.2 术后不同时间点ECD和角膜内皮细胞丢失率变化
术前供体植片ECD为2 455.9(2 250.0,2 872.3)个/mm2,术后1、3、6、12、24个月ECD逐渐降低,角膜内皮细胞丢失率逐渐升高(表1)。
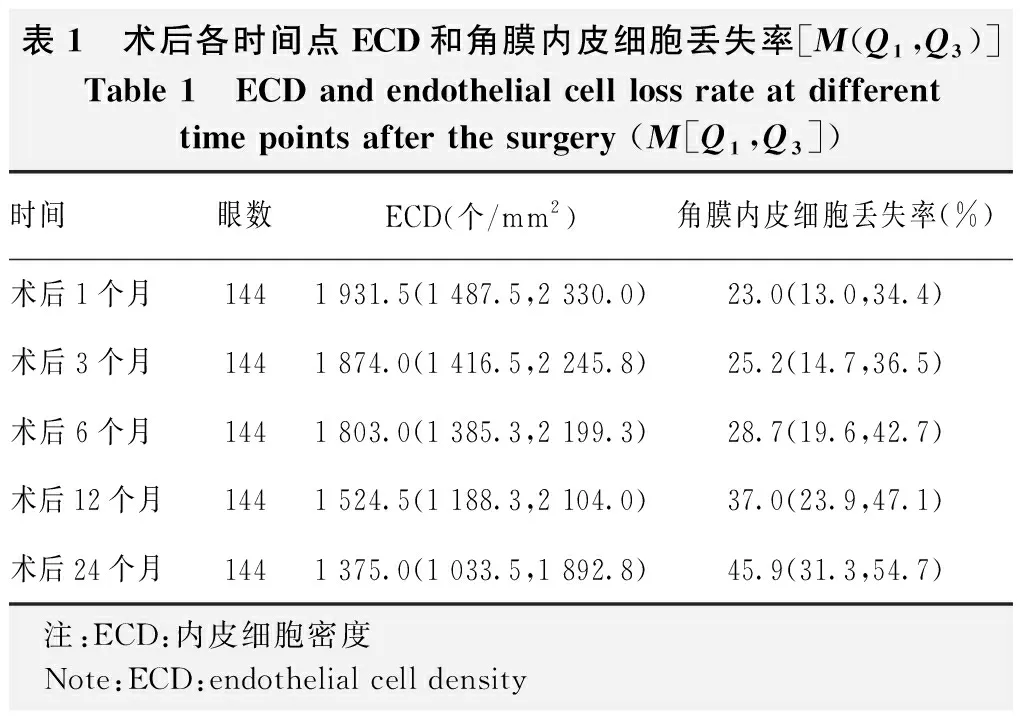
表1 术后各时间点ECD和角膜内皮细胞丢失率[M(Q1,Q3)]Table 1 ECD and endothelial cell loss rate at different time points after the surgery (M[Q1,Q3])时间眼数ECD(个/mm2)角膜内皮细胞丢失率(%)术后1个月1441 931.5(1 487.5,2 330.0)23.0(13.0,34.4)术后3个月1441 874.0(1 416.5,2 245.8)25.2(14.7,36.5)术后6个月1441 803.0(1 385.3,2 199.3)28.7(19.6,42.7)术后12个月1441 524.5(1 188.3,2 104.0)37.0(23.9,47.1)术后24个月1441 375.0(1 033.5,1 892.8)45.9(31.3,54.7) 注:ECD:内皮细胞密度 Note:ECD:endothelial cell density
2.3 术后24个月ECD与术前供体植片ECD、供体植片大小及供体CGT的相关性
Spearman相关性分析显示,术后24个月时ECD与术前供体植片ECD呈强正相关(rs=0.783,P<0.001),与供体植片大小和术后3个月时的供体CGT均无明显相关性(rs=0.141,P=0.093;rs=-0.044,P=0.600)(图1)。
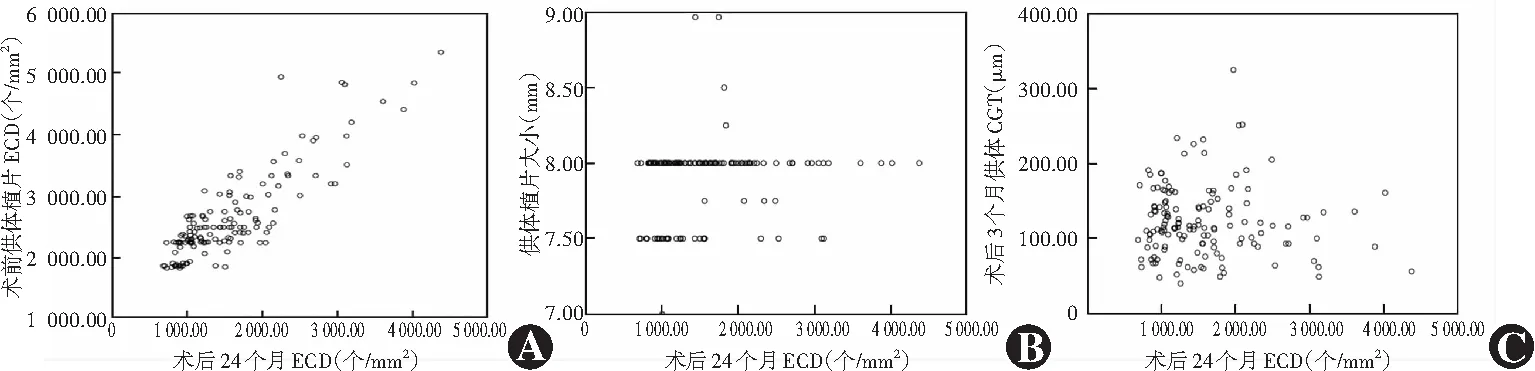
图1 术后24个月ECD与术前供体植片ECD、植片大小及供体CGT的相关性(Spearman相关分析,n=144) A:术后24个月ECD与术前供体植片ECD呈强正相关(rs=0.783,P<0.001) B:术后24个月ECD与供体植片大小无明显相关性(rs=0.141,P=0.093) C:术后24个月ECD与术后3个月时供体CGT无明显相关性(rs=-0.044,P=0.600) ECD:内皮细胞密度;CGT:中央植片厚度Figure 1 Correlations between 24-month postoperative ECD and donor graft ECD,donor graft size and donor CGT (Spearman correlation analysis,n=144) A:ECD at postoperatively 24 months was strongly positively correlated with the donor ECD (rs=0.783,P<0.001) B:There was no correlation between donor graft size and the 24-month postoperative ECD (rs=0.141,P=0.093) C:The 24-month postoperative ECD was not associated with donor CGT at postoperatively 3 months (rs=-0.044,P=0.600) ECD:endothelial cell density;CGT:central graft thickness
2.4 不同厚度供体CGT组术前ECD和术后角膜内皮细胞丢失率比较
薄植片组、中等厚植片组和厚植片组供体CGT分别为72.0(62.0,89.5)、118.5(111.8,135.3)和171.0(164.0,209.0)μm。3个组术前ECD分别为2 499.8(2 251.1,3 033.0)、2 458.5(2 250.0,3 013.0)和2 424.0(2 254.9,2 713.9)个/mm2,总体比较差异无统计学意义(H=0.368、P=0.832)。3个组术后各时间点角膜内皮细胞丢失率总体比较差异均无统计学意义(表2)。
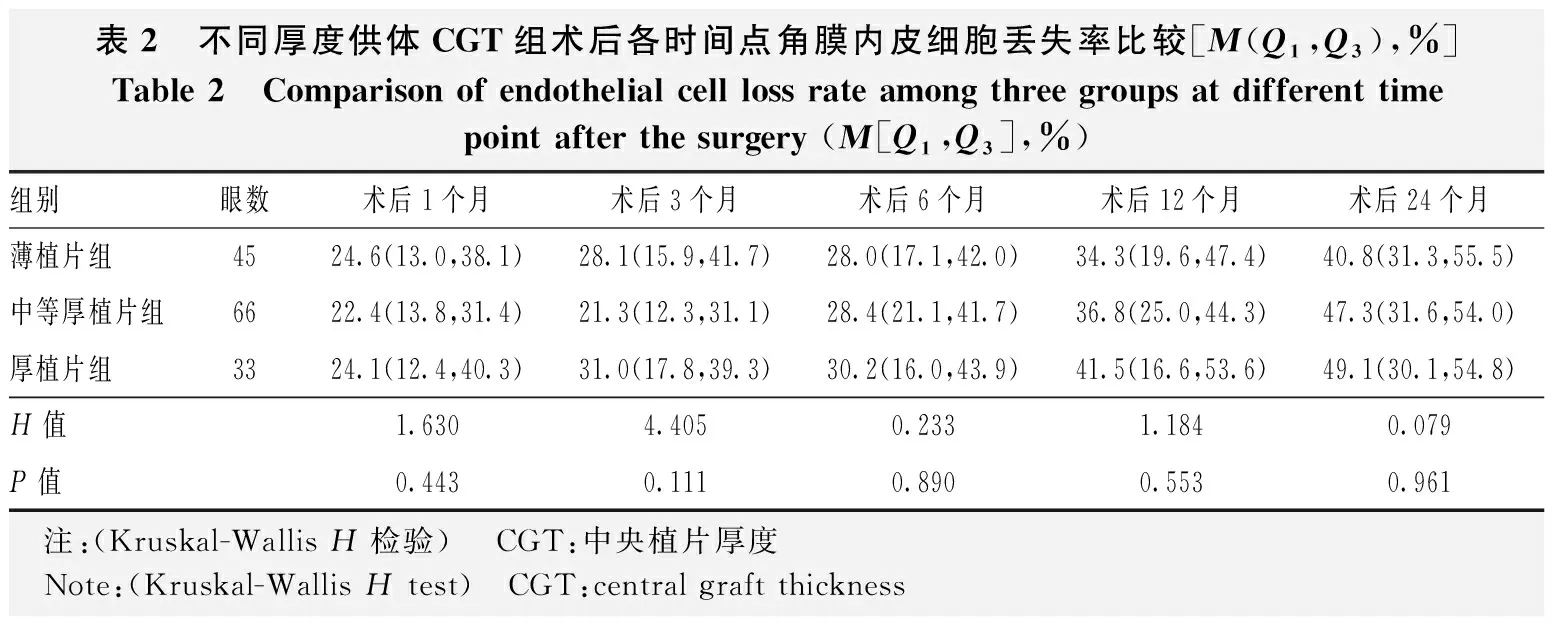
表2 不同厚度供体CGT组术后各时间点角膜内皮细胞丢失率比较[M(Q1,Q3),%]Table 2 Comparison of endothelial cell loss rate among three groups at different time point after the surgery (M[Q1,Q3],%)组别眼数术后1个月术后3个月术后6个月术后12个月术后24个月薄植片组4524.6(13.0,38.1)28.1(15.9,41.7)28.0(17.1,42.0)34.3(19.6,47.4)40.8(31.3,55.5)中等厚植片组6622.4(13.8,31.4)21.3(12.3,31.1)28.4(21.1,41.7)36.8(25.0,44.3)47.3(31.6,54.0)厚植片组3324.1(12.4,40.3)31.0(17.8,39.3)30.2(16.0,43.9)41.5(16.6,53.6)49.1(30.1,54.8)H值1.6304.4050.2331.1840.079P值0.4430.1110.8900.5530.961 注:(Kruskal-Wallis H检验) CGT:中央植片厚度 Note:(Kruskal-Wallis H test) CGT:central graft thickness
2.5 不同供体植片大小组术前ECD、术后供体CGT及角膜内皮细胞丢失率比较
小植片组和大植片组植片直径分别为7.5(7.5,7.5)mm和8.0(8.0,8.0)mm。2个组术前ECD和术后3个月时供体CGT比较差异均无统计学意义(Z=-0.002、-1.648,均P>0.05)(表3)。2个组术后各时间点角膜内皮细胞丢失率总体比较差异均无统计学意义(均P>0.05)(表4)。

表3 不同供体植片大小组术前ECD和术后CGT比较[M(Q1,Q3)]Table 3 Comparison of preoperative ECD and postoperative CGT between two groups (M[Q1,Q3])组别眼数术前ECD(个/mm2)术后3个月CGT(μm)小植片组312 329.5(2 252.3,3 033.0)107.0(88.0,139.0)大植片组1132 490.0(2 250.0,2 765.6)117.0(93.0,151.5)Z值-0.002-1.648P值0.9980.099 注:(Mann-Whitney U检验) ECD:内皮细胞密度;CGT:中央植片厚度 Note:(Mann-Whitney U test) ECD:endothelial cell density;CGT:central graft thickness
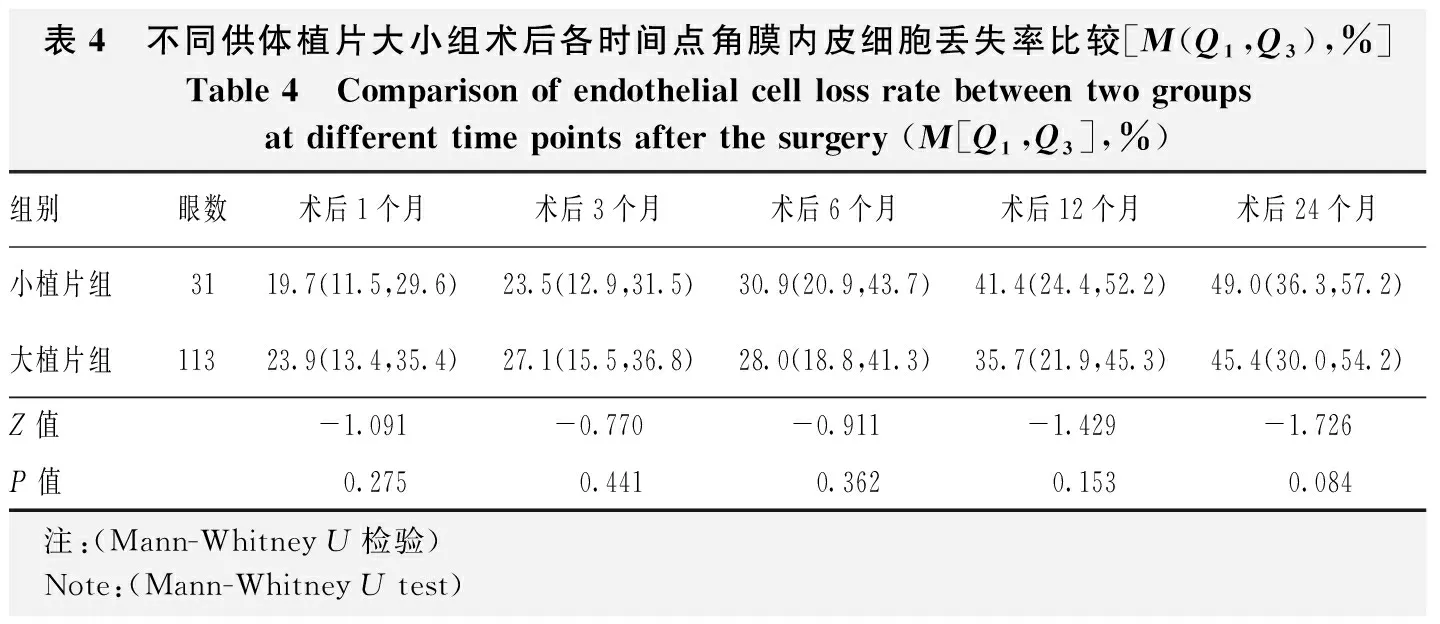
表4 不同供体植片大小组术后各时间点角膜内皮细胞丢失率比较[M(Q1,Q3),%]Table 4 Comparison of endothelial cell loss rate between two groups at different time points after the surgery (M[Q1,Q3],%)组别眼数术后1个月术后3个月术后6个月术后12个月术后24个月小植片组3119.7(11.5,29.6)23.5(12.9,31.5)30.9(20.9,43.7)41.4(24.4,52.2)49.0(36.3,57.2)大植片组11323.9(13.4,35.4)27.1(15.5,36.8)28.0(18.8,41.3)35.7(21.9,45.3)45.4(30.0,54.2)Z值-1.091-0.770-0.911-1.429-1.726P值0.2750.4410.3620.1530.084 注:(Mann-Whitney U检验) Note:(Mann-Whitney U test)
3 讨论
有研究发现DSAEK术前,供体植片会产生“水肿”,其主要原因是供体角膜在进行切削时,植片浸泡于平衡盐溶液中,并去除了角膜上皮层。而术后供体植片会发生“去水肿”作用,从而使其厚度变薄[10]。本研究发现,DSAEK术后1个月和3个月,CCT和供体CGT均明显降低,3个月以后逐渐趋于稳定。这表明DSAEK术后3个月时,植床与植片的炎症反应基本消退,而植片内皮细胞的术源性损伤也趋于停止,ECD和功能趋于稳定,从而使植床和植片的厚度基本稳定。Di Pascuale等[11]研究发现,DSAEK术后供体植片厚度变薄,可从术后第1天的243 μm降至末次随访的148 μm。本研究也发现,供体CGT从术后1个月的129.0(90.8,160.8)μm降至术后3个月的115.5(93.0,146.0)μm。这一结果提示我们,DASEK术后供体植片会产生“去水肿”作用,因而术前准备供体移植片及评价手术疗效时,应注意供体移植片厚度的变化。如术前植片厚度大于100 μm,术后植片厚度变薄,可能使原来的DSAEK变成超薄DSAEK。
通过上述分析,本研究发现术后3个月时供体CGT基本稳定,故选取术后3个月的供体CGT分析DSAEK术后24个月ECD与术前供体植片ECD、供体植片大小和供体CGT的相关性。发现术后24个月ECD与术前供体ECD呈强正相关,而与供体植片大小和供体CGT无明显相关性,这一结果与既往的一些研究结论相同。Lass等[12]研究发现,DSAEK术后3年ECD与术前供体ECD呈正相关,而与供体植片厚度无明显相关性。而Lekhanont等[13]的研究也认为DSAEK术后5年的ECD与术前供体ECD呈正相关,而与供体植片的直径不相关。
2012年,Busin等[14]进行的超薄DSAEK手术中所用供体植片厚度均小于100 μm,此后陆续很多研究发现,超薄DSAEK具有视力恢复快、术后高阶相差小等优点[15-16],但供体CGT与DSAEK术后视力恢复关系仍存在一定争议[17]。本研究结果发现,在随访的24个月内,厚植片组的角膜内皮细胞丢失率一直较高,仅术后1个月时低于薄植片组。术后3个月内薄植片组内皮细胞丢失率较高,可能与薄植片在DSAEK手术时展开困难、操作相对复杂有关;而术后6~24个月薄植片组的内皮细胞丢失率低于其他2个组,可能与术后3个月后植片稳定、薄植片的角膜基质含量少、炎症反应和排斥反应较轻以及损伤的内皮细胞恢复较快有关。厚植片组的角膜内皮细胞丢失率一直较高,考虑与手术过程中厚植片通过角膜切口进入前房时,角膜切口及植入器端口对内皮细胞的双重挤压作用,导致内皮细胞损伤相对较多有关;且其植片较厚,术后炎症和排斥反应相对严重,导致内皮细胞损伤恢复不佳。但术后各观察时间点,3个组之间角膜内皮细胞丢失率差异均无统计学意义。因此我们认为在DSAEK手术中,相对薄的供体植片术后角膜内皮细胞损失较小,内皮细胞丢失率可能较低。
本研究进一步分析发现,术前小植片组和大植片组间ECD以及术后3个月时供体CGT的差异均无统计学意义。术后1~3个月,小植片组的角膜内皮细胞丢失率低于大植片组,考虑与大植片通过角膜切口时,因切口对内皮细胞的挤压作用,引起更多的角膜内皮细胞损伤有关;而术后6~24个月,大植片组的角膜内皮细胞丢失率低于小植片组,考虑可能与大植片含有更多的角膜内皮细胞及部分损伤的内皮细胞功能逐渐恢复有关。但术后各观察时间点,2个组之间角膜内皮细胞丢失率差异均无统计学意义。因此我们认为在DSAKE手术中,相对大的供体植片术后内皮细胞损失较小,内皮细胞丢失率可能较低。
综上所述,本研究结果显示符合国人特点的小植片DSAEK手术在术后3个月时供体CGT趋于稳定。术后24个月,ECD与术前供体ECD呈强正相关,而与供体CGT和植片大小无明显相关性。供体植片越薄、直径越大,术后远期角膜内皮细胞丢失率越低,更有利于植片的长期存活。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明顾绍峰:数据整理、统计分析、论文撰写;彭荣梅:采集数据、分析数据;肖格格、冯云:临床信息的分析和解释;洪晶:研究指导、论文修改及定稿

