三种皮质神经元原代培养方法的改良及对比
廖慧丹,龙玲玲,闫杰
(中南大学湘雅医学院基础医学院法医系,长沙 410013)
神经科学是现代科学中进展最为迅猛的研究领域之一,体外原代培养神经细胞的形态学特性及生长发育特征与体内非常相似,较少受到体内循环、内分泌等因素的影响,且便于直接观察、检测指标,已成为神经科学研究中必不可少的模型工具,细胞培养的质量将直接影响研究工作的进展[1-3]。
神经元原代培养是指从活体获得细胞或组织在体外条件下进行的第一次培养,当从胚胎脑组织中分离培养神经元时,由于他们已在原位组织完成分裂时分化,所以培养的神经元将不再会分裂、增殖,这使神经元培养与其他种类体细胞培养相比有很大的不同[4]。目前,原代皮质神经元培养的方法有很多,本研究参照相关文献[5-9],对机械吹打法、胰蛋白酶消化法以及木瓜蛋白酶法进行比较研究,并在其基础上进行了实验细节的改良,旨在探讨稳定适当的神经元培养方法及上述三种方法在皮质神经元培养中各自的优缺点,为研究工作者根据各自条件选择合适的培养方法提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂及配制
多聚赖氨酸(L-polysine),L-半胱氨酸(L-cysteine),胰蛋白酶(tripsin),木瓜蛋白酶 (papain),联咪二苯吲哚(DAPI):Sigma产品;D-Hank's平衡液,马血清:Thermo产品;DMEM培养液,双抗(青霉素,链霉素):Corning Cellgro产品;Neurobasal Medium,B27培养基添加剂:Gibco产品。胎牛血清:上海依科赛生物制品有限公司;兔抗大鼠NSE单克隆抗体,FITC标记抗兔Ig G(Abcam)。
L-polysine打底液:用灭菌 ddH2O配至工作浓度50 μg/mL。Tripsin 消化液:用 D-Hank's 溶液溶解配至工作浓度0.125%;木瓜蛋白酶消化液(papain):用 D-hank's溶液配至工作浓度 200μg/mL,现用现配;接种液配制(体积分数):DMEM 83.5%,胎牛血清10%,马血清5%,双抗 1%,L-半胱氨酸1%;神经元培养液(体积分数):Neurobasal Medium 98%,B272%。所有配制液体均用0.22 μm筛网过滤。
1.1.2 实验动物
孕16~18日龄SPF级SD大鼠1只,雌性,350~400 g,由湖南斯莱克景达实验动物有限公司提供[SCXK(湘)2013-0004]。
1.2 方法
1.2.1 神经元培养
包被:L-polysine打底液包被六孔板,在37℃孵箱孵育30 min后吸弃液体,晾干过夜后用灭菌ddH2O洗板两次,置于37℃孵箱孵干备用。取材:断颈处死孕16~18 d SPF级SD大鼠,并在无菌条件下取出胎鼠;剥离胎鼠脑膜,取顶、颞叶大脑皮层的薄层脑组织置于DMEM溶液中,进一步剥去未分离的脑膜,并将脑组织剪碎成约1 mm3大小,然后将脑组织与DMEM溶液的混合液分别移入3个无菌培养皿,分别标记为机械吹打组、胰酶消化组、木瓜蛋白酶消化组。分离、培养:机械吹打组:对培养皿中剪碎脑组织吹打30次,移入15 mL无菌离心管,离心5 min 1000 r/min。加入3 mL接种液后分层吹打,即:吹打10次,静置2 min,取上清液,再吹打10次后,取上清液入离心管,再吹打10次后,取上清液入另一无菌离心管。台盼兰拒染法进行活细胞计数,调整细胞密度(1.0×106个细胞/孔),接种于经包被的培养板中,置于37℃,5%CO2的孵箱内孵育;胰酶消化组:在盛有大鼠脑组织的无菌培养皿中加入2 mL胰酶消化液,混匀,37℃水浴箱消化15~20 min,5 min观察、摇匀,然后加入等体积于胰酶消化液的胎牛血清终止消化,并转移至15 mL无菌离心管中,吹打后离心5 min,1000 r/min,弃上清,加入5 mL接种液重悬细胞,按前述分层吹打步骤吹打细胞,计数,接种,孵育;木瓜蛋白酶消化组:在盛有大鼠脑组织的无菌培养皿中加入3 mL木瓜蛋白酶消化液,混匀,37℃水浴箱消化20~30 min,每5 min摇匀一次,将消化后的组织转移至15 mL无菌离心管中,吹打后离心5 min,1000 r/min,弃上清,加入5 mL接种液重悬细胞,按前述分层吹打步骤吹打细胞,计数,接种,孵育;各组孵育4 h后,全量换为神经元培养液,72 h后全量换液,以后视细胞生长情况,3~4 d半量换液,倒置相差显微镜下观察生长状况。
1.2.2 神经元鉴定
免疫荧光鉴定NSE:4℃ PBS洗细胞3次,4%多聚甲醛室温固定细胞10 min,吸去多聚甲醛,PBS洗3次。用0.12%Triton X2100的PBS对细胞进行透化处理15 min,然后加入封闭液,室温封闭1 h。换为相应一抗(兔抗大鼠NSE单克隆抗体)4℃湿盒过夜,PBS清洗3次后加入FITC标记的抗兔二抗,室温避光孵育1 h。然后加入用DAPI室温染细胞核5 min(避光)。PBS漂洗3次。90%甘油封片。荧光显微镜下观察NSE表达阳性细胞,随机取8个视野,摄像后计算每个视野中NSE表达阳性细胞数占该视野总细胞数的比例,即为神经元纯度。
1.2.3 统计学处理
应用SPSS 18.0分析软件进行方差分析,P<0.05视为有统计学差异。
2 结果
2.1 形态学观察
培养的皮层神经元细胞在接种4 h后大部分贴壁,多数贴壁细胞成圆球状,少数细胞出现较小突起,呈蝌蚪样(图 1A、2A、3A),6h后可见明显的细胞突起;至第24 h神经元细胞完全贴壁,光晕明显,突起伸长,可见轴突形成稀疏的网络(图1B、2B、3B),随着培养时间延长,神经元细胞轴突形成的网状结构渐趋密集,3 d后神经元胞体变大,细胞呈现多样性,多为纺锤形、三角形及圆形。细胞突起增粗伸长,可见双极或多极神经元,细胞突起交织成疏散的网状结构,视野中偶见不规则扁平的胶质细胞(图1C、2C、3C)。培养7 d后神经元胞体进一步增大且突起延长,形成复杂紧密的神经元网络(图1D、2D、3D),此时,神经元成熟稳定,可以作用实验模型用于进一步实验。
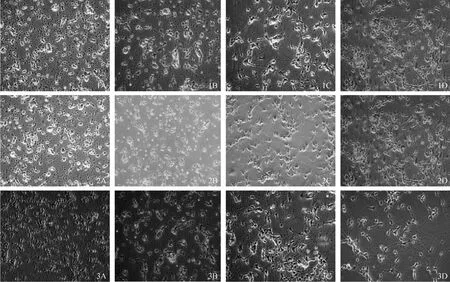
注:1.机械吹打法,2.胰蛋白酶消化法,3.木瓜蛋白酶消化法。A、B、C、D分别为接种后4 h、24 h、3d、7d的皮质神经元。图1 倒置相差显微镜观察不同培养时间的皮质神经元(×400)Note 1.Neurons dissociated by mechanical method;2.Neurons dissociated by trypsin digestion;3.Neurons dissociated by papain methods.A.Cultured for 4 hours,B.Cultured for 24 hours,C.Cultured for 3 days,D.Cultured for 7 days.Fig.1 Morphological changes of cultured neuronal cells were observed by light microscropy. ×400
2.2 神经元鉴定
原代细胞中神经元所占比例高,形态良好,核大而清晰(图2:4A、5A、6A)。免疫荧光染色结果显示NSE阳性细胞在机械吹打组(图2:4B)、胰酶消化组(图2:5B)及木瓜蛋白酶消化组(图2:6B)分别为96.28%,95.63%,97.34%,三组间无统计学差异(P >0.05)。
3 讨论
神经细胞培养是神经生物医学领域研究的一项重要技术。原代培养的神经细胞在Alzheimer’s病及帕金森病等中枢神经系统疾病以及氯胺酮、甲基苯丙胺等神经系统药毒物研究中备受关注,已经成为神经科学研究中重要的实验材料及模型工具[8]。本研究改良实验条件,运用三种方法培养大鼠的体外培养皮质神经元,光镜下可见神经元形态多为纺锤形、椭圆形及三角形,突起相互交织成网状,具有神经元的形态学特征,经免疫荧光染色,随机选取视野计数后,神经元阳性细胞百分率均大于95%。提示三种方法均培养出高纯度及发育成熟的神经元。
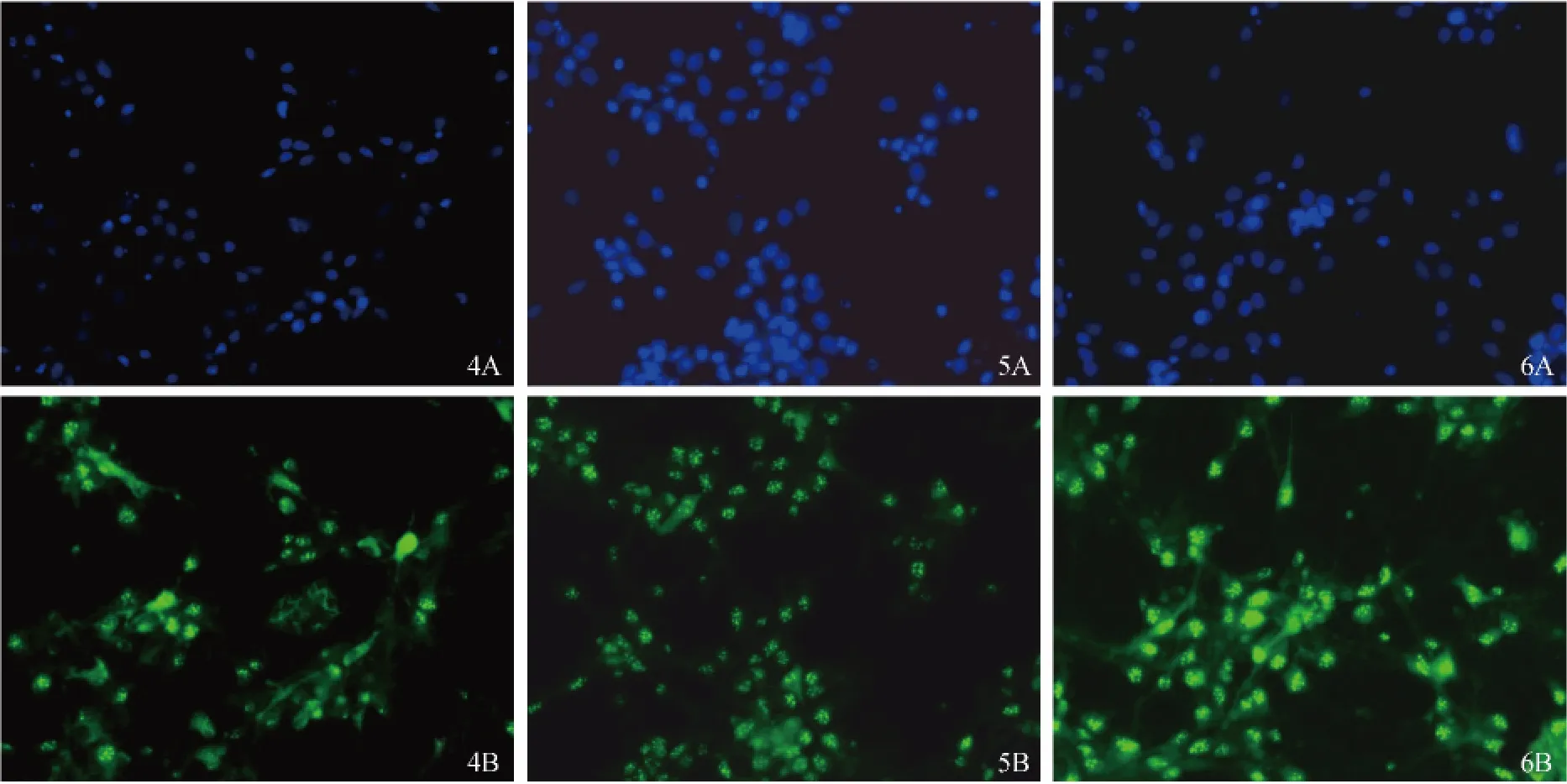
注:4.机械吹打法培养7 d的神经元形态特征及鉴定;5.胰酶消化法培养7 d的神经元形态特征及鉴定;6.木瓜蛋白酶消化法培养7 d的神经元形态特征及鉴定。A:DAPI染核的图像;B:NSE免疫荧光图像。图2 不同方法培养7d的皮质神经元免疫荧光染色(×400)Note.4.Neurons isolated by mechanical method,5.Neurons isolated by trypsin methods,6.Neurons isolated by papain digestion method.A:Nuclei of neurons are shown by DAPI staining;B:Stable networks are established,NSE staining,×400.Fig.2 Identification and morphological characteristics of neurons cultured for 7 days. ×400
神经元原代培养主要有以下步骤:首先是实验动物的选择,将胎龄为16~18 d的SD大鼠胚胎作为实验材料,此胎龄的胎鼠皮层神经元尚未发育成熟,抵抗损伤的能力较强,而胶质细胞数量甚少,利用此阶段的大鼠胚胎提取神经元可以提高细胞的成活率并能较好地控制杂质细胞的百分含量;再者取材过程中血管膜剥离是一个重要的步骤,若剥离不完全易导致神经元分离困难,继发吹打过度而造成神经元大量死亡,且血管膜的细胞会混入原代培养中,严重干扰实验结果,胎鼠的血管膜较新生鼠易剥离,可以提高实验的成功率[10,11]。其次是取材,SD胎鼠从母鼠腹腔取出至脑皮层剪碎过程需时较长,易造成神经元损伤甚至死亡,多文献中提出保持实验过程在冰上且冰浴的培养液中进行,可以大大提高神经元的存活率。此外,在解剖过程中,D-Hanks液的无糖环境对神经元很不利,本实验用DMEM溶液浸泡解剖过程中的大脑,保持大脑的代谢活性,可提高神经元的存活率。在最后的神经元分离培养过程中,制作活性较高的单细胞悬液是培养过程中至关重要的步骤,制备神经元单细胞悬液的方法主要有两种:机械吹打法与酶消化法。其中吹打是一个关键的步骤,用枪头缓慢吹打就可以达到好的效果,切忌过快,吹打过快可以导致大量神经元死亡形成细胞碎片。分层吹打法取代过筛可以避免过筛可能导致的细胞丢失和损伤。而在消化分离过程中,使用酶消化时用35 mm或者60 mm培养皿盛放酶消化液,使消化液在培养皿里形成浅而广阔的一层,均匀分布着组织块,避免神经元部分消化不足,部分消化过度导致的损伤甚至死亡。在培养过程中,有血清培养可以在种植初期促进细胞快速恢复状态,适应环境及稳定生长,但血清刺激胶质细胞和杂细胞分裂,影响神经元的纯度,导致细胞状态不均一,可能对后续实验造成不良影响[6],而使用 Neurobasal Medium及B27可以提高神经元培养的纯度,非神经元细胞明显减少,神经细胞突起分化早、伸展快。本实验采用含血清种植液种植细胞,而用无血清饲养液维持细胞的存活和生长,综合双方的优势,更有利于后续实验的进展[6]。
本实验运用孕16~18 d SD大鼠胚胎作为实验对象,在实验细节方面进行改良如DMEM溶液浸泡解剖后的大脑、分层吹打法代替过筛离心等操作及培养皿盛放酶消化液进行消化等,力使细胞培养过程中,节省实验时间,降低污染,使神经元的损伤达到最小化,提高神经元培养的存活率。并且利用改良的实验条件,分别运用三种不同方法均能成功培养出含杂质量较少且纯度高的皮层神经元,其在不同生长阶段具有典型的形态学特征,每种培养方法都有其不同的特点。
机械分离法中用机械分离代替酶消化,其优点在于:轻轻吹打对细胞的损伤小,细胞活性保持很好,并且操作流程简单;节约操作时间,减少污染。但是消化结果的稳定程度与操作人员熟练程度相关,易形成难以消除的组织团块。胰蛋白酶消化是一种生化和化学性分离技术,而胰蛋白酶消化与pH、浓度、温度和消化时间有关,浓度的大小、消化时间的长短都会直接影响到细胞的产率和活性,此外,消化之前要掌握好皮质组织块剪碎的大小以及吸管吹打程度,以利于对胰蛋白酶消化时间的控制,而胰蛋白酶消化的彻底与否,直接关系到神经元的生长活性。因此,胰蛋白酶的浓度和作用时间需要严格控制,需要多次摸索实验条件。木瓜蛋白酶是消化过后神经元存活率最高的酶[5,6],木瓜蛋白酶的特点是不会过度消化,非常温和。缺点是需要用无血清的培养液配来保证神经元的营养代谢,而且一定要现用现配,价格较前两种方法昂贵,且木瓜蛋白酶消化法消化时间最长,需要30 min左右,具体消化时间需要实验摸索确定。
随着神经元将被越来越广泛的应用于包括细胞功能、神经发育、退行性疾病、神经药毒理学等在内的多领域、多层次的研究[12-17],神经元原代培养作为体外实验研究的工具愈显重要。本实验改良并比较了三种原代神经元培养的方法,为研究工作者根据各自条件选择合适的培养方法提供实验证据和理论依据。
[1]司徒镇强,吴军正.细胞培养[M].北京:世界图书出版公司,2007:119-122.
[2]鄂征.组织培养技术及其在医学研究中的应用[M].北京:中国协和医科大学出版社,2004:65-69.
[3]Robert F,Cloix JF,Hevor T.Ultrastructural characterization of rat neurons in primary culture[J].Neuroscience.2012,200:248-60.
[4]薛丽,水克娟,吕朝军,等.神经细胞培养方法概述[C].中国植物保护学会.科技创新与绿色植保—中国植物保护学会2006学术年会论文集.中国植物保护学会,2006:6.
[5]Meberg PJ,Miller MW.Culturing hippocampal and cortical neurons[J].Methods Cell Biol,2003,71(2):111 -127.
[6]Brewer GJ,Torricelli JR,Evege EK,et al.Optimized survival of hippocampal neurons in B27-supplemented neuronbasalTM,a new serum-free medium combination[J].J Neurosci Res,1993,35(5):567-576.
[7]张小娟,李廷玉,刘友学,等.简易大鼠海马神经元原代培养方法及神经元兴奋性检测[J].南方医科大学学报,2010,09:2080-2083.
[8]白瑜,赵德明.大脑皮质神经元培养中胰蛋白酶消化分离技术的探讨[J].中国畜牧兽医,2007,34(6):105-107.
[9]谭少华,徐安定,苗海锋,等.胰酶快速消化大鼠皮层神经细胞原代培养方法分析[J].中国实用神经疾病杂志,2013,19(8):4-6.
[10]周晖,毛萌,罗小丽,等.脑源性神经营养因子对缺氧神经元的保护作用及其细胞内信号传递[J].中国临床康复,2006,10(25):73-74,68.
[11]Ballarin C,Peruffo A.Primary cultures of astrocytes from fetal bovine brain[J].Methods Mol Biol,2012,814:117 -26.
[12]Jakob von Engelhardt,Beril Doganci,et al.Synaptic NR2A-but not NR2B-containing NMDA receptors increase with blockade of ionotropic glutamate receptors[J].Frontiers Mol Neur,2009,2:19.
[13]Wildburger NC,Lin-Ye A,BairdMA,et al.Neuroprotective effects of blockers for T-type calcium channels[J].Mol Neurodegener,2009,4:44.
[14]Lee Y,Lee H,KimJ,et al.Classification of BMI control commands from rat’s neural signals using extreme learning machine[J].Biomed Enginer OnLine,2009,8:29.
[15]Pedrini S,Thomas C,Brautigam H,et al.Dietary composition modulates brain mass and solubilizable Abeta levels in a mouse model of aggressive Alzheimer’s amyloid pathology[J].Mol Neurodegener,2009,4:40.
[16]高雪松,王自能.纯氧与空气环境复苏对低氧新生大鼠大脑皮质神经元凋亡的影响[J].中国实验动物学报,2010,18(6):530-534,448.
[17]裴娜娜,吴丽红,高永新,等.大鼠瘦素基因重组腺相关病毒的构建及在原代神经元细胞中的过表达[J].中国实验动物学报,2013,18(5):42-47,105.

