HGF/c-met在小鼠毛囊生长周期中的表达
于秀菊,高淑媛,程笳琪,赵兵令,赫晓燕,董常生
(山西农业大学动物科技学院,山西 太谷 030801)
肝细胞生长因子(hepatocyte growth factor,HGF)是一种多肽类生长因子,由α重链和β轻链组成。其受体是由原癌基因编码的具有酪氨酸集激酶活性的蛋白 c-met[1]。大量研究表明,HGF/c-met在哺乳动物间充质-上皮互作的多种组织中起调控细胞增殖、迁移、分化和存活的作用[2,3]。毛囊具有周期性的生长特性,根据其毛囊各组分在形态上的变化,将其分为毛发生长期、退化期和休止期[4,5]。真皮乳头(由间充质衍生)的成纤维细胞与表皮角质细胞之间的相互作用在毛囊周期性生长过程中发挥重要的作用[6]。
体外实验证明HGF/c-met对毛囊生长具有促进的作用。Shimaoka等[7]在体外培养的人毛囊中添加一定浓度的HGF后,发现毛囊的长度增长,DNA合成能力增强,证明HGF能够刺激毛囊的生长;过表达HGF的转基因小鼠呈现毛囊发育提前,退化期显著推迟,皮肤组织中的毛囊数量显著增加的现象[8]。但是,内源性的 HGF/c-met信号是否参与毛囊的周期性变化还不清楚。本实验运用免疫组织化学技术,对HGF及其受体c-met在ICR小鼠毛囊的生长期、退化期和休止期进行组织定位,证明HGF/c-met在毛发生长过程发挥着重要的作用,为HGF/c-met的应用奠定理论基础。
1 材料与方法
1.1 实验动物
清洁级ICR小鼠雌、雄各10只,体重18~22 g,2月龄。均购于北京华阜康生物科技股份有限公司【SCXK(京)2009-0004】。交配受孕后将雌鼠单独饲养直至生产,选定同一天出生的三窝ICR小鼠,在出生后的第15天和17天,第19天和20天、第25天和26天,每窝各取一只小鼠,处死后取其背部皮肤,固定于Bouin氏液中,24 h后更换为70%酒精,通过梯度酒精脱水,二甲苯透明,浸蜡后包埋,切成5 μm厚的切片,用于免疫组织化学研究。
1.2 免疫组织化学
石蜡切片二甲苯脱蜡,梯度酒精复水至蒸馏水后,3%H2O2去除内源性的过氧化物酶,PBS洗切片5 min×3次;滴加5%非免疫山羊血清,封闭30 min;甩掉封闭液后滴加1∶100兔抗HGF多克隆抗体(1∶100兔抗 c-met多克隆抗体),室温放置 30 min,4℃过夜后,37℃孵育30 min,PBS 洗切片 5 min×3次;然后按照下面的程序进行,HGF:滴加生物素化山羊抗兔IgG,37℃,20 min;用PBS缓冲溶液冲洗3 min ×3次;显色:BCIP/NBT(1∶20比例稀释)混匀后加至切片,室温显色20 min;蒸馏水洗涤后核固红轻度复染。水洗,干燥后水溶性封片剂封片。c-met:滴加 1∶100 HRP-山羊抗兔 IgG,37℃ 孵育 30 min,PBS洗切片5 min ×3次;滴加DAB显色剂显色3~5 min,PBS冲洗5 min ×3次;苏木精轻度复染,梯度酒精脱水后二甲苯透明,中性树胶封片。非免疫山羊血清代替一抗作为阴性对照。
1.3 图像分析
应用 Image-Pro Plus 6.0 软件对HGF 和 c-Met蛋白在各期小鼠皮肤组织中的免疫组织化学染色结果进行光密度的测定,每个时期的小鼠皮肤组织取3张切片,每张切片取5个视野,得到阳性细胞的光密度值。所得数据用SPSS 16.0(美国SPSS公司),应用方差分析进行统计学分析。经过测定所有数据均符合正态分布,分析结果用平均值 ±标准误(Mean±SE)来表示。
2 结果
2.1 HGF在ICR小鼠毛囊生长周期中的定位和表达量分析
HGF的免疫阳性产物主要分布在真皮乳头和皮脂腺,表达量随时期的不同而不同。在毛囊的生长期,毛纤维生长旺盛,毛乳头的直径显著大于根鞘部,HGF呈强阳性的表达,紫色阳性物在真皮乳头着色较深(图1A);到达退化期,毛囊萎缩成杵形的圆状结构,没有可见的HGF的阳性表达物(图1B);在休止期-生长期过渡中,可见新毛向上推移,接近杵形毛,杵形毛最终会脱落,新毛会占据旧毛穴,HGF的阳性表达有所增强,在真皮乳头和皮脂腺均呈现阳性表达(图1C)。对照组中均未见阳性反应(图1D-1F)。生长期的平均吸光度是(0.17±0.0164),休止期-生长期测定的平均吸光度值是(0.1168±0.0067)。
2.2 c-met在ICR小鼠毛囊生长周期中的定位和表达量分析
c-met的免疫阳性产物主要分布在根鞘部和表皮。在毛囊的生长期,毛纤维c-met呈强阳性的表达,棕黄色阳性物在毛基质和根鞘部着色较深(图2A);在退化期,仅有微弱的c-met的阳性信号(图2B);在休止期-生长期过度中,c-met的阳性表达有所增强,在根鞘部和表皮中均呈现阳性表达(图2C)。对照组中均未见阳性反应(图2D-2F)。3个时期的平均吸光度值分别是(0.31±0.0107)、(0.05±0.0041)和(0.23±0.0065)。
3 讨论
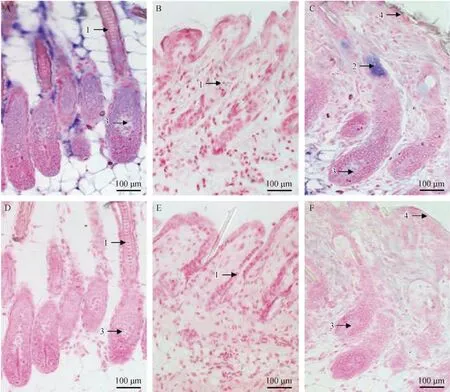
注:1.根鞘;2.皮脂腺;3.真皮乳头;4.表皮;A-C.实验组;D-F.对照组;A,D.毛囊生长初期;B,E.毛囊生长中期;C,F.毛囊生长末期。图1 毛囊生长周期不同时期HGF的免疫组织化学染色Note.1.Root sheath;2.Sebaceous glands;3.Dermal papilla;4.Epidermis;A-C.Experiment groups;D-F.Control groups;A,D.Anagen;B,E.Catagen;C,F.Telogen.Fig.1 The expressions of HGF protein in different phases of the hair follicle cycle in ICR mice
毛囊是毛发生长依赖的微小器官,其周期性变化与间充质-上皮的相互作用有密切的关系,与角质化细胞的分化,增殖和凋亡相关[9]。大量研究证明,毛囊的生长受到 Shh(Sonic Hedgehog)、β连环蛋白(β-catenin)、淋巴增强因子(lymphoid enhancer factor-1,lef-1)、骨形成蛋白(bone morphogenetic protein,bmp)家族成员等很多因子的调控[4,10,11]。同时,黑色素细胞活性与数量也随着毛囊的生长呈现周期性的变化[12]。本实验证明HGF主要定位于小鼠毛囊的毛乳头,毛乳头是皮肤间充质衍生形成的特殊结构,由成纤维细胞组成。Yamaguchi等[13]实验证明HGF是一种由成纤维细胞分泌的生长因子,通过与黑色素细胞上的受体作用调控黑色素的产生。而c-met主要表达在小鼠毛囊的毛基质、根鞘部和表皮中。毛囊的黑色素细胞主要位于毛基质和根鞘部,其中毛基质的黑色素细胞对毛色起到决定性的作用,相对于毛基质来说,根鞘部仅含有很少量的黑色素细胞[14]。HGF/c-met在 ICR 毛囊生长的不同时期呈现不同的表达量。在生长期,毛囊生长旺盛,HGF和c-met表达量达到最高值;到退化期时,整个毛囊萎缩成杵形的圆状结构,HGF完全没有阳性信号,c-met表达信号非常微弱,在休止期向下一个生长期转化过程中,HGF和c-met信号均呈现上升趋势。实验表明,HGF/c-met与ICR小鼠毛囊的周期性生长过程中起调控作用。
体外实验证明HGF/c-met能够增加毛囊的数量、促进毛囊的生长和延迟退化期的到达时间[7,8]。本实验证明内源性的HGF/c-met信号调控毛囊的周期性变化。Balkovetz等证实HGF刺激β-catenin的的合成,从而引起表皮中的细胞核内β-catenin的积累。前期的实验证明β-catenin是毛囊生长必需的分子之一,维持和促进毛囊的生长[4]。由此推测HGF与c-met的相互作用以间充质和上皮的互作为组织基础,HGF可能通过调节β-catenin来发挥调控毛囊的生长。具体的分子作用机制是我们下一步研究的靶点。
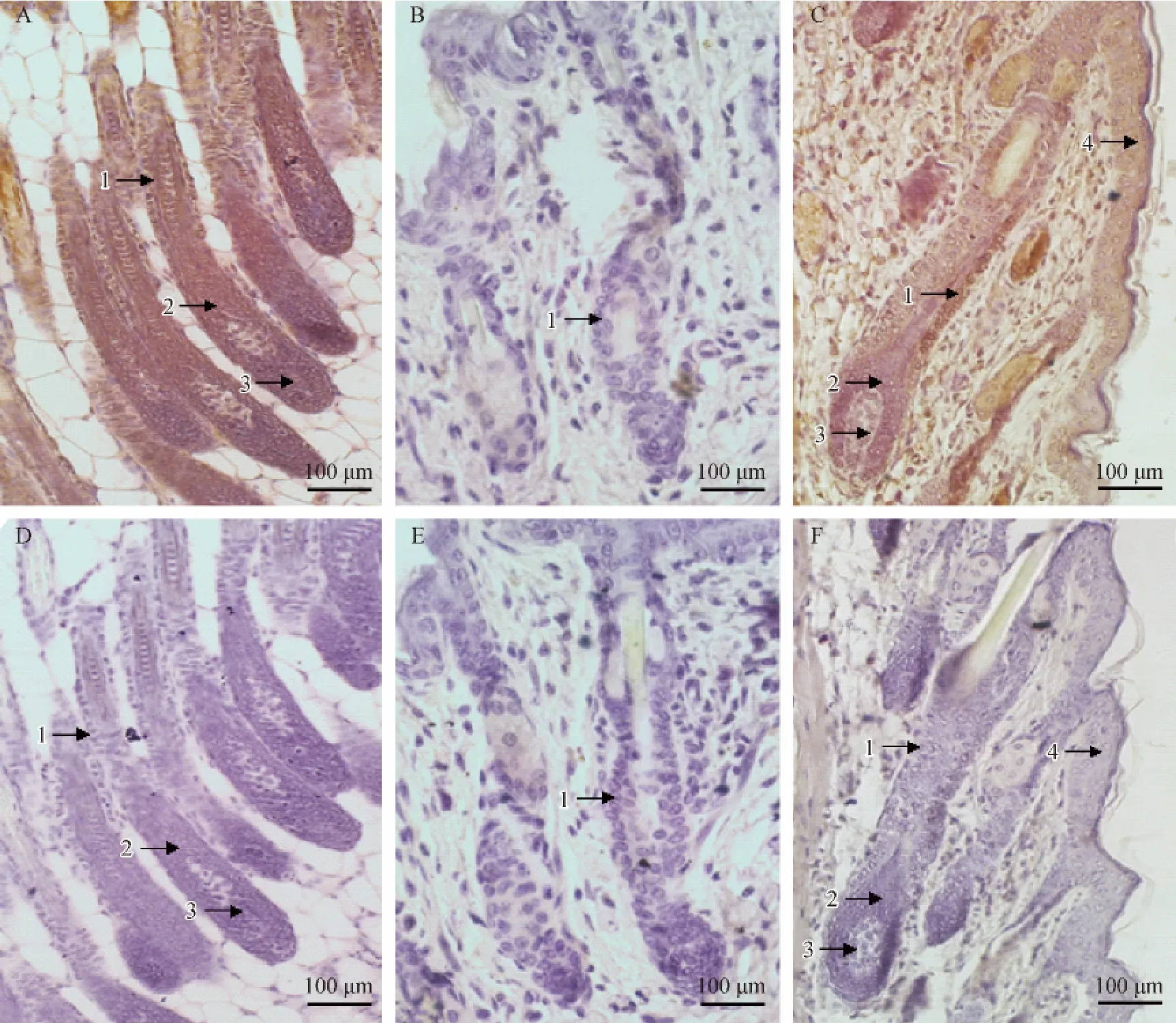
注:1.根鞘;2.毛基质;3.真皮乳头;4.表皮;A~C.实验组;D~F.对照组;A,D.毛囊生长初期;B,E.毛囊生长中期;C,F.毛囊生长末期。图2 毛囊生长周期不同时期c-met的免疫组织化学染色(×20)Note.1.Root sheath;2.Hair matrix;3.Dermal papilla;4.Epidermis;A-C.Experiment groups;D-F.Control groups;A,D.Anagen;B,E.Catagen;C,F.Telogen.Fig.2 Expression of c-met protein in different phases of the hair follicle cycle in ICR mice
[1]Hirobe T,Osawa M,Nishikawa S.Hepatocyte growth factor controls the proliferation of cultured epidermal melanoblasts and melanocytes from newborn mice [J].Pigment Cell Res,2004,17(1):51-61.
[2]Birchmeier C,Gherardi E.Developmental roles of HGF/SF and its receptor,the c-Met tyrosine kinase [J].Trends Cell Biol,1998,8:404-410.
[3]Jiang,WG,Hiscox S.Hepatocyte growth factor/scatter factor,a cytokine playing multiple and converse roles [J].Histol Histopathl,1997,12:537 -555.
[4]于秀菊,范阔海,贺俊平,等.小鼠自然毛囊生长周期及β连环蛋白的表达[J].解剖学报,2010,41(6):862-866.
[5]李晓娟,李硕,白冰珂,等.BALB/c突变卷毛小鼠皮肤组织结构的分析[J].中国比较医学杂志,2014,24(4):47-50.
[6]Tasseff R,Bheda-Malge A,DiColandrea T,et al.Mouse hair cycle expression dynamics modeled as coupled mesenchymal and epithelial oscillators[J].PLoS Comput Biol,2014,10(11):e1003914.
[7]Shimaoka S,Tsuboi R,Jindo T,et al.Hepatocyte growth factor/scatter factor expressed in follicular papilla cells stimulates human hair growth in vitro[J].J Cell Physiol,1995,165:333 -338.
[8]Wolnicka-Glubisz A,Pecio A,Podkowa D,et al.HGF/SF increases number of skin melanocytes but does not alter quality or quantity of follicular melanogenesis[J].PloS ONE,2013,8(11):e74883.
[9]Paus R,Cotsarelis G.Hair follicle biology in health and disease[J].N Engl J Med,1999,341:491-497.
[10]Wang HD,Yang L,Yu XJ,et al.Immunolocalization of β-catenin and Lef-1 during postnatal hair follicle development in mice[J].Acta Histochem,2012,114(8):773-778.
[11]Botchkarev VA,Botchkareva NV.Modulation of BMP signaling by Noggin is required for induction of the secondary(Nontylotrieh)hair follicles[J].J Invest Dermatol,2002,118(1):3 -10.
[12]Barsh G,Cotsarelis G.How hair gets its pigment[J].Cell,2007,130:779-781.
[13]Yamaguchi Y,Hearing VJ.Physiological factors that regulate skin pigmentation[J].Biofactors,2009,35(2):193 -199.
[14]Tobin DJ.The cell biology of human hair follicle pigmentation[J].Pigment Cell Melanoma Res,2011,24(1):75 -88.

