环磷酰胺致大鼠免疫抑制和免疫亢进模型的建立与评价
张俊,Yong-Seong Shin,胡安君,杜芳芳,李永亮,王学兵,,张红英,*
(1.河南农业大学牧医工程学院,郑州 450000;2.河南省动物性食品安全重点实验室,郑州 450000)
抗癌药环磷酰胺(cyclophosphamide,Cy)是临床上广泛应用的烷化剂类化疗药物之一,由于其高度且广谱的细胞毒性作用,除了用于治疗急慢性白血病、多发性骨髓瘤、恶性淋巴瘤,也常常被用作免疫抑制药,例如在骨髓移植时的免疫抑制治疗以及治疗一些自身免疫性疾病[1-2]。但是研究表明,环磷酰胺作用于机体的机制是相当复杂的,往往不同剂量,不同作用时间,会引起机体免疫抑制和免疫亢进两种不同结果[3-4]。现有文献报道的免疫抑制模型的建立方法,有一次性大剂量(100或150 mg/kg)注射 Cy[5-7]和多次小剂量(20、40 mg/kg 或 80 mg/kg)给药[8-11]两种方式,但药物的使用剂量和次数也各有差异。Cy不同剂量和给药方式对机体的免疫指标影响到底如何,未见有系统研究。本实验拟通过不同的给药时间和剂量比较,建立大鼠的免疫抑制和免疫亢进模型,并通过对第7天和第15天大鼠的免疫学和血液学指标的分析,确定建立大鼠免疫模型的最佳剂量和给药方式,为临床药物筛选动物模型建立提供理论依据。
1 材料与方法
1.1 试剂
注射用环磷酰胺,美国Baxter公司,购于郑州大学第一附属医院;RPMI-1640培养基(Gibco);ConA,Sigma公司产品;鸡卵清白蛋白(ovalbumin,OVA),Solarbio 公司产品;CCK-8 日本同仁;YAC-1细胞(ATCC,B04005,购自上海复祥生物科技有限公司);大鼠OVA-sIgG抗体检测试剂盒,卡尔文生物科技进口分装试剂盒;Drewe大鼠IL-6预包被ELISA检测试剂盒;Drewe大鼠 TNF-α预包被ELISA检测试剂盒。
1.2 仪器
酶联免疫检测仪(FC 型,Thermo),BC-2800Vet Mindray血液全自动分析。
1.3 动物分组与处理
SPF级SD大鼠64只,体重(120±20)g,雌雄不拘,购自河南省实验动物中心【SCXK(豫)2010-0002】,实验于河南省中医学院进行【SYXK(豫)2010-0001】,实验动物随机分为A、B、C三组,A 组为对照组,B组又分为B1、B2、B3三个小组,C组分为C1、C2、C3、C4四个小组,每组各8只。各组均腹腔注射10%OVA 1 mL进行免疫。B组在注射OVA后6 h腹腔注射Cy,各组剂量分别为:B1组125 mg/kg,一次注射;B2组100 mg/kg,一次注射;B3组每日40 mg/kg,每天一次连续3 d。C组在免疫OVA前3 d腹腔注射Cy,每日剂量分别为:C1组225 mg/kg;C2组80 mg/kg;C3组20 mg/kg;C4组5 mg/kg,连续3d。对照组注射等量生理盐水。
1.4 血液学指标检测
OVA免疫后第7天和第15天大鼠尾静脉采血,血液全自动分析仪对大鼠血液进行分析。
1.5 免疫学指标检测
1.5.1 免疫器官指数的测定
SD大鼠OVA免疫后第7天和第15天各组分别处死4只,取脾脏和胸腺,剔除脂肪,称重,按公式计算免疫器官指数:免疫器官指数(mg/g)=脏器质量(mg)/体重(g)。
1.5.2 淋巴细胞转化实验
免疫后第7天和第15天处死大鼠后,无菌取脾脏,PBS洗两遍,后置于含有5mL PBS的灭菌平皿中,在200目不锈钢网上研磨并过筛制成单细胞悬液。收集细胞悬液于灭菌离心管中,1200 r/min离心6min,弃上清。加入10倍体积的 Tris-NH4Cl,混匀,并于37℃放置5 min,使红细胞充分裂解后,1200 r/min离心6 min,弃上清。用PBS洗细胞两次后,用含10%胎牛血清的1640完全培养液洗细胞一次,然后用1640完全培养液重悬细胞,调整细胞浓度为2×106个/mL。将上述细胞悬液加入96孔板中,每孔200 μL,每组6个重复,同时每孔加入20 μL ConA,使其终浓度为5μg/mL。37℃ 5%CO2培养箱中培养48 h,于培养结束前3 h,每孔加CCK-8试剂20 μL,并用酶标仪检测各孔A450nm吸光度。
1.5.3 NK细胞活性检测
淋巴细胞悬液的制备同1.5.2,制备的淋巴细胞作为效应细胞;取培养24h并处在对数生长期的YAC-1细胞作为靶细胞,用1640完全培养液洗细胞两次,0.5%台盼兰染色检测细胞活性大于95%,调整细胞浓度,使其与效应细胞比值为1∶20。96孔板每孔加效应细胞和靶细胞各100 μL,同时设效应细胞对照孔和靶细胞对照孔,每组6个重复,37℃ 5%CO2培养箱中培养4h,每孔加 CCK-8 试剂20 μL,继续培养3 h后,酶标仪检测各孔A450nm吸光度。NK细胞活性计算公式:NK细胞活性%=[1-(A实验孔 -A效应孔)/A靶细胞]×100%
1.5.4 OVA抗体检测(ELISA法)
免疫后第7天和第15天,大鼠眼球采血,37℃温箱至血清析出,2500 r/min,离心10 min后小心抽取上清液,按试剂盒说明检测各组血清OVA抗体水平。
1.5.5 IL-6和TNF-含量的检测(ELISA法)
免疫后第7天和第15天,大鼠眼球采血,分离血清,按试剂盒说明检测各组血清IL-6和TNF-α含量。
1.5.6 各组免疫指标综合得分
检测的免疫指标显著高于对照组按1分计算,显著低于对照组按-1分计算,与对照组差异不显著按0分计算,各指标得分相加为各组的免疫指标综合得分。
1.6 数据处理和统计学分析
采用SPSS 18.0统计分析软件处理,数据以均数±标准差表示,组间比较采用方差分析统计分析,P<0.05为差异有显著性。
2 结果
2.1 不同处理Cy对大鼠免疫器官指数的影响
B组(免疫OVA后当天注射不同剂量Cy)与对照组相比,在第7天,大鼠脾脏和胸腺指数均显著降低;第15天,脾脏指数又显著升高,胸腺指数各组差异无显著性。
C组(免疫OVA前3d注射不同剂量Cy)与对照组相比,第7天,C2和C3两组脾脏指数明显升高,而C2组胸腺指数却明显下降,C1组脾脏和胸腺指数显著降低;第15天,C1和C4组脾脏指数明显增高,而胸腺指数明显降低。结果见表1。
2.2 不同处理Cy对大鼠血液学指标的影响
B组(免疫OVA后当天注射不同剂量Cy组)与对照组相比,在第7天,大鼠外周血白细胞(WBC)和血小板(PLT)数量显著下降,红细胞数量无差异;第15天B3组白细胞数量显著增多,B1和B2组白细胞数目恢复正常,血小板数目各组明显升高,红细胞数量呈现降低趋势。
C组(免疫OVA前3d注射Cy)与对照组相比,在第7天,C2和C4组白细胞数和血小板数量明显升高,各组红细胞数均有升高趋势;第15天各组白细胞和红细胞数均恢复正常,血小板数,除C3组外均显著高于对照组。结果见表2。
表1 不同Cy处理对大鼠脏器指数的影响()Tab.1 Effect of different cyclophosphamide treatment on the rat organ indexes()
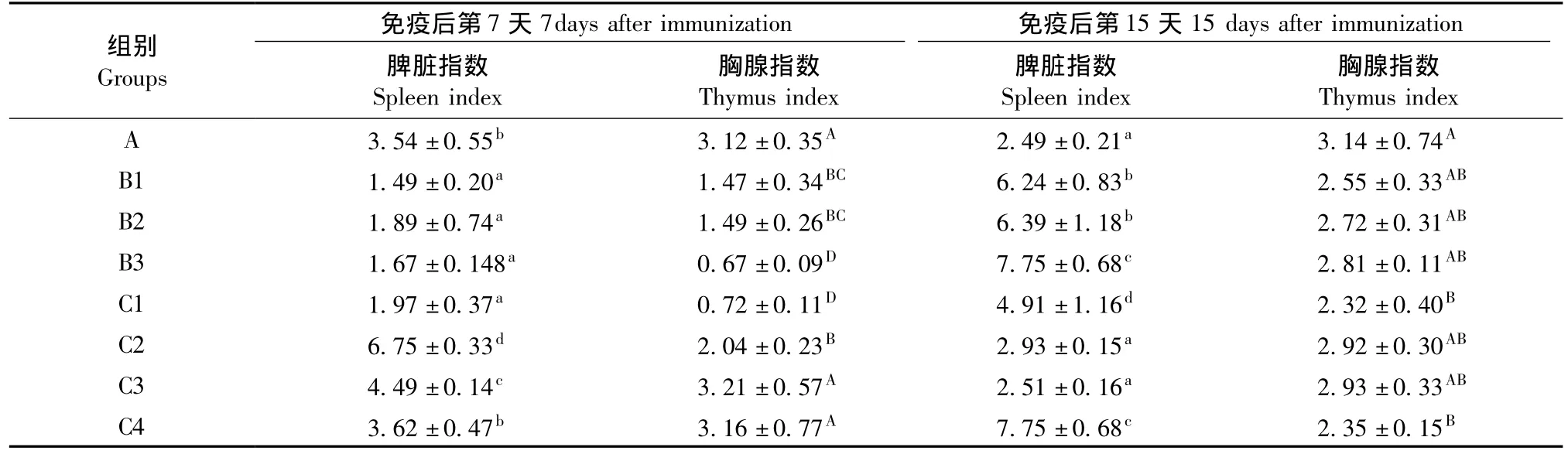
表1 不同Cy处理对大鼠脏器指数的影响()Tab.1 Effect of different cyclophosphamide treatment on the rat organ indexes()
注:同列数据肩标相同字母表示差异无显著性(P>0.05),肩标不同字母表示差异有显著性(P<0.05)。下同。Note.The same letters in the same row mean no significant difference(P>0.05),different letters mean significant difference(P<0.05).The same as below.
组别 免疫后第7天Groups胸腺指数Thymus index A 3.54±0.55b 3.12±0.35A 2.49±0.21a 3.14±0.74A B1 1.49±0.20a 1.47±0.34BC 6.24±0.83b 2.55±0.33AB B2 1.89±0.74a 1.49±0.26BC 6.39±1.18b 2.72±0.31AB B3 1.67±0.148a 0.67±0.09D 7.75±0.68c 2.81±0.11AB C1 1.97±0.37a 0.72±0.11D 4.91±1.16d 2.32±0.40B C2 6.75±0.33d 2.04±0.23B 2.93±0.15a 2.92±0.30AB C3 4.49±0.14c 3.21±0.57A 2.51±0.16a 2.93±0.33AB C4 3.62±0.47b 3.16±0.77A 7.75±0.68c 2.35±0.157days after immunization 免疫后第15天15 days after immunization脾脏指数Spleen index胸腺指数Thymus index脾脏指数Spleen index B
表2 不同Cy处理对大鼠血液学指标的影响()Tab.2 Effect of different cyclophosphamide treatments on the rat hematologic indexes()
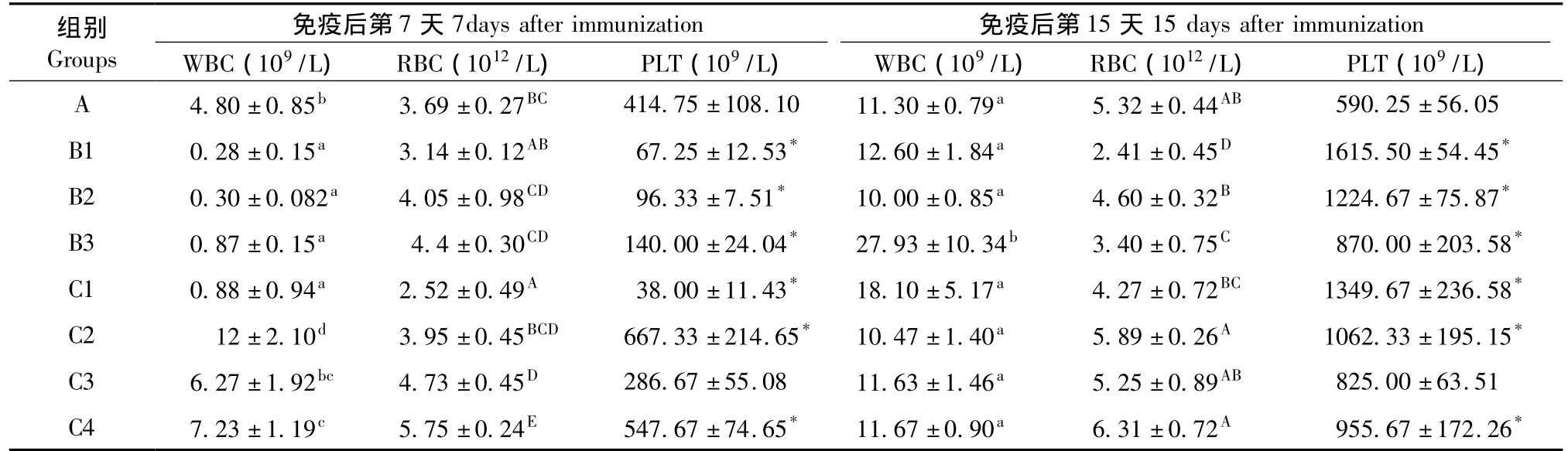
表2 不同Cy处理对大鼠血液学指标的影响()Tab.2 Effect of different cyclophosphamide treatments on the rat hematologic indexes()
注:*表示同列数据中与对照组(A)相比,差异有显著性(P<0.05),下同。Note.*means significant difference(P<0.05)compared with the control group(A)in the same row.
组别 免疫后第7天Groups 7days after immunization 免疫后第15天15 days after immunization WBC(109/L) RBC(1012/L) PLT(109/L) WBC(109/L) RBC(1012/L) PLT(109/L)A 4.80±0.85b 3.69±0.27BC 414.75±108.10 11.30±0.79a 5.32±0.44AB 590.25±56.05 B1 0.28±0.15a 3.14±0.12AB 67.25±12.53* 12.60±1.84a 2.41±0.45D 1615.50±54.45*B2 0.30±0.082a 4.05±0.98CD 96.33±7.51* 10.00±0.85a 4.60±0.32B 1224.67±75.87*B3 0.87±0.15a 4.4±0.30CD 140.00±24.04* 27.93±10.34b 3.40±0.75C 870.00±203.58*C1 0.88±0.94a 2.52±0.49A 38.00±11.43* 18.10±5.17a 4.27±0.72BC 1349.67±236.58*C2 12±2.10d 3.95±0.45BCD 667.33±214.65* 10.47±1.40a 5.89±0.26A 1062.33±195.15*C3 6.27±1.92bc 4.73±0.45D 286.67±55.08 11.63±1.46a 5.25±0.89AB 825.00±63.51 C4 7.23±1.19c 5.75±0.24E 547.67±74.65* 11.67±0.90a 6.31±0.72A 955.67±172.26*
2.3 不同处理Cy对大鼠淋巴细胞转化的影响
B组(免疫OVA后当天注射不同剂量Cy组)与对照组相比,在第7天,淋巴细胞转化能力无差异;第15天,B1组淋巴细胞转化能力显著低于对照组,而B2组淋巴细胞转化能力显著高于对照组。
C组(免疫OVA前3d注射Cy)与对照组相比,在第7天,C2组淋巴细胞转化能力显著升高,其他各组差异不显著;第15天,C2组淋巴细胞转化能力显著下降,C1和C3组淋巴细胞转化能力显著升高。结果见表3。
2.4 不同处理Cy对大鼠NK细胞活性的影响
B组(免疫OVA后当天注射不同剂量Cy组)与对照组相比,在第7天,B1、B2、B3组NK细胞活性均降低,但差异无显著性;在第15天,B1、B2、B3各组NK细胞活性均显著升高。C组(免疫OVA前3d注射Cy)与对照组相比,在第7天,C3组的NK细胞活性显著高于对照组,然而C1组显著低于对照组,在第15天,C1组NK细胞活性较对照组升高,C2、C3和C4组NK细胞活性与对照组相比变化不大。结果见表3。
2.5 不同处理Cy对大鼠OVA抗体生成的影响
与对照组相比,第7天,C3和C4两组抗体水平显著高于对照组,其余各处理组差异无显著性;第15天,C1组抗体水平显著低于对照组,其他各组抗体水平虽都低于对照组,但差异无显著性。B组与对照组无差异,结果见表3。
2.6 不同处理Cy对大鼠IL-6生成的影响
B组(免疫OVA后当天注射不同剂量Cy组)与对照组相比,在第7天,各组大鼠血清IL-6的含量降低,B1、B2组差异有显著性;第15天时,各组虽仍低于对照组,但有恢复趋势,B2组差异有显著性。
C组(免疫OVA前3d注射Cy)与对照组相比,第7天,C1组IL-6含量显著低于对照组;第15天,B2组显著降低,其余各组IL-6含量差异均不显著。结果见表4。
表3 不同Cy处理对大鼠免疫功能的影响()Tab.3 Effect of different cyclophosphamide treatments on the rat immune function()
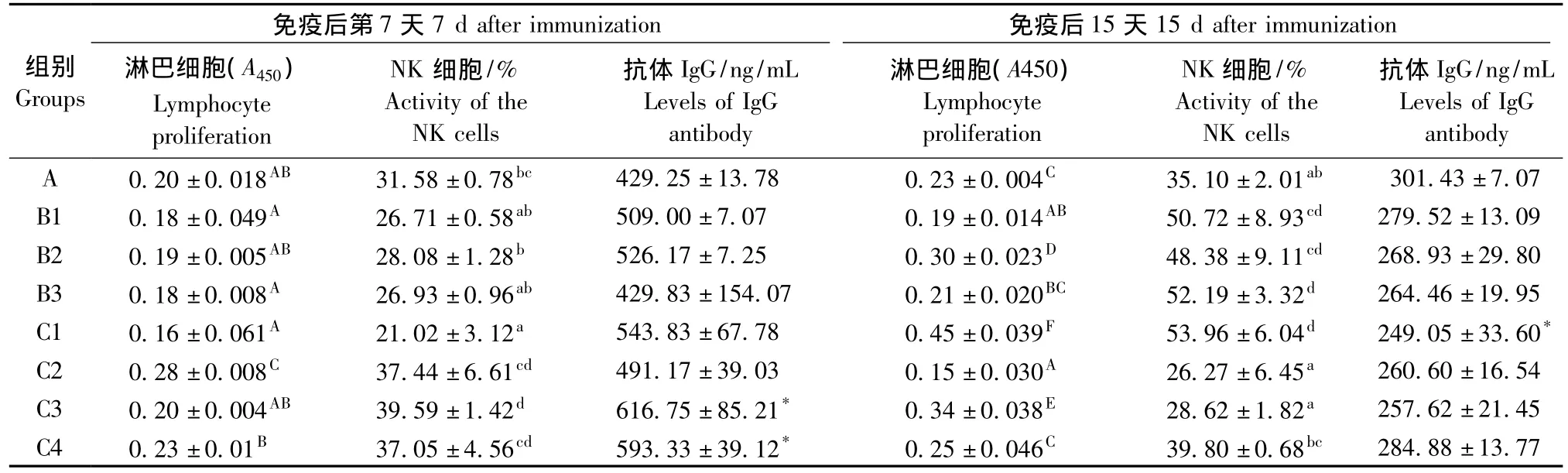
表3 不同Cy处理对大鼠免疫功能的影响()Tab.3 Effect of different cyclophosphamide treatments on the rat immune function()
免疫后第7天7 d after immunization 免疫后15天15 d after immunization组别Groups抗体IgG/ng/mL Levels of IgG antibody A 0.20±0.018AB 31.58±0.78bc 429.25±13.78 0.23±0.004C 35.10±2.01ab 301.43±7.07 B1 0.18±0.049A 26.71±0.58ab 509.00±7.07 0.19±0.014AB 50.72±8.93cd 279.52±13.09 B2 0.19±0.005AB 28.08±1.28b 526.17±7.25 0.30±0.023D 48.38±9.11cd 268.93±29.80 B3 0.18±0.008A 26.93±0.96ab 429.83±154.07 0.21±0.020BC 52.19±3.32d 264.46±19.95 C1 0.16±0.061A 21.02±3.12a 543.83±67.78 0.45±0.039F 53.96±6.04d 249.05±33.60*C2 0.28±0.008C 37.44±6.61cd 491.17±39.03 0.15±0.030A 26.27±6.45a 260.60±16.54 C3 0.20±0.004AB 39.59±1.42d 616.75±85.21* 0.34±0.038E 28.62±1.82a 257.62±21.45 C4 0.23±0.01B 37.05±4.56cd 593.33±39.12* 0.25±0.046C 39.80±0.68bc淋巴细胞(A450)Lymphocyte proliferation NK细胞/%Activity of the NK cells抗体IgG/ng/mL Levels of IgG antibody淋巴细胞(A450)Lymphocyte proliferation NK细胞/%Activity of the NK cells 284.88±13.77
表4 不同处理环磷酰胺对大鼠血清细胞因子含量的影响(,pg/mL)Tab.4 Effect of different cyclophosphsamide treatments on levels of serum cytokines in the rats(,pg/mL)
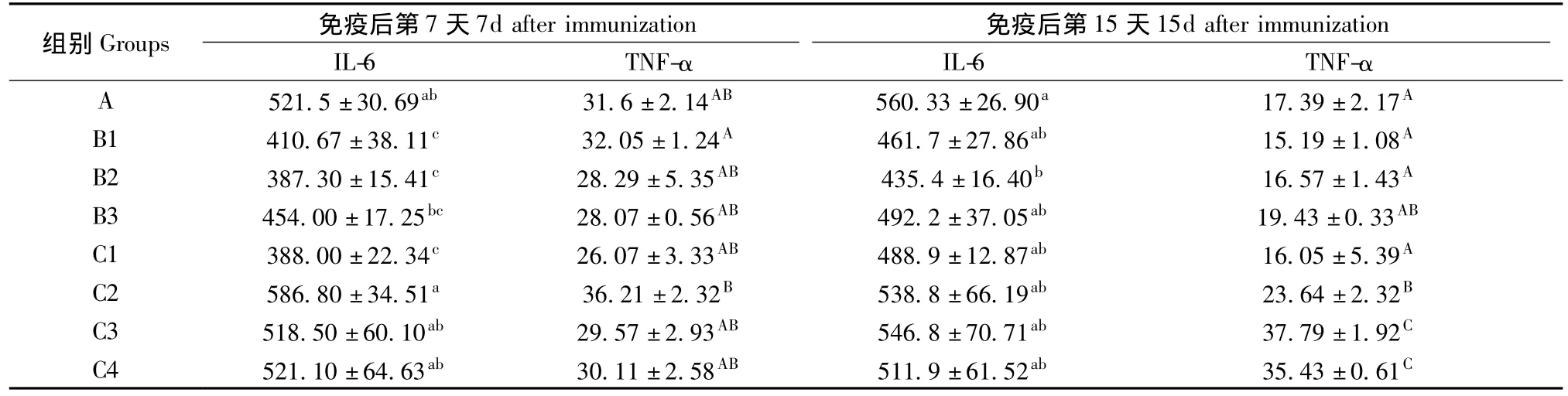
表4 不同处理环磷酰胺对大鼠血清细胞因子含量的影响(,pg/mL)Tab.4 Effect of different cyclophosphsamide treatments on levels of serum cytokines in the rats(,pg/mL)
组别521.5±30.69ab 31.6±2.14AB 560.33±26.90a 17.39±2.17A B1 410.67±38.11c 32.05±1.24A 461.7±27.86ab 15.19±1.08A B2 387.30±15.41c 28.29±5.35AB 435.4±16.40b 16.57±1.43A B3 454.00±17.25bc 28.07±0.56AB 492.2±37.05ab 19.43±0.33AB C1 388.00±22.34c 26.07±3.33AB 488.9±12.87ab 16.05±5.39A C2 586.80±34.51a 36.21±2.32B 538.8±66.19ab 23.64±2.32B C3 518.50±60.10ab 29.57±2.93AB 546.8±70.71ab 37.79±1.92C C4 521.10±64.63ab 30.11±2.58AB 511.9±61.52ab 35.43±0.617d after immunization 免疫后第15天15d after immunization IL-6 TNF-α IL-6 TNF-α A Groups 免疫后第7天C
2.7 不同处理Cy对大鼠TNF-α生成的影响
与对照组相比,在第7天各组TNF-α的含量差异无显著性。第15天,B组(免疫OVA后当天注射不同剂量Cy组)与对照组相比差异均无显著性,C组(免疫OVA前3 d注射Cy)与对照组相比,C2、C3、C4组均显著升高,C1组差异无显著性。结果见表4。
2.8 各组免疫指标综合得分
各实验组免疫指标得分见表5。B1、B2和B3组免疫指标综合得分,7 d分别为 -4、-4、-4,15 d分别为1、1、2;C1、C2、C3 和 C4 组免疫指标综合得分,7 d分别为 -4、3、5、4,15 d 分别为2、1、2、2。
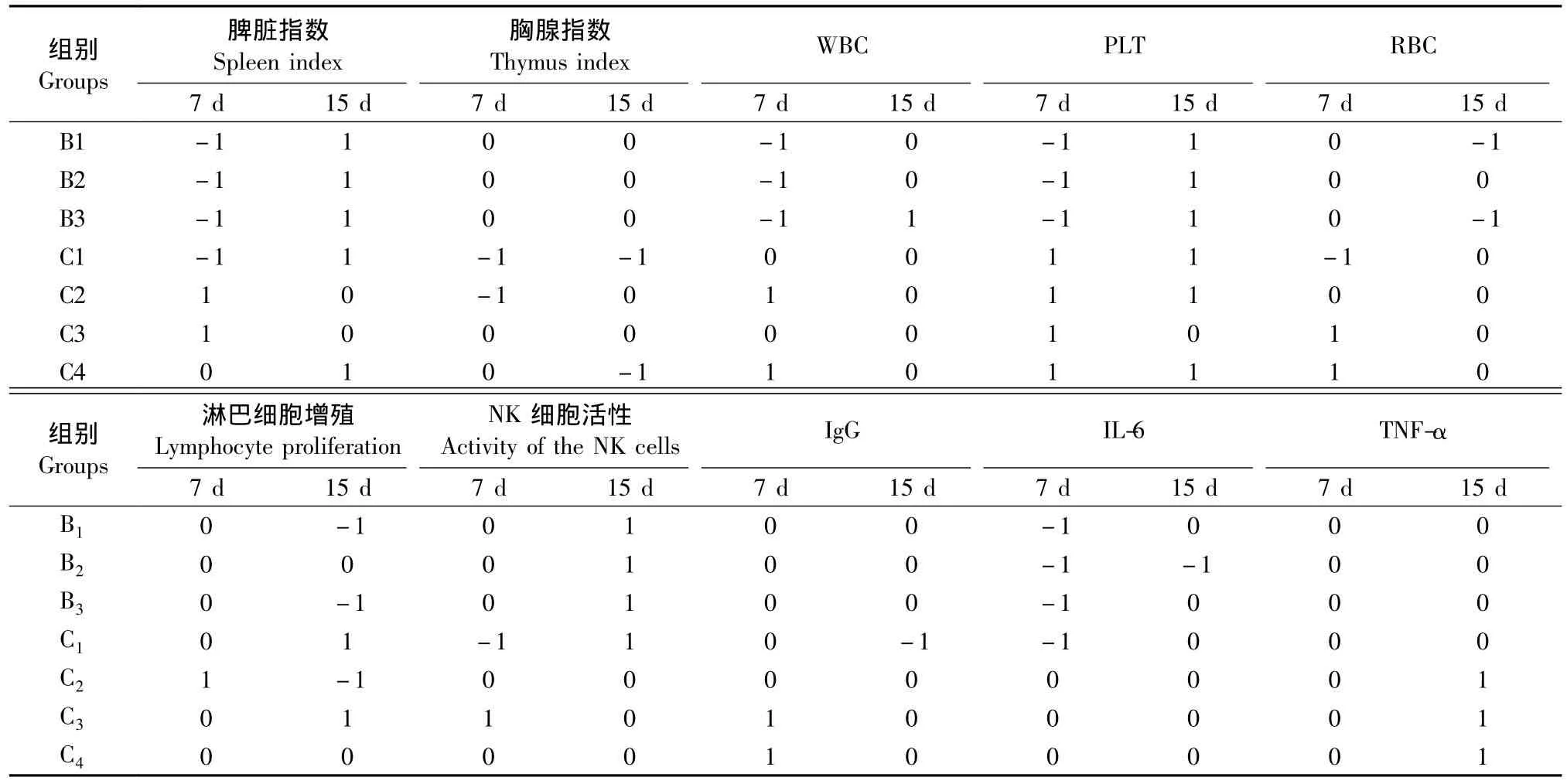
表5 不同处理Cy组大鼠各免疫指标综合得分Tab.5 The composite scores of all immune indexes in the rats treated by different doses of cyclophosphamide
3 讨论
3.1 Cy对大鼠免疫器官的影响
免疫器官是淋巴细胞和其他免疫细胞发生、分化、成熟、定居和增殖以及产生免疫应答的场所,其中胸腺是机体的中枢免疫器官,是T细胞分化成熟的场所。脾脏是最大的外周免疫器官,受抗原刺激后,参与机体细胞和体液免疫的T细胞、B细胞和巨噬细胞大量增生,致脾滤泡增大,脾体积增大;而受到免疫抑制影响时,淋巴组织萎缩,致脾体积缩小。因此免疫器官指数说明了免疫器官的发育状况,间接体现了机体的免疫状态。本实验结果表明免疫后当天注射不同剂量Cy或者多次小剂量注射Cy(B组),以及免疫前3 d超大剂量注射Cy(C1组)在免疫后第7天,均能显著抑制大鼠脾脏指数,但其抑制作用,在15 d时消失,脾脏指数出现代偿性增高。免疫前3 d注射适当剂量(80、20 mg/kg)Cy(C2、C3组)时均能引起大鼠脾脏指数的升高,但维持时间较短暂,在免疫后两周基本上消失,进入机体的代偿期。对于胸腺指数,除了免疫前3 d超大剂量注射Cy(C1组)在7、15 d能显著影响胸腺指数外,其他各组差异不大。
3.2 Cy对大鼠淋巴细胞的影响
淋巴细胞根据表型和功能的不同可以分为很多群体,包括T细胞、B细胞、NK细胞、LAK细胞等等。其中T淋巴细胞在体外经PHA或ConA刺激后,可转化为淋巴母细胞,其转化情况,可反应机体的细胞免疫水平[12]。NK细胞介导天然的免疫应答,它无需抗原或有丝分裂原刺激,也无需抗体或补体参与,即可杀伤肿瘤细胞或溶解被病毒和胞内寄生菌感染的细胞,在抗肿瘤和早期抗感染过程中起重要作用。
本实验结果表明,免疫OVA后当天注射不同剂量的Cy或者免疫前3 d超大剂量注射Cy第7天对T淋巴细胞的转化无影响,但大鼠NK细胞活性有下降趋势而且在第15天NK细胞活性明显增强;而免疫前3 d一次注射80 mg/kg Cy第7天能促进淋巴细胞增殖,一次注射20 mg/kg Cy第7天能促进NK细胞活性。说明Cy对大鼠淋巴细胞的活性有影响,但其影响作用与Cy剂量和作用时间相关。
3.3 Cy对大鼠体液免疫的影响
体液免疫是机体特异性免疫的一个重要组成部分,血清抗体的高低在一定程度上反映机体对疾病的抵抗能力,也即抗体效价的高低一定程度上能反映机体免疫状态。已有文献报道Cy对体液免疫呈现小剂量促进和大剂量抑制的双向作用[4]。本实验结果显示Cy大剂量(总剂量在100~125 mg/kg)对大鼠抗体生成的影响在15d内不明显;225 mg/kg在15 d时可抑制抗体产生;注射较低剂量的Cy(总剂量15、20 mg/kg)对抗体生成在第7天时有一定的促进作用。说明Cy对体液免疫确实有双向调节作用,其作用与剂量密切相关,但作用持续时间不长。
3.4 Cy对大鼠IL-6和TNF-α的影响
多种淋巴细胞如T细胞、B细胞、单核细胞和某些非淋巴细胞如成纤维细胞、内皮细胞等均能产生细胞因子IL-6,IL-6对多种细胞的生长和分化都有调节作用,可促进T淋巴细胞活化和增生,辅助B淋巴细胞促使抗体合成和分泌,参与体液免疫过程。TNF-α主要是由巨噬细胞和T细胞产生的促炎因子,在许多生理的免疫应答中有重要作用。研究表明促炎因子IL-6和TNF-α与一些自身免疫性疾病的发生和转归密切相关,例如类风湿性关节炎病人可在滑膜和血清中检测到高水平表达的IL-6[13],银屑病病损局部和血清中IL-6和TNF-α水平均见升高[14]。本实验结果表明大剂量注射Cy(总剂量100~225 mg/kg)能显著抑制大鼠血清IL-6的含量,但作用时间有限,而免疫前3 d注射Cy(总剂量在15、20或者80 mg/kg)能显著提高TNF-α的含量。
3.5 Cy对大鼠免疫功能调节作用的剂量与时效
有文献报道用低剂量(20、80 mg/kg)多次腹腔注射的方式建立免疫抑制模型[8,15-16],我们在前期预实验时(分别以125、100 mg/kg的剂量腹腔一次注射,以每日80、40 mg/kg剂量连续3 d腹腔注射)发现,以每日80 mg/kg的剂量连续3 d腹腔注射大鼠,从免疫后第12天开始大鼠出现不同程度的死亡,可能由于抑制作用过强超出了大鼠自身的调节范围。
本实验结果显示,Cy不同剂量、使用次数对机体的免疫功能会有影响,且其影响持续时间有限,在使用Cy建立免疫抑制或免疫亢进模型时,应综合考虑各项免疫指标和其作用时效。免疫抑制模型可选用B1、B2模型,即注射OVA后6 h腹腔一次性注射Cy(125 mg/kg或100 mg/kg),两组模型免疫指标综合得分一样。免疫亢进模型,实验周期7 d以内,C3、C4模型均可(即免疫OVA前3 d腹腔一次性注射Cy剂量20 mg/kg或每日5 mg/kg,连续3 d),C3要更好些;实验周期大于7 d小于15 d,C3组模型更合适(即Cy剂量20 mg/kg)。
[1]Mei YX,Chen HX,Zhang J,et al.Protective effect of chitooligosaccharides against cyclophosphamide-induced immunosuppression in mice[J].Int J Biol Macromol,2013,62:330 -335.
[2]El-Abasy M,Motobu M,Nakamura K,et al.Preventive and therapeutic effects of sugar cane extract on cyclophosphamide-induced immunosuppression in chickens[J].Int Immunopharmacol,2004,4:983 -990.
[3]Huyan XH,Lin YP,Gao T,et al.Immunosuppressive effect of cyclophosphamide on white blood cells and lymphocyte subpopulations from peripheral blood of Balb/c mice[J].Int Immunopharmacol,2011,11:1293 -1297.
[4]王兴旺,陈敏珠,徐叔云.环磷酰胺的免疫药理作用[J].中国病理生理杂志,1991,7(6):664-665.
[5]Salva S,Marranzino G,Villena J,et al.Probiotic Lactobacillus strains protect against myelosuppression and immunosuppression in cyclophosphamide-treated mice [J].Int Immunopharmacol,2014,22:209-221.
[6]王萌,方笋,赵晓娟,等.芍芪多苷对小鼠体液免疫的调节作用[J].中国新药杂志,2008,17(10):842-846.
[7]赵弋清,罗霞,陈东辉,等.不同剂量环磷酰胺诱导正常小鼠免疫抑制的对比研究[J].免疫学杂志,2005,21(3):122-124.
[8]Wang H,Wang M,Chen J,et al.A polysaccharide from Strongylocentrotus nudus eggs protects against myelosuppression and immunosuppression in cyclophosphamide-treated mice [J].Int Immunopharmacol,2011,11:1946-1953.
[9]Fan Y,Lu Y,Wang D,et al.Effect of epimedium polysaccharide-propolis flavone immunopotentiator on immunosuppression induced by cyclophosphamide in chickens[J].Cell Immunol,2013,281:37-43.
[10]苗明三.薏苡仁多糖对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].中医药学报,2002,30(5):49-50.
[11]杨颖,蔡玟,黄志彪,等.环磷酰胺致小鼠免疫功能低下模型建立与评价[J].中国公共卫生,2008,24(5):581-583.
[12]Fan Y,Hu Y,Wang D,et al.Epimedium polysaccharide and propolis flavone can synergistically stimulate lymphocyte proliferation in vitro and enhance the immune responses to ND vaccine in chickens[J].Int J Biol Macromol,2010,47:87 -92.
[13]Guirado A,Lopez Sanchez JI,Ruiz-Alcaraz AJ,et al.Synthesis and biological evaluation of 4-alkoxy-6,9-dichloro[1,2,4]triazolo[4,3-a]quinoxalines as inhibitors of TNF-alpha and IL-6 [J].Eur J Med Chem,2012,54:87-94.
[14]刘元林,徐文,鲁祖清.银屑病患者外周血TNF-α、IL-6水平的变化及意义[J].海军总医院学报,2007,20(4):222-224.
[15]Chen X,Nie W,Fan S,et al.A polysaccharide from Sargassum fusiforme protects against immunosuppression in cyclophosphamide-treated mice[J].Carbohydr Polym,2012,90:1114 -1119.
[16]Guo L,Liu J,Hu Y,et al.Astragalus polysaccharide and sulfated epimedium polysaccharide synergistically resist the immunosuppression[J].Carbohydr Polym,2012,90:1055 -1060.

