黄芪多糖干预环磷酰胺所致免疫抑制小鼠的免疫功能
张芮琪,陈正礼,罗启慧
(四川农业大学动物医学院,四川 雅安 625014)
近年来,健康养殖成为人们关注的问题,中草药及其提取物因其来源广泛、低毒及无耐药性和无药物残留等优势成为替代抗生素,治疗和预防畜禽动物疾病的重要药物。黄芪为豆科植物蒙古黄芪和膜荚黄芪的干燥根,具有补气固表,利尿拔毒,排脓和敛疮生肌等功效[1],为中医临床常用药,有关其制剂及活性成分的药理学研究一直受到重视。研究证实,其化学成分主要含有多糖、黄酮、多种皂苷以及生物碱、氨基酸和亚油酸等。其中,黄芪多糖(astragalus polysaccharide,APS)作为黄芪的主要有效成分,在调节免疫、抗病毒、抗衰老等方面具有重要作用[2]。近年来,黄芪多糖因其显著的免疫增强和抗病毒效应,加上来源丰富、价格低廉、较低的毒性以及无耐药性等[3]特性而广泛应用于兽医临床、畜牧及水产动物的养殖中,其利用价值越来越受到重视。但目前在其对免疫抑制动物的研究上还没有系统的综合性评价指标与体系,因此本实验就黄芪多糖对正常和免疫抑制小鼠免疫器官指数及其组织形态学的影响进行观察,并从腹腔巨噬细胞吞噬鸡红细胞功能和外周血T淋巴细胞亚群 CD3+、CD4+和CD8+百分含量两个方面研究黄芪多糖对正常小鼠及免疫抑制小鼠非特异性免疫及T淋巴细胞亚群的影响。一方面为其临床应用提供理论依据,另一方面也可为多糖类物质免疫调控评价提供一套较为系统的评价指标体系。
1 材料与方法
1.1 材料
1.1.1 实验动物
120只5周龄SPF级KM小鼠,雌雄各半,体重(18±3)g,来源于成都达硕生物科技有限公司【SCXK(川)2013-24】。实验在雅安普莱美生物科技有限公司【SYXK(川)2014-186】进行。在室温22℃、控光条件下(14 h光照,10 h黑暗)按常规方式单笼饲养,在实验室适应环境1周后用于实验,并按实验动物使用的原则给予人道的关怀。
1.1.2 主要仪器设备
流式细胞仪(Beckman Coulter Altra,美国Beckman公司);Motic数码显微照相系统(厦门麦克奥迪实业有限公司);Leica RM2235型轮转切片机(德国徕卡仪器设备公司),LS-100石蜡包埋机和GTK-2002自动恒温摊烤烘片机(沈阳市龙首电子仪器有限公司),Sartorius AA-160型电子读数分析天平(北京赛多利斯仪器系统有限公司),101型电热鼓风干燥箱(北京科伟永兴仪器有限公司),数显恒温水浴锅HH-6型(国华电器有限公司)等。
1.1.3 主要试剂
黄芪多糖(购自陕西宝鸡方晟生物开发有限公司)、环磷酰胺、FITC anti-mouse CD3+、PE antimouse CD4+、PE anti-mouse CD8+(均为美国 BD 公司产品),肝素钠(上海第一生化药业有限公司),苏木素、伊红、瑞特氏染液等。
1.2 方法
1.2.1 实验分组
将小鼠随机分为6组,每组20只:I组为对照组,II组为黄芪多糖低剂量组(100 mg/kg)、III为黄芪多糖高剂量组(500 mg/kg)、IV组为CTX免疫抑制模型组、V为CTX+黄芪多糖低剂量组、VI为CTX+黄芪多糖高剂量组。各组按相应剂量灌胃中药多糖,连续灌胃14d。其中,第 IV、V、VI三组以CTX致免疫抑制小鼠模型为基础[于灌服多糖的第1天腹腔注射75 mg/(kg·bw)CTX,隔1天注射1次,共3次]。
1.2.2 黄芪多糖对小鼠免疫器官指数及组织发育的影响
末次给药后24 h,各组随机取6只小鼠称重,而后处死小鼠,取其脾脏及胸腺分别称重,并计算胸腺和脾脏指数。称重后的胸腺和脾脏组织均投入4%多聚甲醛中固定,按常规组织学方法制备石蜡切片,HE染色后进行组织病理学观察。
1.2.3 黄芪多糖对小鼠非特异性免疫功能的影响
按照参考文献[4]方法进行。主要操作如下:在末次给药前三天每组随机选6只小鼠腹腔注射6%淀粉溶液1 mL,末次给药后30 min,每组小鼠腹腔注射2 mL的1%鸡红细胞悬液,30 min后腹腔注射2 mL PBS缓冲液,按揉腹部3~5 min。颈椎脱臼法处死小鼠,酒精消毒,吸取腹腔液,制作腹腔巨噬细胞涂片,姬姆萨染色,镜下观察巨噬细胞吞噬鸡红细胞情况。按以下公式计算吞噬百分率和吞噬指数。
吞噬百分率:有吞噬作用的巨噬细胞数/计数的总巨噬细胞数 ×100%
吞噬指数:吞噬的鸡红细胞总数/计数的总巨噬细胞数 ×100%
1.2.4 黄芪多糖对免疫抑制模型小鼠外周血CD3+、CD4+和 CD8+的影响
末次给药后2 h,每组随机选6只小鼠。对各组小鼠实行摘除眼球法采血,1%肝素钠抗凝。取200 μL抗凝血加入抗体20 μL,充分混匀,震荡,室温避光20 min;加600 μL红细胞裂解液去除红细胞,震荡避光10 min;离心1500 r/min,5 min,弃上清,加PBS缓冲液1 mL洗,以去除未结合抗体;离心沉淀后弃上清;加300 μL 1%多聚甲醛固定液重悬,置于4℃冰箱,于24 h内流式细胞仪检测。
1.2.5 数据分析
2 结果
2.1 黄芪多糖对小鼠免疫器官指数的影响
结果见表1。由表1可以看出,与对照组相比,高剂量APS可显著提高正常小鼠脾脏的器官指数(P<0.05),高、低剂量的APS均可极显著提高正常小鼠的胸腺指数(P<0.01)。CTX模型组小鼠脾脏指数和胸腺指数均极显著低于对照组,表明造模成功。与CTX模型组相比,低剂量APS可显著提高CTX致免疫抑制小鼠的脾脏指数和胸腺指数(P<0.05),而高剂量APS可极显著提高CTX致免疫抑制小鼠的脾脏指数和胸腺指数(P<0.01)。
2.2 黄芪多糖对小鼠免疫器官组织发育的影响
2.2.1 黄芪多糖对小鼠脾脏组织结构的影响
对照组脾脏被膜较厚,并伸入实质形成小梁;脾脏实质由红髓和白髓组成,其界限分明,白髓内淋巴细胞较为密集。与对照组相比(图1A),低、高剂量APS组脾脏白髓面积明显增大,脾小结生发中心明显,动脉周围淋巴鞘增厚,白髓内淋巴细胞数量更多(图1B、C)。CTX组脾脏组织结构杂乱,红髓与白髓界限不清,白髓结构散乱,脾小结明显变小,淋巴细胞较为稀疏(图1D)。CTX+低剂量APS组,脾脏组织结构明显改善,红髓与白髓界限逐渐分明,白髓面积增大、淋巴细胞变得密集(图1E);CTX+高剂量APS组脾脏组织形态恢复情况更好,动脉周围淋巴鞘明显增厚(图1F)。
2.2.2 黄芪多糖对小鼠胸腺组织结构的影响
对照组胸腺小叶分界清楚,皮质与髓质界限清晰,皮质内淋巴细胞较为密集(图2A)。与对照组相比,低、高剂量APS组的小鼠胸腺组织结构及小叶面积均有所增大,皮质变厚(图2B、图2C)。CTX模型组胸腺小叶结构不清,胸腺皮质萎缩、其中淋巴细胞变得稀疏,髓质区域明显变大(图2D)。CTX+低剂量APS组小鼠胸腺小叶结构较为清晰,皮髓质分界清楚,皮质增厚(图2E)。CTX+高剂量APS组胸腺组织结构明显好转,皮质明显增厚、其中淋巴细胞密集(图2F)。
2.3 黄芪多糖对小鼠巨噬细胞功能的影响
如表1所示,与对照组相比,低、高剂量的APS均可显著提高正常小鼠腹腔巨噬细胞吞噬百分率及吞噬指数(P<0.05);与对照组比,CTX致免疫抑制模型组腹腔巨噬细胞吞噬百分率和吞噬指数均极显著降低(P<0.01),而灌胃低、高剂量的APS均可显著提高CTX致免疫抑制小鼠的吞噬百分率及吞噬指数(P<0.05)。
表1 黄芪多糖对小鼠免疫器官指数及巨噬细胞功能的影响()Tab.1 The effect of astragalus polysaccharide on the thymus,spleen and macrophage phagocytosis indexes in mice
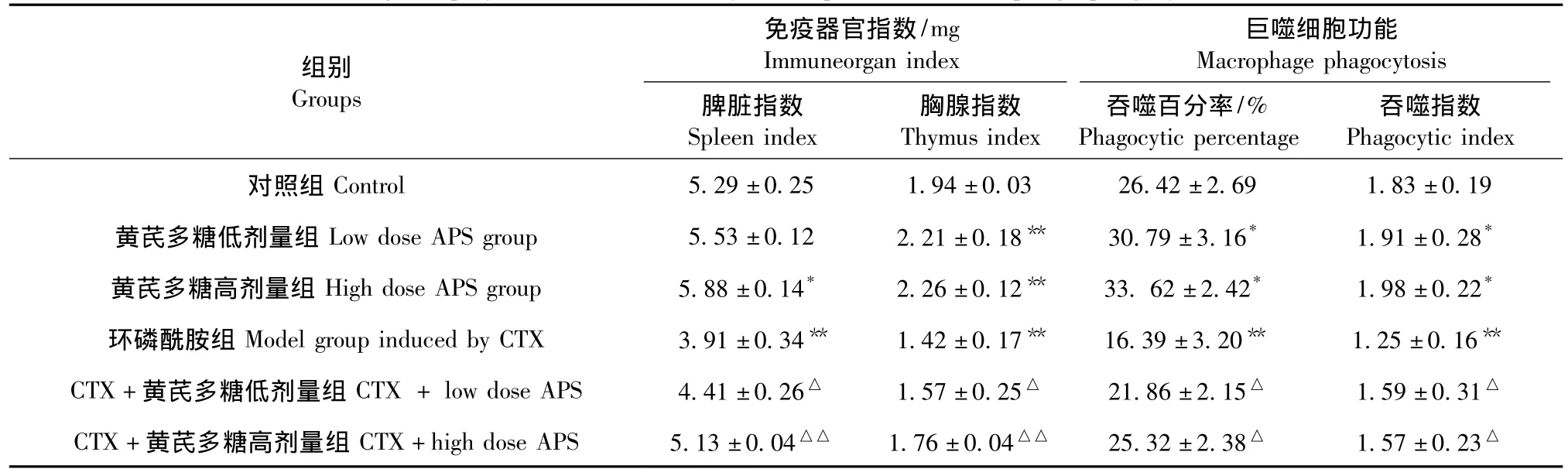
表1 黄芪多糖对小鼠免疫器官指数及巨噬细胞功能的影响()Tab.1 The effect of astragalus polysaccharide on the thymus,spleen and macrophage phagocytosis indexes in mice
注:*表示与对照组相比差异有显著性(P<0.05);**表示与对照组相比差异有显著性(P<0.01);△表示与环磷酰胺组相比差异有显著性(P<0.05);△△表示与环磷酰胺组相比差异有显著性(P<0.01)。Note.*P<0.05 indicates significant and**P<0.01 indicates extremely significant differences compared with the control group.△P<0.05 indicates significant and△△P<0.01 indicates extremely significant differences compared with the CTX model group.
组别Immuneorgan index免疫器官指数/mg吞噬指数Phagocytic index对照组 Control 5.29±0.25 1.94±0.03 26.42±2.69 1.83±0.19黄芪多糖低剂量组 Low dose APS group 5.53±0.12 2.21±0.18** 30.79±3.16* 1.91±0.28*黄芪多糖高剂量组 High dose APS group 5.88±0.14* 2.26±0.12** 33.62±2.42* 1.98±0.22*环磷酰胺组 Model group induced by CTX 3.91±0.34** 1.42±0.17** 16.39±3.20** 1.25±0.16**CTX+黄芪多糖低剂量组 CTX+low dose APS 4.41±0.26△ 1.57±0.25△ 21.86±2.15△ 1.59±0.31△CTX+黄芪多糖高剂量组 CTX+high dose APS 5.13±0.04△△ 1.76±0.04△△ 25.32±2.38△ 1.57±0.23 Groups巨噬细胞功能Macrophage phagocytosis脾脏指数Spleen index胸腺指数Thymus index吞噬百分率/%Phagocytic percentage△
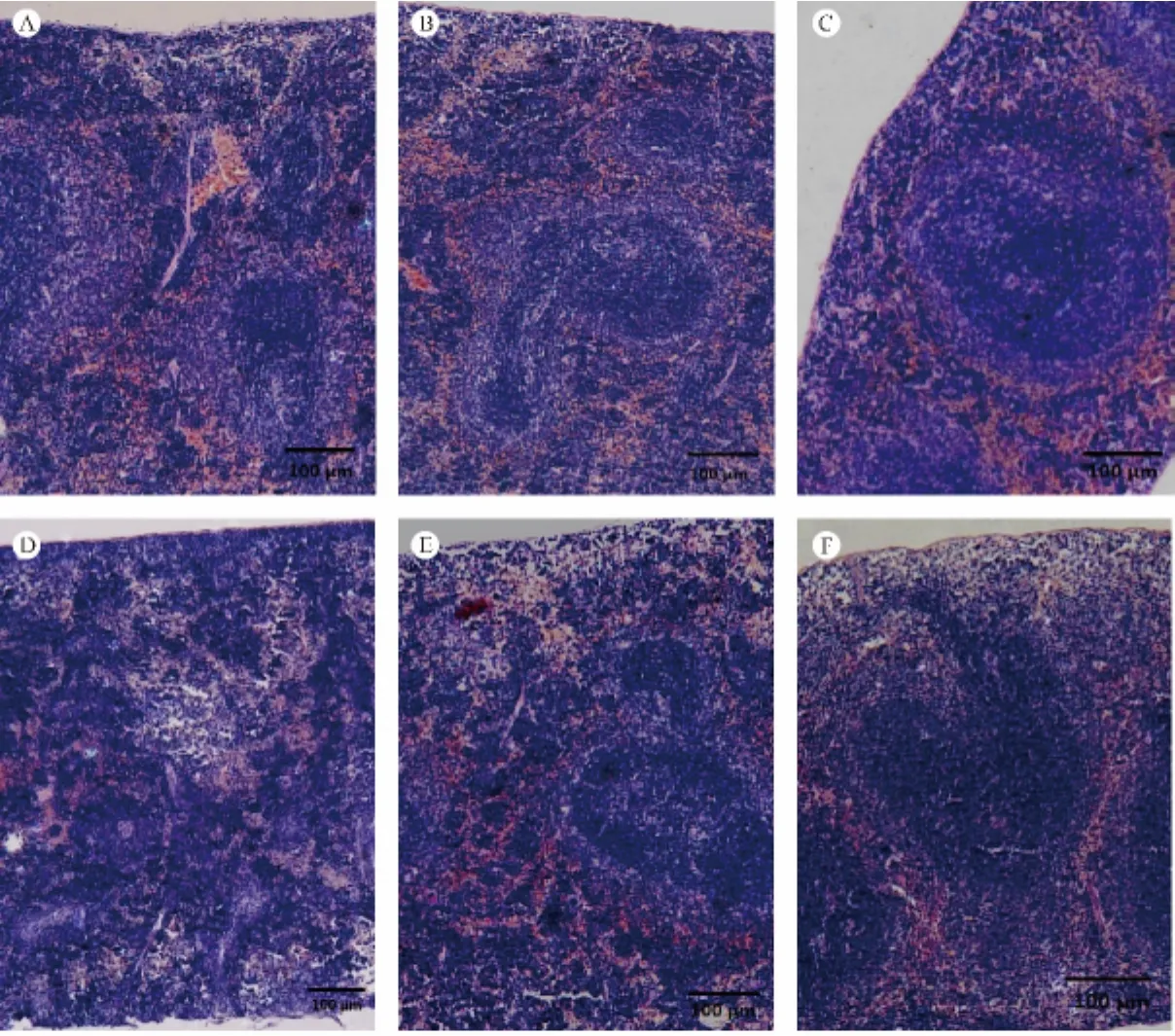
注:A.空白对照组;B.黄芪多糖低剂量组;C.黄芪多糖高剂量组;D.CTX组;E.CTX+APS低剂量组;F.CTX+APS高剂量组。图1 黄芪多糖对小鼠脾脏组织学结构的影响Note.A.Blank control group;B.Low dose APS group;C.High dose APS group;D.CTX group;E.CTX+low dose APS group;F.CTX+high dose APS groupFig.1 Effects of different doses of APS on histological structure of the mouse spleens
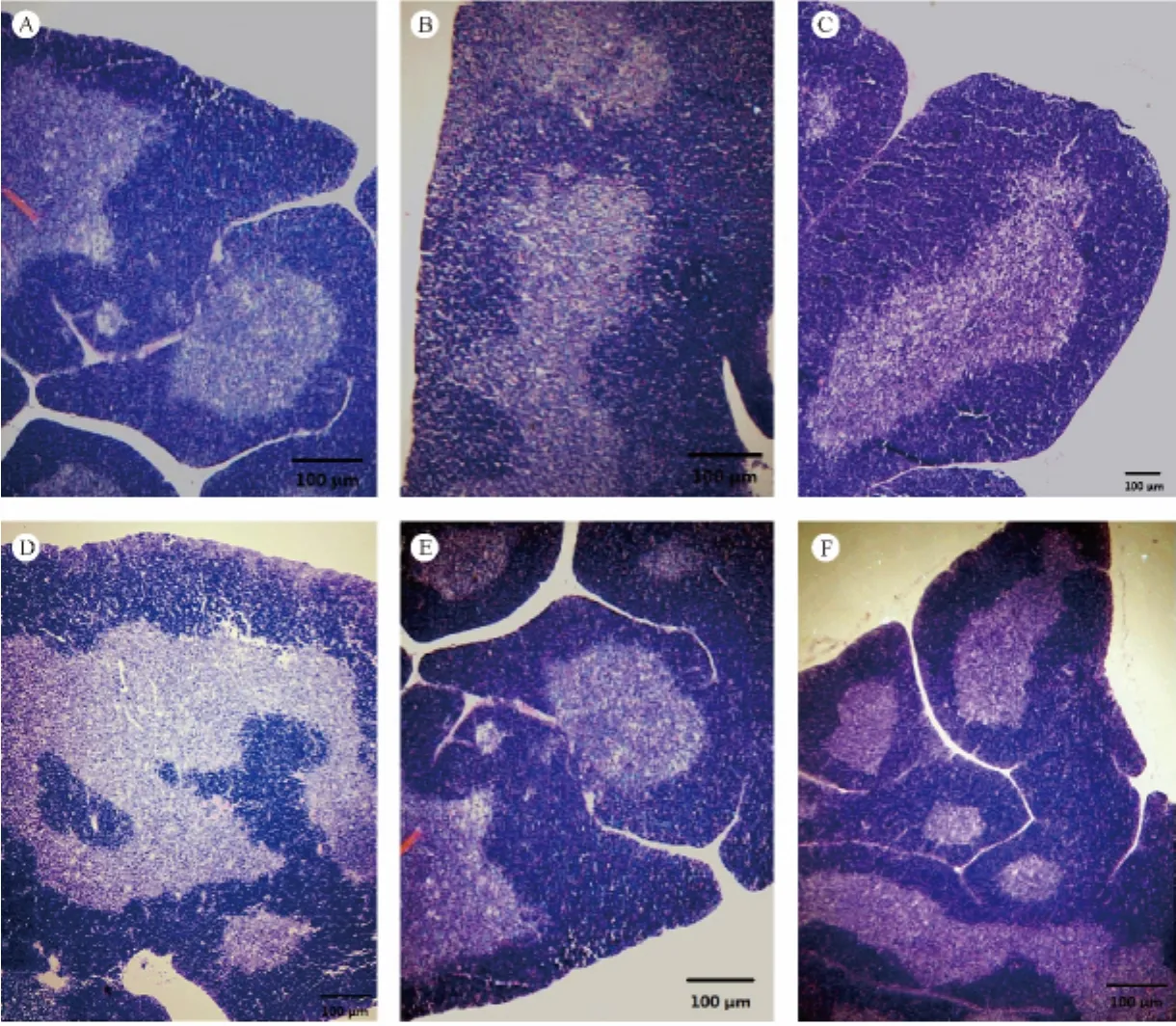
注:A.空白对照组;B.黄芪多糖低剂量组;C.黄芪多糖高剂量组;D.CTX组;E.CTX+APS低剂量组;F.CTX+APS高剂量组。图2 黄芪多糖对小鼠胸腺组织学结构的影响Note.A.Blank control group;B.Low dosage APS group;C.High dosage APS group;D.CTX group;E.CTX+low dosage APS group;F.CTX+high dosage APS group.Fig.2 Effects of differerct doses of APS on histological structure of the mice spleens
2.4 黄芪多糖对免疫抑制小鼠T淋巴细胞亚群的影响
如表2所示,与对照组相比,低、高剂量的APS可不同程度地提高小鼠 CD3+、CD4+和 CD4+/CD8+比值、降低CD8+百分含量(P<0.05或P<0.01);而 CTX 组 CD3+、CD4+和 CD4+/CD8+明显降低,说明造模成功。与CTX组相比,低、高剂量的APS均可显著(P<0.05)或极显著(P<0.01)提高免疫抑制小鼠外周血血清中CD3+、CD4+和CD4+/CD8+比值(P<0.05或P<0.01),降低 CD8+百分含量。
表2 黄芪多糖对小鼠外周血T淋巴细胞亚群的影响(,%)Tab.2 Influence of PCP on T lymphocytes subsets in peripheral blood of the immunosuppressed mice
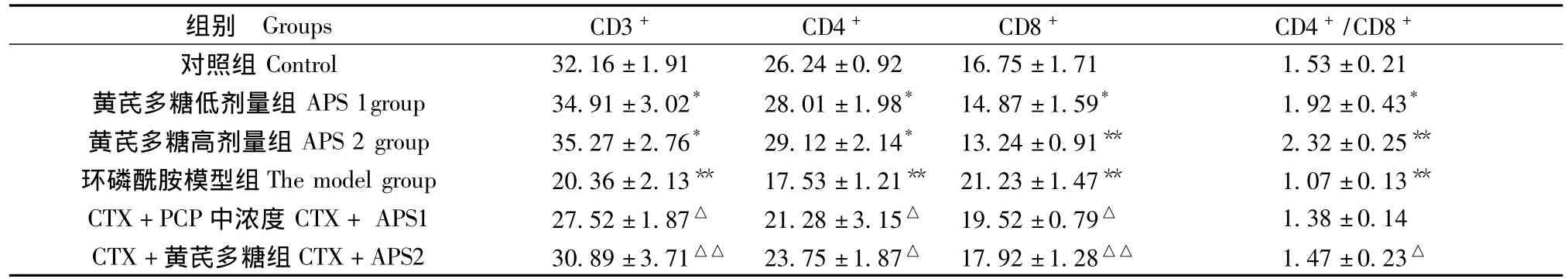
表2 黄芪多糖对小鼠外周血T淋巴细胞亚群的影响(,%)Tab.2 Influence of PCP on T lymphocytes subsets in peripheral blood of the immunosuppressed mice
注:*表示与对照组相比差异有显著性(P<0.05),**表示与对照组相比差异有显著性(P<0.01);△表示与环磷酰胺组相比差异有显著性(P<0.05),△△表示与环磷酰胺组相比差异有显著性(P<0.01)。Note.*Difference is significant(P< 0.05)and**difference is extremely significant(P< 0.01)in comparison with the control;△Difference is significant(P<0.05)and△△difference is extremely significant(P<0.01)compared with CTX model group.
组别 Groups CD3+ CD4+ CD8+ CD4+/CD8+对照组 Control 32.16±1.91 26.24±0.92 16.75±1.71 1.53±0.21黄芪多糖低剂量组 APS 1group 34.91±3.02* 28.01±1.98* 14.87±1.59* 1.92±0.43*黄芪多糖高剂量组 APS 2 group 35.27±2.76* 29.12±2.14* 13.24±0.91** 2.32±0.25**环磷酰胺模型组The model group 20.36±2.13** 17.53±1.21** 21.23±1.47** 1.07±0.13**CTX+PCP中浓度CTX+APS1 27.52±1.87△ 21.28±3.15△ 19.52±0.79△ 1.38±0.14 CTX+黄芪多糖组CTX+APS2 30.89±3.71△△ 23.75±1.87△ 17.92±1.28△△ 1.47±0.23△
3 讨论
3.1 黄芪多糖对正常和CTX诱导免疫抑制小鼠脾脏和胸腺发育的影响
脾脏、胸腺指数在一定程度上能反应出免疫器官的发育程度,可以直观的体现出机体免疫功能的强弱。较多研究结果已经证实,植物多糖作为免疫调节剂能够促进免疫器官的发育成熟,延缓胸腺退化。Liu等[5]的研究证实,鸡爪大黄多糖可以明显提高辐射诱导免疫损伤小鼠的脾脏和胸腺指数、碳廓清率、巨噬细胞吞噬活性、淋巴细胞增值率及血清溶血素值及NK活性,提示鸡爪大黄多糖对辐射诱导的小鼠免疫损伤具有保护作用。衰老小鼠给以白术多糖提取物后其胸腺、脾脏和心脏指数均显著增加,提示白术多糖提取物可能增强衰老小鼠的免疫并促进其心脏功能[6]。鸡枞菌多糖能明显拮抗CTX的细胞毒作用,促进淋巴细胞增殖,提高免疫抑制小鼠的脾脏和胸腺重量及器官指数,对免疫器官有明显保护作用[7]。150 mg/kg黄芪多糖灌胃小鼠7d可显著小鼠胸腺和脾脏重量[8]。本实验结果表明,低、高剂量的APS均可显著提高正常小鼠及免疫抑制小鼠的脾脏及胸腺器官指数,表明PCP可以促进小鼠免疫器官的生长发育,对环磷酰胺致免疫功能障碍有一定的改善,且其促进作用与剂量呈正相关。
免疫器官的组织发育程度也直接影响到其生理功能,较多的研究已经证实,某些中药成分可以在一定程度上促进动物免疫器官的组织发育。周金星等[9]研究了不同剂量党参和淫羊藿提取物对青脚麻鸡脾脏组织结构的影响,结果表明饮水中添加党参和淫羊藿提取物均可促进青脚麻鸡脾脏的组织发育。乔恩美等[10]的研究结果显示,基础日粮中添加20和40 mg/kg低聚壳聚糖能明显促进肉鸡的生长性能及免疫器官的组织发育,增强机体的免疫功能。本实验结果表明,低、高剂量APS组小鼠脾脏白髓面积增大,脾小结生发中心明显,动脉周围淋巴鞘增厚;胸腺小叶体积增大,皮质变厚,高剂量PCP组效果更为明显。CTX致免疫抑制小鼠在灌服不同剂量的APS后,脾脏及胸腺组织形态均有所改善,提示APS可以拮抗CTX引起的小鼠脾脏和胸腺发育损伤,提高免疫抑制小鼠脾脏及胸腺的免疫功能。
3.2 黄芪多糖对腹腔巨噬细胞吞噬能力的影响
巨噬细胞是机体重要的免疫细胞,具有抗感染、抗肿瘤和免疫调节等重要作用。因而,激活巨噬细胞可提高机体抗肿瘤和抗感染能力[11]。腹腔巨噬细胞的吞噬功能还是机体非特异性免疫应答的重要组成部分。已经证实,植物多糖可激活巨噬细胞,提高其吞噬功能。如马齿觅多糖可显著提高巨噬细胞的吞噬功能,增加吞噬百分率和吞噬指数,促进淋巴细胞的转化[12]。曾星等[13]用流式细胞术研究了猪苓多糖对模型大鼠巨噬细胞吞噬率的影响,结果表明,猪苓多糖可显著促进膀胱癌大鼠腹腔巨噬细胞的吞噬功能和表面免疫相关分子的表达。本实验结果表明,与对照组相比,CTX组小鼠腹腔巨噬细胞吞噬百分率和吞噬指数均显著降低,低、高剂量APS组小鼠腹腔巨噬细胞吞噬指数与对照组相比均显著升高。添加低、高剂量的APS均显著提高了免疫抑制小鼠的巨噬细胞吞噬百分率和吞噬指数,说明APS在一定程度上可促进小鼠的非特异性免疫功能。
3.3 黄芪多糖对免疫抑制小鼠外周血T淋巴细胞亚群的影响
T淋巴细胞的表面标志有两大类:一类为T淋巴细胞所共有的CD3+标志,另一类为亚群特有标志,CD4+为辅助/诱导功能细胞,CD8+为抑制/杀伤功能细胞。有研究证实,T淋巴细胞对体内一切体液和细胞免疫反应类型和强度都有调节作用,其中主要的是CD3、CD4、CD8细胞亚群。CD3+亚群是成熟的T淋巴细胞,其比值降低提示机体细胞免疫功能减弱,机体易发生感染;CD4+亚群是调节机体免疫功能最重要的枢纽细胞,其值降低会引起机体免疫功能低下;CD8+亚群为免疫反应中的直接杀伤性细胞,其值增高可导致免疫缺陷;CD4+/CD8+比值,判断机体免疫功能紊乱的临床诊断敏感指标,其值降低提示机体处于“免疫抑制”状态[14]。有研究[15-16]证实,黄芪多糖(astragalus polysaccharide,APS)、板蓝根多糖(isatis root polysaccharide,IRPS)、牛膝多糖(achyranthes root polysaccharide,ARPS)和山药多糖(Chinese yam polysaccharide,CYPS)均能显著提高免疫雏鸡的新城疫HI抗体效价,促进外周血T淋巴细胞增殖,并可提高CD4+、CD8+T淋巴细胞含量和CD4+/CD8+值。本实验结果显示,中、高剂量的APS均可不同程度提高正常及免疫抑制小鼠外周血血清中 CD3+、CD4+和 CD4+/CD8+比值(P<0.05或P<0.01),而降低CD8+百分含量,提示黄芪多糖可以明显促进免疫抑制小鼠的T淋巴细胞增殖,增强机体的细胞免疫,从而改善机体的免疫功能低下状态。
3.4 黄芪多糖干预小鼠免疫功能评价体系的建立
结合本文与已有文献报道可以看出黄芪多糖干预正常小鼠和免疫抑制小鼠后,其相应的免疫器官指数、腹腔巨噬细胞吞噬鸡红细胞功能和外周血T淋巴细胞亚群CD3+、CD4+和CD8+百分含量等均呈现了显著性的变化,且与其他多糖的免疫调控机制有相似之处,阐明了黄芪多糖的免疫调控作用机制。因此,从本文研究指标的敏感性变化规律看,本文研究结果与评价体系可以作为评价多糖类类物质对机体免疫调控的的参考标准与指导。
[1]陈国辉,黄文凤.黄芪的化学成分及药理作用研究进展[J].中国新药杂志,2008,17(17):1482 -1485.
[2]Wang D Y,Hu Y L,Sun J L,et al.Comparative study on adjuvanticity of compound Chinese herbal medicinal ingredients[J].Vaccine,2005,23:3704-3708.
[3]张小梅.黄芪多糖的免疫调节作用及抗肿瘤作用研究进展[J].大连大学学报,2003,6(24):101-104.
[4]陈奇.中药药理研究方法学(第三版)[M].北京:人民卫生出版社,2011,12.
[5]Liu LN,Guo ZW,Zhang Y,etal.Polysaccharide extracted from Rheum tanguticum prevents irradiation-induced immune damage in mice[J].Asian Pac J Cancer Prev,2012,13(4):1401 -1405.
[6]Guo L,Sun YL,Wang AH,etal.Effect of polysaccharides extract of rhizoma atractylodis macrocephalae on thymus,spleen and cardiac indexes,caspase-3 activity ratio,Smac/DIABLO and HtrA2/Omi protein and mRNA expression levels in aged rats[J].Mol Biol Rep.2012,39(10):9285 -9290.
[7]王思芦,汪开毓,赵玲,等.鸡枞菌多糖对免疫抑制小鼠免疫功能的影响[J].中国药理学通报,2013,29(1):59 -63
[8]高旭,李丽芬,刘斌钰.黄芪多糖对小鼠免疫功能影响的实验研究[J].山西大同大学学报,2010,26(4):43 -44
[9]周金星,李升和,宁康健,等.不同剂量党参、淫羊藿提取物对青脚麻鸡脾脏组织结构的影响[J].中国农学通报,2012,28(05):48-52.
[10]乔恩美,孙亚丽,朱杨辉,等.低聚壳聚糖对肉仔鸡生长性能及免疫器官发育的影响[J].安徽科技学院学报,2011,25(2):9-13.
[11]袁从英,车文文,张宁,等.天然植物多糖的研究进展与前景展望[J].中国现代应用药学杂志,2009,26(12):979 -982.
[12]卢新华,何军山,朱湘忠.马齿苋多糖对小鼠免疫功能影响的研究[J].中药药理与临床2006,22(3、4):89 -90.
[13]曾星,李彩霞,黄羽,等.猪苓及猪苓多糖对膀胱癌模型大鼠腹腔巨噬细胞吞噬和表面免疫相关分子表达的影响[J].中国免疫学杂志,2011,27(5):414-418.
[14]Morten H,Karen H,Johannes L,etal.Kinetics and activation requirements of contact-dependent immune suppression by human regulatory T cells[J].J Immunol,2012,18(11):5459 -5466
[15]邱妍,崔保安,胡元亮,等.4种多糖对免疫雏鸡抗体效价和T淋巴细胞的影响[J].南京农业大学学报,2008,31(1):77-81.
[16]邱妍,董发明,胡元亮,等.黄芪多糖对新支二联疫苗免疫雏鸡的免疫调节作用[J].中国预防兽医学报,2011,33(3):232-235.

