酸吸入性肺损伤小鼠模型的建立
郭磊,刘龙丁* ,梅俊杰,2*
(1.中国医学科学院医学生物学研究所,昆明 650118;2.费城儿童医院,美国 费城 19104)
全球每年大约有100万急性肺损伤(acute lung injury,ALI)的患者发展成为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),其死亡率可达到30% ~50%[1]。急性肺损伤的诱因有很多,包括创伤、吸入性损伤、胃酸反流入肺、细菌或呼吸道病毒感染等。在这当中,约11%的临床急性肺损伤患者是由于胃酸反流入肺引起[2]。胃酸反流入肺后,酸性消化液破坏肺泡-毛细血管结构,血液中的白细胞大量浸润入肺泡,形成严重的肺部免疫炎症反应,导致肺水肿和低氧性呼吸功能不全。盐酸灌注小鼠肺部的肺损伤模型能够很好模拟临床胃酸反流入肺的症状,引起典型的肺部严重免疫炎症反应和肺水肿,是当前研究酸吸入性肺损伤常用的实验模型[3]。
小鼠酸吸入性肺损伤模型的建立需要对小鼠气管进行切口后插管,从而灌流一定浓度的盐酸入肺。该方法对小鼠气管和肺泡均造成损伤,严重时即使术后给予呼吸机辅助呼吸小鼠,小鼠也只能存活2~3 h,从而无法对酸吸入肺损伤及修复过程进行长期研究[4]。Das等[5]开发了一种可视小鼠气管插管的实验技术,该技术利用光纤光源介导从小鼠口腔进行气管插管,插管后可直接从小鼠口部灌流入小鼠的气管和肺部,无创伤性,术后小鼠死亡率显著降低[5]。为了建立一个对酸吸入肺损伤及修复过程进行研究的小鼠模型,本研究利用口腔气管插管的方法,将盐酸导入小鼠右侧肺部,在提高小鼠术后存活率的同时可以对小鼠肺损伤及修复过程免疫机理进行长期研究。
1 材料与方法
1.1 实验动物及主要材料
SPF级C57BL/6小鼠,8~10周龄,雌性,体重22~25 g。由中国医学科学院医学生物学研究所实验动物中心提供【SCXK(滇)2010-0003】,相关动物实验均在中国医学科学院医学生物学研究所SPF级动物实验室进行无菌操作【SYXK(滇)2010-0007】。小鼠随机分为气管插管盐酸实验组和气管插管生理盐水对照组,各组小鼠分配如下:小鼠存活率检测使用15只、肺功能分析6只、肺盥洗液炎性因子检测6只、病理学检查3只,两组共计使用60只小鼠。分析纯盐酸(HCL)购自重庆川东化工集团有限公司,工作浓度为0.9%生理盐水稀释至0.1 mol/L(pH 1.5)。静脉套管(规格20)购自美国BD公司。0.5 mm光纤购自美国Edmund Optics公司。光源盒(型号NCL-150)购自美国Volpi公司。小鼠脉搏血氧仪MouseOx购自美国Starr公司。小鼠肺功能仪flexiVent购自美国Scireq公司。小鼠细胞因子 TNF-α (MTA00B)、IL-6(M6000B)、MIP-2(DY452)和KC(MKC00B)ELISA检测试剂盒购自美国R&D Systems公司。
1.2 口腔气管插管盐酸灌流小鼠模型建立
口腔气管插管方法按照 Das等[5]可视插管技术改进而来。具体来说,无菌插管(静脉套管)套在光纤末端,光纤另一端接通光源。ketamine(125 μg/g)和xylazine(12.5 μg/g)腹腔注射麻醉后的小鼠,通过门牙固定垂直挂立在操作平台上。随后用手温和的将其舌头拉出,暴露出口腔及气管开口。利用光纤光源的引导,将插管由上至下小心插入气管,随后缓慢抽出光纤而插管留置在小鼠气管内。进入气管的插管连接5 mL注射器,轻缓抽吸,通过观察小鼠胸腔扩张确定插管准确插入小鼠气管。
盐酸(HCL)灌流:插管后的小鼠放置为45°右侧卧体位,配合手指按压其胸腔左侧肺部,用1 mL注射器将0.1 mol/L pH 1.5的HCL(按2.5 μL/g重量给剂量)连接插管后缓缓推入小鼠气管和肺部。注射后保持小鼠侧卧体位1 mim,尽量使酸液流入小鼠右侧肺叶。
盐酸灌流后的小鼠放入小型恒温观察室,并给予供氧4 h直至麻醉消退。小鼠在盐酸灌流后的1~3 d极其虚弱,取食困难,按每只0.8 mL/d腹腔注射给予D-(+)-吡喃葡萄糖营养液。
1.3 肺损伤小鼠生理指标检测
1.3.1 肺功能检测
(1)肺湿干重比:酸吸入后24 h,断颈处死小鼠开胸取其肺组织称湿重,随后用电热恒温干燥箱60℃下烘干,24 h后称干重,计算肺湿/干重比。
(2)肺回弹性:麻醉后小鼠进行气管插管,插管后将其套管连接到flexiVent肺功能仪上进行监测(术后1~8 d),记录肺回弹性指标并进行统计学处理。
(3)动脉血氧饱和度:利用无创体外MouseOx脉搏血氧仪系统,在小鼠颈部放置电极以获得动脉血氧饱和度数值,各实验组(n=6)数据进行统计学处理。
1.3.2 肺部病理检测
小鼠肺组织(酸吸入后24 h)用4%多聚甲醛充盈后浸泡于多聚甲醛中固定,48 h后进行石蜡包埋、切片(冠状切5 μm厚度)。苏木素-伊红(H&E)染色,光镜下观察肺组织形态学改变。
1.3.3 肺盥洗液白细胞计数及细胞因子检测
肺泡盥洗液:术后24 h对小鼠气管进行插管并结扎固定,随之用0.8 mL无菌生理盐水冲洗肺部5次,收集盥洗液置于4℃保存。肺盥洗液细胞计数:肺盥洗液用ACK buffer裂解红细胞后利用细胞计数板对白细胞计数。随后cytospin对肺盥洗液细胞进行涂片离心,Diff-Quick染色法细胞染色后计数白细胞中巨噬细胞和嗜中性粒细胞的数量。细胞因子检测:肺盥洗液细胞离心后(1500 g,3 min)取上清进行 ELISA 测定细胞因子 TNF-α、IL-6、MIP-2 和 KC的含量。蛋白浓度测定:肺盥洗液离心上清利用BCA法测定总蛋白含量。
1.4 统计学处理
2 结果
2.1 盐酸灌流鼠肺模型的建立
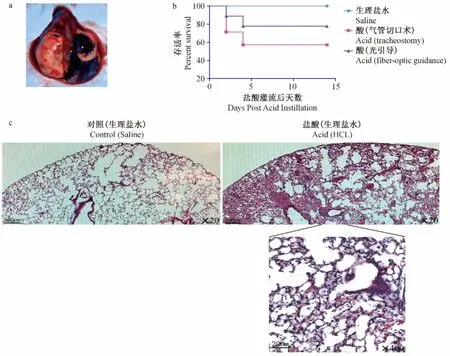
注:a:亚甲基蓝灌流小鼠肺叶;b:盐酸灌流小鼠术后存活率(生理盐水对照组、气管切口盐酸组和光纤介导盐酸组,n=15);c:组织学检查盐酸和生理盐水灌流鼠肺(H&E染色,×20/×400)图1 盐酸灌流小鼠肺部模型的建立Note:a:Methylene blue instillation of a mouse lung;b:Survival of acid instillation mice(saline control group,tracheostomy group and fiber-optic guidance group,n=15);c:Histological examination of HCl and saline instillation mouse lung(H&E staining,×20/×400)Fig.1 Establish of HCl instillation mouse lung injury model
为了减少手术对小鼠的伤害,降低术后死亡率,实验一方面采用无创伤口腔插管技术对小鼠气管进行插管,另一方面利用重力作用和挤压左肺的方法将盐酸主要导入小鼠右肺肺叶,以减少小鼠肺负担。亚甲基蓝染料模拟盐酸灌流小鼠肺部显示,染料大部分流入到了小鼠右侧肺部,将右侧肺叶染成蓝色(图1a)。对术后小鼠存活率的分析表明,利用实验所采用的盐酸灌流方法,其存活率达到约80%,显著高于常规气管切口插管盐酸灌流小鼠的存活率(图1b)。酸吸入后肺组织切片检查揭示(图1c),与对照生理盐水吸入小鼠相比,酸吸入后导致小鼠肺泡结构瓦解,透明膜形成,肺泡间质肿胀,富含蛋白的液体进入肺泡腔,形成肺水肿。此外,肺叶出血,免疫炎性细胞侵润入肺泡并聚集在间质空间,造成局部炎症反应。上述结果表明,在保证肺损伤建立的前提下,实验所采用的盐酸灌流方法极大提高了小鼠的术后存活率。
2.2 肺功能分析
对肺的湿重与干重比指标的分析发现,酸吸入后24 h,小鼠湿干重比与对照组相比明显增加(图2a),表明酸吸入后导致小鼠肺部出现肺水肿。对术后小鼠肺功能的连续监测发现,酸吸入后小鼠肺回弹性激增(图2b),揭示肺水肿的形成导致肺回弹阻力增大,肺收缩功能受到影响。随着时间的推移肺回弹性逐渐回落,揭示急性肺损伤的一个恢复过程。肺功能的削弱也直接导致小鼠动脉氧含量的降低,从术后小鼠动脉血氧饱和度的分析来看,术后第一天氧饱和度下降至75%左右,随着肺损伤的恢复氧饱和度逐渐回升,到术后第9天接近于90%(图2c)。通过上述肺功能指标的分析表明,盐酸的吸入导致小鼠肺部肺水肿及肺功能受损,术后一周后逐渐恢复。
2.3 肺部炎症反应分析
酸吸入导致肺泡结构遭到破坏,病理切片可见炎性细胞浸润入肺泡造成急性肺部免疫炎症反应(图1c)。对肺泡盥洗液中的白细胞计数表明酸吸入后大量白细胞进入到肺泡内(图3a)。进一步对肺泡内白细胞染色后计数发现,进入肺泡中的免疫细胞主要为嗜中性粒细胞(图3a),大量的嗜中性粒细胞引发了肺部炎症反应。对肺泡盥洗液中的蛋白含量及细胞因子检测发现,酸吸入后导致肺泡液总蛋白含量升高(图3b),其中ELISA检测表明,肺泡液中 TNF-α、IL-6、KC(CXCL-1)和 MIP-2(CXCL-2)等细胞免疫炎症因子含量均显著升高(图3b)。上述结果证实了酸吸入所致小鼠肺部严重的免疫炎症反应。
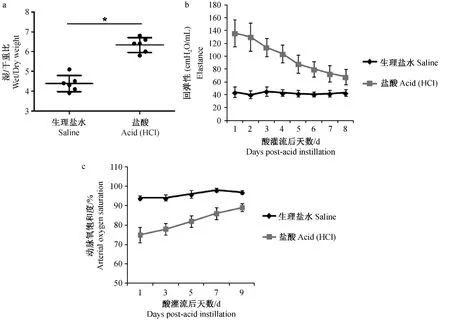
注:a:盐酸和生理盐水灌流小鼠肺湿/干重比(mean±SD,n=6);b:盐酸灌流小鼠术后肺回弹性(mean±SD,n=6);c:盐酸灌流小鼠术后动脉血氧饱和度(mean±SD,n=6)。图2 盐酸灌流小鼠肺生理指标监测Note.a:Wet/dry ratio of mouse lung after HCl or saline instillation(mean±SD,n=6);b:Lung elastance after HCl instillation(mean±SD,n=6);c:Arterial oxygen saturation after HCl instillation(mean±SD,n=6).Fig.2 Monitoring of lung function in the mice after HCl instillation
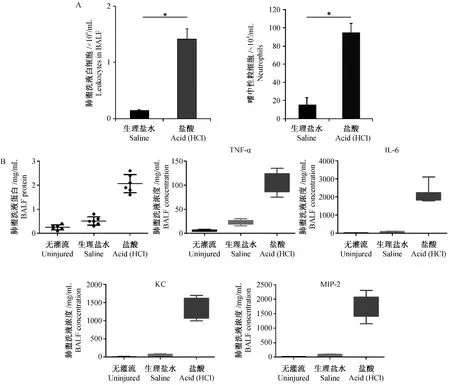
注:A:小鼠肺盥洗液白细胞(图左)和嗜中性粒细胞计数(图右)(mean±SD,n=6);B:小鼠肺盥洗液总蛋白含量及TNF-α、IL-6、KC和MIP-2 含量测定(mean±SD,n=6)。图3 小鼠肺盥洗液分析Note.A:Counting of leukocytes and neutrophils in BALF(mean ±SD,n=6);B:Quantitation of BALF total proteins and cytokines(TNF-α,IL-6,KC,MIP-2)(mean ± SD,n=6).Fig.3 Analysis of the mouse bronchoalveolar lavage fluid(BALF)
3 讨论
酸性物质误吸入肺导致肺损伤多见于手术后麻醉恢复过程和重症监护意识不清醒的病人胃消化液反流入肺,引发肺炎及呼吸功能抑制,是术后高风险并发症之一[6-8]。胃消化液中的低pH胃酸是对肺泡上皮细胞的主要伤害,盐酸作为胃酸的主要成分,进入肺泡后破坏肺泡上皮细胞并损伤血管内皮细胞,导致炎性细胞侵润入肺部致炎症反应,肺功能受损[9-11]。利用盐酸灌流鼠肺能够很好模拟胃酸反流入肺引发的炎症损伤和肺功能不全[9,12],是目前研究酸所致肺损伤的动物模型。
酸吸入小鼠模型的建立通常采用气管插管后灌流一定浓度的低pH的盐酸(通常为1.5)进入小鼠肺部[3,4,13-16]。灌流盐酸浓度既需要能够引起炎症损伤又要防止体积或浓度过大导致小鼠死亡。实验过程中需要对小鼠气管进行切口后插管,术后缝合。由于气管处创伤的存在导致术后长期观测过程中伤口易感染,伤口引发的炎症反应也会对小鼠肺部炎症损伤的评估有一定干扰。我们采用一种可视化无创伤的口腔气管插管技术[5]对小鼠进行插管,同时灌流时改变小鼠的体位使盐酸经气管主要进入到小鼠右侧肺叶中,保证小鼠左肺功能运转。我们的结果表明,采取这样的手段有效降低了手术的风险,提高了术后小鼠的存活率。此外,运用这样的建模方法可以最大限度提高灌流盐酸的体积和浓度达到2.5 μL/g 0.1 mol/L。在该浓度条件下,病理检测和肺功能分析表明小鼠右肺出现典型免疫炎症反应和肺损伤。
急性肺损伤主要是一个免疫损伤的过程,肺泡上皮细胞和毛细血管内皮细胞凋亡或坏死,导致肺泡-毛细血管屏障打破,肺泡基底膜通透性增加,大量嗜中性粒细胞从毛细血管进入到肺泡中。破损的I型和II型肺泡上皮细胞释放细胞炎性因子诸如IL-1、6、8 和 TNF-α,激活嗜中性粒细胞和巨噬细胞诱发免疫炎症反应[17-20]。我们从肺损伤小鼠肺盥洗液中检测到了大量白细胞,包含巨噬细胞和嗜中性粒细胞,其中嗜中性粒细胞的比例显著增加,表明嗜中性粒细胞在肺部炎症反应中的一个主要作用。此外,在肺盥洗液中还检测到不同浓度的TNF-α、IL-6 和趋化因子 CXCL-1(KC)、CXCL-2(MIP-2)等炎性因子,这些因子均为嗜中性粒细胞的效应分子,进一步证明嗜中性粒细胞在肺炎性损伤中的重要作用。
单纯利用盐酸灌流并不能全面反映酸性消化液混杂消化后食物残渣及细菌物质的胃酸反流入肺的情况,然而采用胃消化液进行肺灌流需要对胃消化物进行高压过滤无菌处理后灌流[21-23],灭活后的胃消化液主要刺激成分仍为盐酸。盐酸吸入肺损伤小鼠模型很好反映了肺损伤后肺部免疫炎症进程,我们建立的模型表明嗜中性粒细胞在肺炎性损伤中的重要作用,为进一步研究肺部免疫炎症机理提供了平台。
[1]Frutos-Vivar F,Ferguson ND,Esteban A.Epidemiology of acute lung injury and acute respiratory distress syndrome [J].Semin Respir Crit Care Med,2006,27:327-336.
[2]Rubenfeld GD,Caldwell E,Peabody E,et al.Incidence and outcomes of acute lung injury[J].N Engl J Med.2005,353:1685-1693.
[3]Matute-Bello G,Frevert CW,Martin TR.Animal models of acute lung injury [J].Am J Physiol Lung Cell Mol Physiol,2008,295:379-399.
[4]Zarbock A,Singbartl K,Ley K.Complete reversal of acid-induced acute lung injury by blocking of platelet-neutrophil aggregation[J].J Clin Invest,2006,116:3211 -3219.
[5]Das S,MacDonald K,Chang HYS,et al.A simple method of mouse lung intubation[J].J Vis Exp,2013,21(73):e50318.
[6]Doyle RL,Szaflarski N,Modin GW,et al.Identification of patients with acute lung injury.Predictors of mortality[J].Am J Respir Crit Care Med,1995,152:1818-1824.
[7]Hudson LD,Milberg JA,Anardi D,et al.Clinical risks for development of the acute respiratory distress syndrome [J].Am J Respir Crit Care Med,1995,151:293-301.
[8]Neelakanta G,Chikyarappa A.A review of patients with pulmonary aspiration of gastric contents during anesthesia reported to the Departmental Quality Assurance Committee [J].J Clin Anesth,2006,18:102-107.
[9]Tsushima K,King LS,Aggarwal NR,et al.Acute lung injury review[J].Inter Med,2009,48:621-630.
[10]Ware LB.Pathophysiology of acute lung injury and the acute respiratory distress syndrome [J].Semin Respir Crit Care Med,2006,27:337-349.
[11]Manicone AM.Role of the pulmonary epithelium and inflammatory signals in acute lung injury [J].Expert Rev Clin Immunol,2009,5:63-75.
[12]Reiss LK,Uhlig U,Uhlig S.Models and mechanisms of acute lung injury caused by direct insults[J].Eur J Cell Biol,2012,91:590-601.
[13]Segal BH,Davidson BA,Hutson AD,et al.Acid aspiration-induced lung inflammation and injury are exacerbated in NADPH oxidase-deficient mice[J].Am J Physiol Lung Cell Mol Physiol,2007,292:760-768.
[14]Favarin DC,Teixeira MM,Andrade ELD,et al.Anti-inflammatory effects of ellagic acid on acute lung injury induced by acid in mice[J].Mediators Inflamm,2013,2013:164202.
[15]陈石,张德平.酸吸入致大鼠肺纤维化初步探索[J].中国实验动物学报,2010,18(4):335-340.
[16]王鑫渊,陈丽,张莉,等.卡托普利对酸吸入所致急性肺损伤的影响[J].麻醉与镇痛,2013,10(7):110-111.
[17]Grommes J,Soehnlein O.Contribution of neutrophils to acute lung injury[J].Mol Med,2011,17:293 -307.
[18]Williams AE,Chambers RC.The mercurial nature of neutrophils:still an enigma in ARDS?[J].Am J Physiol Lung Cell Mol Physiol,2014,306:217 -230.
[19]Singh NR,Johnson A,Peters AM,et al.Acute lung injury results from failure of neutrophil de-priming:a new hypothesis[J].Eur J Clin Invest,2012,42:1342 -1349.
[20]Herold S,Gabrielli NM,Vadasz I.Novel concepts of acute lung injury and alveolar-capillary barrier dysfunction [J].Am J Physiol Lung Cell Mol Physiol,2013,305:665-681.
[21]Nemzek JA,Abatan O,Fry C,et al.Function contribution of CXCR2 to lung injury after aspiration of acid and gastric particulates[J].Am J Physiol Lung Cell Mol Physiol,2010,298:382-391.
[22]Hutson AD,Davidson BA,Raghavendran K,et al.Statistical prediction of the type of gastric aspiration lung injury based on early cytokine/chemokine profiles[J].Anesthesiology,2006,104:73-79,2006.
[23]Knight PR,Davidson BA,Nader ND,et al.Progressive,severe lung injury secondary to the interaction of insults in gastric aspiration[J].Exp Lung Res,2004,30:535 -557.

