中药材中黄曲霉毒素 B1,B2,G1,G2 测定方法研究
李 浩
(广西壮族自治区食品药品检验所,广西 南宁 530021)
黄曲霉毒素是一种对人和动物均有极强毒性的剧毒物质,世界卫生组织(WHO)早在1993年就将其划定为Ⅰ类致癌物[1],可诱发各种癌症[2-3],也是一组化学结构类似的二呋喃香豆素的衍生化合物,主要由黄曲霉、寄生曲霉等产生,目前已鉴定且明确结构的约有 17 种成分,最常见的有黄曲霉毒素 B1,B2,G1,G2,其中黄曲霉毒素B1含量最多,且毒性和致癌性均最强。近年来,黄曲
霉毒素污染广泛存在于中药生产、贮存、运输过程中的各个环节,故对中药材中黄曲霉毒素含量进行准确测定,对于保障用药安全有极其重要的意义[4-5]。目前,黄曲霉毒素常用的检测方法有高效液相色谱(HPLC)法、酶联免疫化学分析法、薄层色谱法、微柱筛选法、液-质谱联用法等[6-11]。本研究中采用免疫亲和柱净化-高效液相色谱分离-串联三重四级杆质谱(HPLC-MS/MS)法测定中药材中的黄曲霉毒素 B1,B2,G1,G2,以探讨检测黄曲霉毒素更好的方法。
1 仪器与试药
安捷伦1200型高效液相色谱仪,配6410型三重四级杆串联质谱仪配有电喷雾离子化源(ESI源,美国安捷伦公司),数据由Masshunter工作站采集和分析;AE 240型十万分之一电子分析天平(瑞士Mettler公司);旋转振荡器(江苏太仓市实验设备厂);Z2064型离心机(德国Hermle公司);Milli-Q超纯水处理系统;黄曲霉总量(B1,B2,G1,G2)免疫亲和层析柱(北京华安麦科生物技术有限公司)。黄曲霉毒素混合标准品(黄曲霉毒素B1,B2,G1,G2,美国 Supelco 公司提供,编号 Lot:LB62461);甲醇、乙腈均为色谱纯,美国J.T.Baker提供;乙酸铵为色谱纯,由美国Sigma公司提供;水为高纯水;药材样品均由本所购买。
2 方法与结果
2.1 色谱条件及质谱条件
色谱条件:色谱柱为Agilent XDB-C18柱(50 mm×4.6 mm,1.8 μm);流动相为甲醇 -乙腈(3 ∶2)-0.1 mmol/L 乙酸铵,梯度洗脱条件见表1;流速为0.3mL/min;柱温为30℃;进样量为10μL;分析时间为10 min。
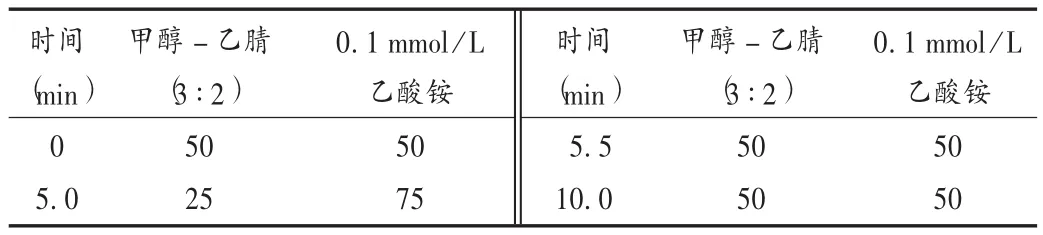
表1 流动相梯度洗脱条件
质谱条件:ESI离子源;扫描方式:正离子多反应监测(MRM)模式;喷雾器40 psi;喷雾电压4.0 kV;干燥气温度350℃;干燥气流速(N2)9 mL/min。为保护离子源,采用了分段扫描。质谱参数见表2,质谱图见图1。

表2 黄曲霉毒素B1,B2,G1,G2检测离子对及相关参数
2.2 测定方法
精密量取黄曲霉毒素混合标准品0.5mL,用甲醇稀释至10mL,制成混合对照品贮备液。精密量取贮备液1 mL,置50 mL容量瓶中,加70%甲醇稀释至50 mL,制成混合对照品溶液。取中药材供试品粗粉末(约5 g),加入50 mL 70%甲醇溶液,震荡混匀20 min,然后以2 500 r/min的速率离心5 min,精密量取5 mL上清液于25 mL容量瓶中,用磷酸盐缓冲液(PBS)稀释至刻度,取经微孔滤膜(0.45 μm)的续滤液 20 mL,在 3 mL /min 的流速下通过免疫亲合层析柱,加入超纯水20 mL分2次淋洗亲和层析柱;准确加入1.5 mL甲醇,分次洗脱免疫层析柱,洗脱液以超纯水稀释至2 mL,即得供试品溶液。精密吸取混合对照品溶液、供试品溶液各10 μL,注入液相色谱 - 串联质谱(LC-MS /MS)仪进行测定,记录色谱图,通过计算、分析后即得。
2.3 方法学考察
检测限与定量限确定:将混合对照品溶液适当倍比稀释后,进样分析,以信噪比 S/N=3∶1,10∶1分别确定定量限与检测限。以黄曲霉毒素B1计,检测限与定量限见表3。
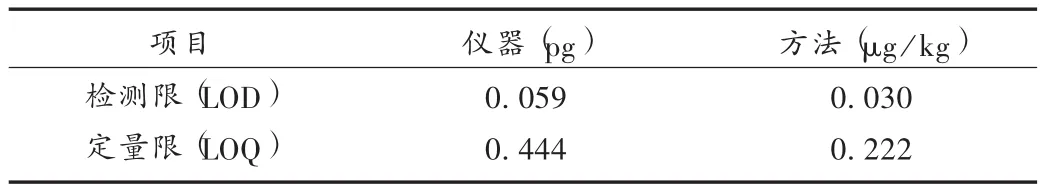
表3 检测限与定量限确定
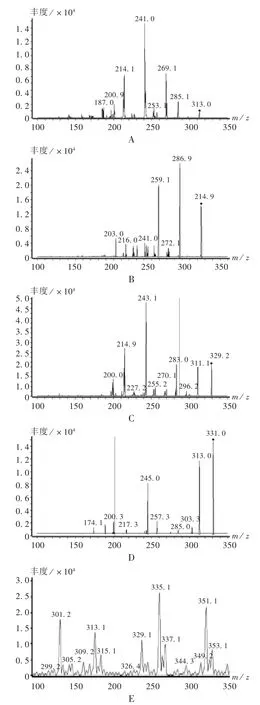
图 1 黄曲霉毒素 B1(A),B2(B),G1(C),G2(D)的二级全扫描质谱图及MRM总离子流图(E)
线性关系考察:将混合对照品溶液适当倍比稀释后,进样分析,测定峰面积积分值,回归分析后得相应标准曲线,见表4。结果表明,黄曲霉毒素G2和B2进样量在0.3~30 pg、黄曲霉毒素G1和B1进样量在1~100 pg范围内与峰面积积分值呈良好线性关系(r>0.999 0)。
精密度试验:取同一混合对照品溶液,按拟订色谱条件连续进样6次,测定各色谱峰的峰面积值,计算相对标准偏差(RSD)。结果黄曲霉毒素 B1,B2,G1,G2的 RSD 分别为 2.95% ,4.51% ,6.25%,5.42%(n =6),表明仪器精密度良好。

表4 黄曲霉毒素B1,B2,G1,G2线性关系考察结果
回收率试验:添加以黄曲霉毒素 B1计为 10,2,0.5 μg /kg 的高、中、低3个质量浓度溶液。取中药供试品粗粉末5 g,各加入混合对照品贮备液(黄曲霉毒素 B1含量为 50 ng /mL)5.00,1.00,0.25 mL,分别加70%甲醇溶液至50 mL,按拟订方法制备供试品溶液,然后按拟订色谱条件进样测定。结果见表5。
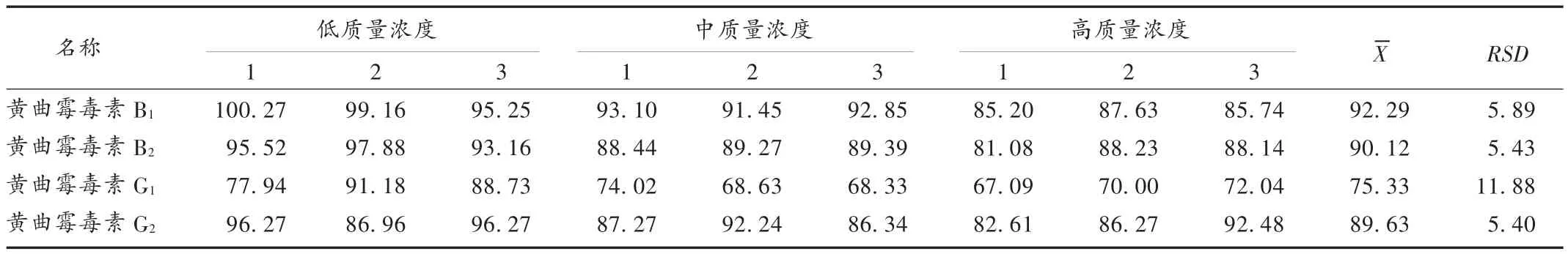
表 5 黄曲霉毒素 B1,B2,G1,G2加样回收试验结果(n=9,%)
2.4 样品含量测定
按所建立的方法分别对生槟榔、生麦芽、炒槟榔、红花、炒牛蒡子、川牛膝、化橘红、柏子仁进行了黄曲霉毒素残留测定,结果见表6。
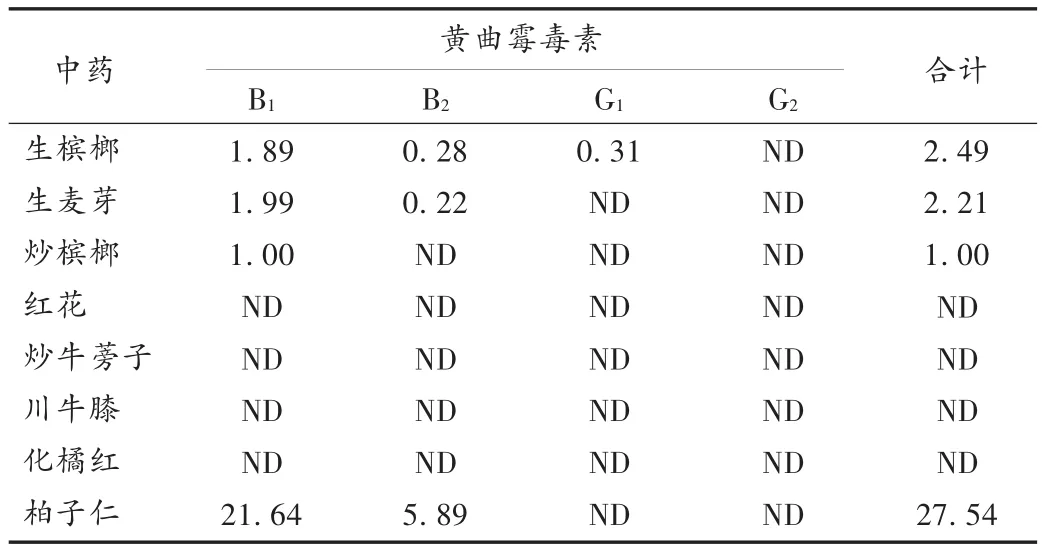
表6 样品含量测定结果(μg/kg)
3 讨论
按照免疫亲和柱-HPLC法制备供试品溶液时,最后的洗脱溶剂为甲醇,直接进样时,峰形较差。需将供试品溶液转化为流动相溶解才能改善峰形。故拟将供试品溶液在50℃下用氮气吹干,再用流动相进行定容。
样品前处理方法如使用含吐温的PBS进行淋洗,因吐温为表面活性剂,对质谱的离子化效率有影响,并且污染离子源,降低仪器的灵敏度。故样品前处理时对溶剂选择应加以考虑。
考虑到供试品基质的复杂多样性,减少杂质对待测组分的干扰,提高方法的适用性,通过更换不同类型色谱柱、调整流动相等进一步优化色谱分离条件,能在快速分析的同时提高分离度,避免杂质的干扰。
以目前的分析方法,黄曲霉毒素4个组分G2,G1,B2,B1的检测限分别为 0.06,0.08,0.04,0.04 μg /kg,灵敏度优于 HPLC 法,已能满足目前的分析需要。
由于LC-MS/MS系统检测方法的通用性,可考虑目前建立的MS系统对其他主要真菌毒素的检测扩展,如赭曲霉毒素等[12]。
黄曲霉毒素的前处理方法采用的净化方式有免疫亲和柱净化[2]、Mycosep 多功能净化柱[3]等。LC-MS /MS 系统由于其检测方法的通用性,在同一系统扩展检测毒素种类,则需考虑前处理方法的通用性,包括提取、净化方式等。
HPLC-MS/MS法可适用于较复杂基质样品中的多组分、低含量残留测定。与酶联免疫吸附法(ELISA),气相色谱法(GC),HPLC法等传统方法比较,HPLC-MS/MS法具有速度快、灵敏度高、选择性强、分析周期短、适用范围广、重复性好等优点[13-14],是霉菌毒素检测的最佳确认方法。
参考文献:
[1]Inernational Agency for Research on Cancer(IARC).Some naturally occurring substances:Food items and constituents,heterocyclic aromatic amines and mycotoxins[R].Lyon:IARC Monographs on the Evaluation of Carcinogenic Risks to Humans,1993(56):245-395.
[2]李书国,陈 辉,李雪梅,等.粮油食品中黄曲霉毒素检测方法综述[J].粮油食品科技,2009,17(2):62-65.
[3]孙秀兰,汪忠云,方银军,等.溶胶凝胶法固定抗体制备黄曲霉毒素免疫传感器[J].分析化学,2010,38(2):245-248.
[4]蔡 飞,高微微,李红玲,等.中药上黄曲霉毒素的污染现状与防除技术[J].中国中药杂志,2010,35(19):2 503-2 507.
[5]黄 莉,张 浩,丁伟琴,等.中药中真菌毒素污染问题[J].海峡药学,2009,21(6):95-99.
[6]Mahoney N,Molyneux RJ.Rapid analytical method for the determination of aflatoxins in plantderived dietery supplement and cosmetic oils[J].J Agric Food Chem,2010,58(7):4 065-4 070.
[7]Khayoon WS,Saad B,Yan CB,et al.Determination of aflatoxins in animal feeds by HPLC with multifunctional column clean-up[J].Food Chem,2010,118(3):882-886.
[8]许菲菲,刘亚丽,田富饶.黄曲霉毒素检测方法研究[J].化学分析计量,2010,19(5):93-94.
[9]王黎丽,周 坚.免疫学法检测黄曲霉毒素的研究进展[J].食品工业,2012,35(2):121-124.
[10]Cervino C,Asam S,Knopp D,et al.Use of isotopelabeled aflatoxinsfor LC-MS /MS stable isotope dilution analysis of foods[J].J Agric Food Chem,2008,56(6):1 873-1 879.
[11]Rasmussen RR,Stormi MLD,Rasmussen PH,et al.Multimycotoxin analysis of maize silage by LC-MS /MS[J].Anal Bioanal Chem,2010,397(2):765-776.
[12]赵孔祥,胡筱芸,何 佳,等.免疫亲和净化-液相色谱-串联质谱测定中成药中 14 个真菌毒素 [J].药物分析杂志,2012,32(5):846-851.
[13]栗建明,李 纯,顾利红,等.快速液相色谱-串联质谱法测定果实类药材中的黄曲霉毒素[J].中国药学杂志,2012,47(1):65-68.
[14]郑润生,徐 晖,王文丽,等 .苦杏仁中黄曲霉毒素 B1,B2,G1,G2的液质联用检测分析[J].中国中药杂志,2013,38(20):3 534-3 538.

