PJ34对肺腺癌顺铂耐药细胞增殖及耐药性的影响
姚圆圆,郝吉庆
(安徽医科大学第一附属医院肿瘤内科,安徽合肥 230022)
PJ34对肺腺癌顺铂耐药细胞增殖及耐药性的影响
姚圆圆,郝吉庆
(安徽医科大学第一附属医院肿瘤内科,安徽合肥230022)
摘要:目的探讨第3代选择性PARP-1抑制剂PJ34对肺腺癌顺铂耐药细胞株A549/DDP生长活性及耐药性的影响。方法使用不同浓度梯度的顺铂(DDP)、PJ34单药或联合作用于A549/DDP细胞,MTT法检测各药物对细胞的增殖抑制率;流式细胞术检测细胞凋亡率; Western blot检测细胞内PARP-1蛋白、MDR相关蛋白(LRP、GST-π)的表达水平。结果PJ34单药对A549/DDP细胞有明显的抑制作用,无毒剂量的PJ34可明显增强A549/DDP细胞对顺铂的敏感性,诱导细胞凋亡,使细胞内PARP-1蛋白、MDR相关蛋白(LRP、GST-π)的表达水平明显降低。结论A549/DDP细胞的顺铂耐药性与细胞内PARP-1蛋白的过度表达有关,PJ34有明显的顺铂增敏作用,能部分逆转A549/DDP细胞对顺铂的耐药性,其机制可能与诱导细胞凋亡,降低细胞内LRP、GST-π的蛋白表达水平有关。
关键词:肺腺癌;聚腺苷二磷酸核糖聚合酶-1抑制剂;顺铂;耐药性;凋亡;机制
聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)是一种广泛存在于真核细胞核中的蛋白质翻译后修饰酶,PARP-1是其主要成员,发挥着90%以上的功能,在DNA损伤修复、基因组完整性的维持、细胞死亡、有丝分裂中纺锤体的形成等过程中发挥关键作用[1-3]。国内外学者们对PARP-1抑制剂在恶性肿瘤治疗中的作用进行了长期大量的探索和研究。目前,PARP-1抑制剂已发展到第3代,其选择性、活性更高,并且很多已进入临床试验阶段,被认为是一种新型有效的抗肿瘤药物。PARP-1抑制剂在乳腺癌、卵巢癌等恶性肿瘤中的体内外Ⅲ期临床试验中均取得了良好的疗效[4-5],但在肺癌中的研究仍较少。目前研究发现,肺癌的发病率及死亡率均位居全球恶性肿瘤之首,在我国更是威胁人类生命健康的最大杀手。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌发病率的75%~80%,绝大多数(80%)确诊时已属晚期,失去手术机会,化学治疗成为晚期NSCLC的主要治疗方法。顺铂(cisplatin,DDP)是临床上最常用的细胞周期非特异性抗肿瘤药物,主要作用靶点是DNA,通过在细胞内形成铂-DNA加合物抑制DNA的复制和转录,目前以DDP为基础的联合化疗仍是国际上公认的晚期NSCLC的标准一线化疗方案。然而,绝大多数患者在DDP用药过程中会逐步产生耐药现象,导致肿瘤复发及治疗失败。这成为当前困扰肺癌治疗的一大难题。肺癌的DDP耐药机制是一个多因素参与的复杂过程[6],至今仍未明确。因此,探索肺癌DDP耐药机制的决定因素、寻求耐药逆转剂来克服耐药现象成为当前临床治疗肺癌急需解决的问题。
本研究拟探讨第3代PARP-1抑制剂PJ34对肺癌A549/DDP细胞耐药性的影响,初步探究其可能的作用机制,为PARP-1抑制剂应用于肺癌DDP耐药的临床治疗提供一定的依据。
1 材料与方法
1.1材料
1.1.1细胞株A549/DDP细胞株购自上海瑞鹿生物科技有限公司,A549细胞株由安徽医科大学第一附属医院中心实验室惠赠,均培养于37℃、5% CO2的培养箱中,隔天换液,细胞长满80%~90%即可传代。A549/DDP细胞培养液中加入终浓度为2 mg·L-1的顺铂以维持耐药表型。
1.1.2药品与试剂RPMI 1640培养基购自美国Hyclone公司,PJ34、胎牛血清、MTT粉末均购自美国Sigma公司,顺铂注射液购自山东齐鲁制药厂,Annecxin V-FITC/PI细胞凋亡检测试剂盒购自上海贝博生物公司,兔抗人PARP-1单克隆抗体购自Abcam公司,鼠抗人LRP单克隆抗体购自Santa Cruz公司,鼠抗人GST-π单克隆抗体购自Bioworld公司,ECL发光试剂盒购自Thermo公司。
1.1.3主要仪器设备细胞培养箱购自美国THERMO公司,倒置显微镜购自日本Olympus公司,超净工作台购自苏州净化,低速离心机购自德国Eppendorf,流式细胞仪购自美国Beckman公司,EPS300型电泳仪、VE-186型转膜仪均购自Tanon公司。
1.2方法
1.2.1MTT法检测DDP及PJ34单药对A549/DDP细胞增殖的影响将对数生长期的细胞以5 000 个/孔接种于96孔板,分别设空白对照组、细胞对照组及药物处理组,培养于37℃、5% CO2的培养箱中,次日上午分别按DDP(10、20、30、40、50 mg· L-1)、PJ34(3、6、12、24、48、96 mg·L-1)梯度加药。继续培养48 h,每孔加入MTT溶液(5 g·L-1) 20 μL,再继续培养4 h,小心弃去孔中液体,加入二甲基亚砜(DMSO) 150 μL,自动酶标仪测定490 nm波长处每孔吸光度(A值),并计算抑制率。抑制率/%=[1-(处理组平均A值-空白对照组平均A值)/(细胞对照组平均A值-空白对照组平均A 值)]×100%。最后用SPSS 19.0软件计算各药物的半数抑制浓度IC50。实验重复3次。
1.2.2MTT法检测PJ34联合DDP对A549/DDP细胞增殖的影响将对数期的细胞接种于96孔板,37℃、5%CO2的培养箱中继续培养,次日上午加入无毒剂量的PJ34(3 mg·L-1)与不同浓度DDP(10、20、30、40、50 mg·L-1)联合作用48 h,加入MTT溶液20 μL,继续培养4 h,弃上清,加入DMSO 150 μL,自动酶标仪测定490nm波长处每孔吸光度(A 值),并计算抑制率。SPSS软件计算两药联合时DDP的IC50,并计算PJ34对DDP的逆转倍数(RF)及相对逆转率(RRR%)。
RF>1表示逆转剂PJ34能增强DDP的作用,RF=1表示两药无交互作用,RF<1表示拮抗作用,RF越大,说明逆转效果越好。RRR%≥100%,表示完全逆转作用; RRR%<100%,表示部分逆转作用。
1.2.3Annexin V-FITC/PI双染法检测细胞凋亡分别设对照组、PJ34单药组(3 mg·L-1)、DDP单药组(12 mg·L-1)及联合用药组(PJ34 3 mg·L-1+ DDP12 mg·L-1)。药物处理48 h后,根据试剂盒说明收集细胞,用400 μL Annexin V-FITC结合液重悬,加入5 μL Annexin V染色15 min,再加入10 μL PI染色5 min。1 h内流式细胞仪上机检测。散点图左下象限散点显示活细胞,右上象限散点显示早期凋亡细胞,右下象限散点显示晚期凋亡及坏死细胞,左上象限散点显示机械损伤细胞。
1.2.4Western blot法检测蛋白表达取对数期A549亲本株及A549/DDP耐药株接种于培养瓶内,分别设A549组、A549/DDP组、PJ34处理组(3 mg ·L-1)、DDP处理组(12 mg·L-1)及联合用药组(PJ34 3 mg·L-1+ DDP 12 mg·L-1)。药物处理48 h后,弃上清,裂解细胞提取蛋白,-80℃保存。反复冻融3次后,BCA法进行蛋白定量。配制SDSPAGE凝胶,取等量的蛋白质样本进行上样分离并转移至PVDF膜上,封闭。加入相应一抗,4℃孵育过夜。TBST洗膜,加入二抗室温孵育2 h,洗膜。ECL试剂盒显色,X胶片曝光。
1.2.5统计学处理采用SPSS 19.0统计软件对数据进行处理。实验数据用±s表示。两组以上的数据比较采用方差分析,两组间数据比较采用t检验。
2 结果
2.1A549/DDP耐药株与A549敏感株对DDP的敏感性A549/DDP细胞对DDP的耐药性明显高于A549细胞。DDP单药处理48 h后的IC50分别为: A549敏感株(2.49±0.39) mg·L-1,A549/DDP耐药细胞(26.14±0.62) mg·L-1,与敏感株相比,耐药倍数为10.5倍(Tab 1)。
Tab 1 Sensitization of A549 and A549/DDP cells to DDP(珋±s,n=3)

Tab 1 Sensitization of A549 and A549/DDP cells to DDP(珋±s,n=3)
DDP/mg·L-1 A549/% DDP/mg·L-1A549/DDP/% 0.625 14.88±1.67 10 19.23±0.83 1.25 38.88±1.84 20 35.83±1.45 2.5 63.19±5.4 30 59.91±2.08 5 80.46±4.88 40 77.91±0.41 10 92.26±2.46 50 87.83±0.8
2.2不同浓度的PJ34单药对A549/DDP细胞增殖的影响PJ34单药对A549/DDP细胞的生长也有抑制作用,抑制率随药物浓度的增加而增加。用SPSS19.0软件计算,PJ34处理A549/DDP细胞48 h其半数抑制浓度(IC50)为(22.2±2.09) mg·L-1。并且,3 mg·L-1的PJ34对A549/DDP细胞的抑制率为4.43%,抑制率<5%,可认为是该药物的无细胞毒浓度(Fig 1)。
2.3无毒浓度的PJ34联合DDP可明显增强A549/DDP细胞对DDP的敏感性与DDP单药组相比,无毒浓度(3 mg·L-1)的PJ34联合DDP组A549/DDP细胞对顺铂的敏感性明显增加,IC50值由(26.14±0.62) mg·L-1降低为(11.46±0.92) mg ·L-1(P<0.01),逆转倍数(RF)为2.28倍,相对逆转率(RRR%)为62.7%,提示PJ34具有部分逆转A549/DDP细胞DDP耐药的作用(Fig 2)。
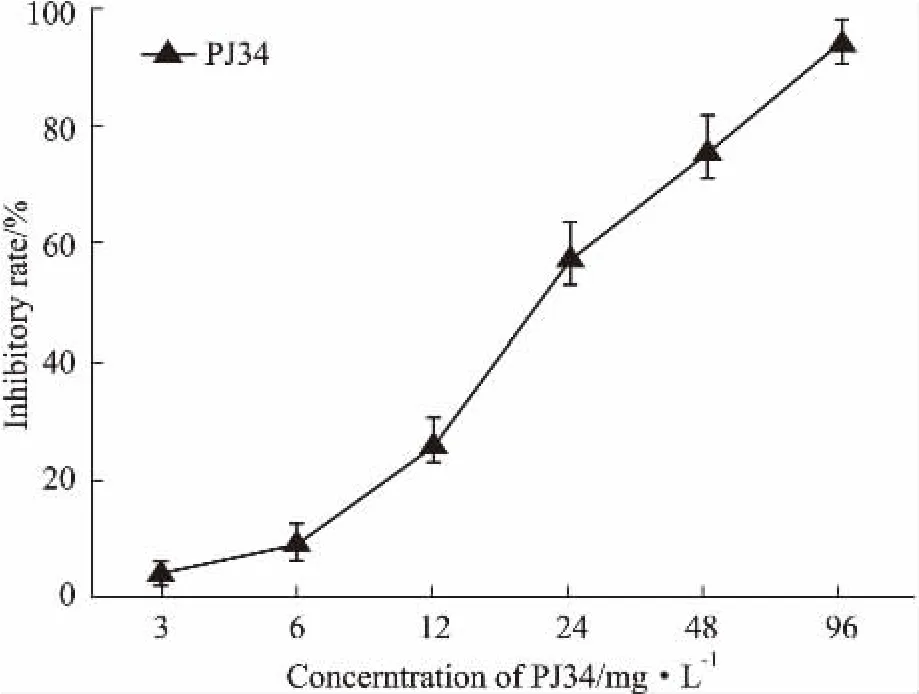
Fig 1 Inhibition ratios of PJ34 on growth of A549/DDP cellss,n=3)

Fig 2 Inhibition ratios of DDP alone or combined with PJ34on growth of A549/DDP cells(珋±s,n=3)
2.4DDP单药/联合PJ34对A549/DDP细胞凋亡的影响3 mg·L-1(无毒浓度)的PJ34对A549/DDP细胞无明显杀伤作用,凋亡率与对照组相比,P >0.05,差异无统计学意义。12 mg·L-1(IC50)的DDP单药对A549/DDP细胞有一定的细胞毒作用,凋亡率为17.74%,与对照组相比,P<0.05,差异有统计意义。而PJ34与DDP联合可明显诱导细胞凋亡,凋亡率为33.2%,与PJ34单药及DDP单药组相比,P<0.05(Fig 3,Tab 2)。
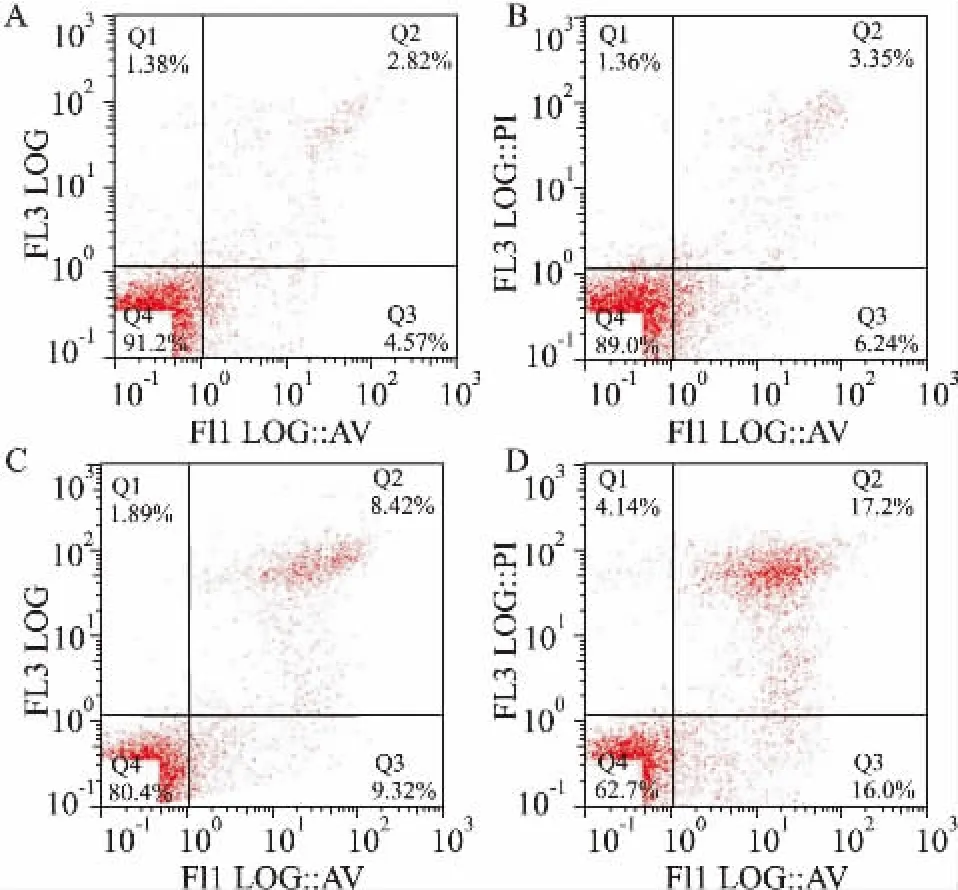
Fig 3 Apoptosis ratios of PJ34 alone or combined withDDP on A549/DDP cells
Tab 2 Apoptosis rate of A549/DDP cells treated with PJ34 alone or combined with DDP±s,n=3)

Tab 2 Apoptosis rate of A549/DDP cells treated with PJ34 alone or combined with DDP±s,n=3)
*P<0.05 vs control;ΔP<0.05 vs PJ34 and DDP.
Group Apoptosis rate/% Control 7.35±2.12 PJ34 9.46±1.8 DDP 18.02±3.57*PJ34+ DDP 34.76±3.81Δ
2.5PJ34单药及联合顺铂对细胞内PARP-1、LRP、GST-π蛋白的调节作用采用Image J软件对条带进行灰度值分析,结果见Fig 4、5,图中数据均为样本蛋白表达/β-actin表达。A549/DDP耐药株内PARP-1及耐药相关蛋白LRP、GST-π的表达水平均较A549顺铂敏感株明显升高。PJ34联合DDP处理48 h后,A549/DDP耐药株内PARP-1及LRP、GST-π的表达水平均明显下降,与A549/DDP细胞对照组及单药处理组相比,P<0.05,差异有统计学意义。
3 讨论
肺癌的顺铂耐药性是造成化疗失败的主要原因之一,其耐药机制至今仍是让人倍感困惑的问题。目前关于肺癌耐药相关蛋白研究较多的主要有肺耐药相关蛋白(lung resistancerelated protein,LRP)和谷胱甘肽-S-转移酶-π(glutathione S-transferase-Pi,GST-π)等。LRP主要通过2种机制引起多药耐药(multidrug resistance,MDR),一是阻止以细胞核为靶点的药物通过核孔进入核内,并将进入的药物在药效发生前泵出核外;二是使胞质中的药物进入囊泡,然后通过胞吐作用排出细胞[7]。LRP在肿瘤组织中含量明显增高,可明显影响抗癌药物的胞内的转运和分布,介导铂类、烷化剂等耐药。GST是一组具有解毒和抗氧化作用的酶类,其中GST-π的表达在人类肿瘤细胞中明显增高,与耐药关系最密切,DDP等抗癌药物都是通过该系统被运送至胞外[8]。Bai等[9]曾经报道NSCLC患者组织中GST-π表达与顺铂的化疗有效率呈明显负相关,说明了GST-π是介导肺癌DDP耐药的重要因素之一。在本研究中,我们发现A549/DDP耐药株的LRP、GST-π蛋白表达水平均较A549敏感株明显升高,与上述文献报道相符,本研究补充了PARP-1抑制剂联合DDP降低A549/DDP耐药株的LRP、GST-π蛋白表达水平,从而逆转耐药的研究。
PARP-1抑制剂的抗肿瘤作用机制主要是基于PARP-1的DNA损伤修复功能,如果PARP-1的活性被抑制,DNA单链损伤(single strand break,SSBs)不能得到及时修复,将导致DNA单链损伤的累积,并转化成持续的双链损伤(double strand break,DSBs),最终细胞死亡[10]。最初,PARP-1抑制剂作为化疗或放疗增敏剂,与细胞毒性化疗药物或放疗联合应用[11-13]。Nguewa等[14]通过体外实验观察到,无毒剂量的PARP-1抑制剂3-AB与DDP联合作用于卵巢癌顺铂耐药细胞株CH1cisR 24 h,不仅能明显增加耐药细胞对DDP的敏感性,并能将细胞死亡的方式由坏死转变为凋亡,从而避免因细胞坏死对机体产生的不良反应。Michels等[15]研究发现与野生型A549细胞相比较,DDP耐药细胞株对PARP抑制剂更加敏感,当给予野生型A549细胞一定量的DDP后,细胞内PARP-1的表达水平明显增加,此现象可被PARP抑制剂完全抑制。本研究同样观察到PARP-1抑制剂PJ34能明显增加肺腺癌A549/DDP耐药细胞对DDP的敏感性,诱导细胞凋亡,提示这可能与其对凋亡通路的调控有一定的相关性。

Fig 4 Protein expression of PARP-1 and LRP,GST-π in A549 and A549/DDP cells(珋±s,n=3)
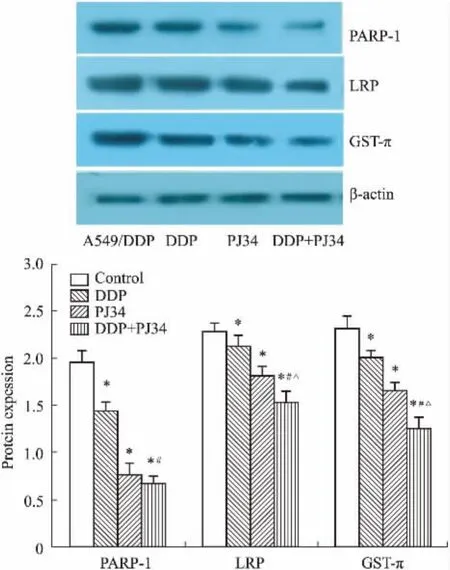
Fig 5 Protein expression level of PJ34 alone or combined withDDP on A549/DDP cells(珋±s,n=3)
PJ34是第3代选择性PARP-1抑制剂,属于菲啶酮类化合物,口服和注射给药生物利用度都很高。其抑酶活性是传统PARP抑制剂3-AB的10 000倍。Gangopadhyay等[16]研究发现PJ34单药即可抑制NSCLC细胞系Calu-6、A549及H460的增殖与转移,并能通过激活Caspase介导的细胞凋亡通路促进细胞凋亡。本文研究结果与其一致,还检测了PJ34对A549/DDP耐药细胞的增殖抑制作用。此外还有文献[17]显示: NSCLC细胞对DDP的敏感性与铂-DNA加合物的累积正相关,PARP抑制剂PJ34具有放缓铂-DNA加合物清除速度的能力,从而起到DDP增敏作用。
综上所述,本研究说明PARP-1抑制剂PJ34单药可抑制A549/DDP细胞的增殖,在无细胞毒作用的低剂量(3 mg·L-1)下,PJ34可明显增强A549/DDP细胞对DDP的敏感性,部分逆转耐药现象,其逆转机制可能与诱导细胞凋亡、降低细胞内PARP-1蛋白及多药耐药蛋白LRP、GST-π的表达水平有关,其具体作用机制有待进一步地深入研究,期望能为DDP耐药的NSCLC患者的治疗提供一定的指导意义。
(感谢安徽医科大学第一附属医院中心实验室的支持与帮助。)
参考文献:
[1]Castiel A,Visochek L,Mittelman L,et al.A phenanthrene derived PARP inhibitor is an extra-centrosomes de-clustering agent exclusively eradicating human cancer cells[J].BMC Cancer,2011,11 (1) :412-26.
[2]Ahmad M,Torky A,Glahn F,et al.PARP-1 expression and activity in primary human lung cells[J].Arch Toxicol,2011,85(6) : 669 -79.
[3]Michels J,Vitale I,Senovilla L,et al.Synergistic interaction between cisplatin and PARP inhibitors in non-small cell lung cancer [J].Cell Cycle,2013,12(6) :877-83.
[4]Zhang J J,Kan Y Y,Tian Y J,et al.Effects of poly(ADP-ribosyl) polymerase(PARP) inhibitor on cisplatin resistance&proliferation of the ovarian cancer C13* cells[J].Indian J Med Res,2013,137 (3) :527-32.
[5]Mirza M R,Monk B J,Ledermann J A,et al.A phase 3 randomized doubleblind trial of maintenance with PARP-inhibitor niraparib versus placebo in patients with platinum-sensitive ovarian cancer [J].Annals Oncol,2014,25(Suppl 4) :305-26.
[6]饶进军,何关生,毛楠,等.沉默EZH2表达逆转人非小细胞肺癌顺铂耐药性[J].中国药理学通报,2014,30(8) :1084-9.
[6]Rao J J,He G S,Mao N,et al.Reverse effect of silencing EZH2 expression on human cisplatin-resistant non small cell lung cancer [J].Chin Pharmacol Bull,2014,30(8) :1084-9.
[7]Scheffer G L,Schroeijers A B,Izquierdo M A,et al.Lung resistance-related protein/major vault protein and vaults in multidrug-resistant cancer[J].Curr Opin Oncol,2000,12(6) :550-6.
[8]Goto S,Ihara Y,Urata Y,et al.Doxorubicin-induced DNA intercalation and scavenging by nuclear glutathione S-transferase pi[J].FASEB J,2001,15(14) :2702-14.
[9]Bai F,Nakanishi Y,Kawasaki M,et al.Immunohistochemical expression of glutathione-S-transferase-Pi can predict chemotherapy response in patients with non small cell lung carcinoma[J].Cancer,1996,78(3) :416-21.
[10]Abd-Elmageed Z Y,Naura A S,Errami Y,et al.The poly(ADP-ribose) polymerases (PARPs) : New roles in intracellular transport [J].Cell Signall,2012,24(1) :1-8.
[11]Fauzee N J,Pan J,Wang Y L.PARP and PARG inhibitors-new therapeutic targets in cancer treatment[J].Pathol Oncol Res,2010,16(4) :469-78.
[12]Cheng H Y,Zhang Z F,Borczuk A,et al.PARP inhibition selectively increases sensitivity to cisplatin in ERCC1-low non-small cell lung cancer cells[J].Carcinogenesis,2013,34(4) :739-49.
[13]Minami D,Taligawa N,Takeda H,et al.Synergistic effect of olaparib with combination of cisplatin on PTEN-deficient lung cancer cells[J].Mol Cancer Res,2013,11(2) :140-8.
[14]Nguewa PA,Fuertes MA,Cepeda V,et al.Poly(ADP-ribose) polymerase-1 inhibitor 3-Aminobenzamide enhances apoptosis induction by platinum complexes in cisplatin-resistant tumor cells[J].Med Chem,2006,2(1) :47-53.
[15]Michels J,Vitale L,Galluzzi L,et al.Cisplatin resistance associated with PARP hyperactivation[J].Cancer Res,2013,73(7) : 2271-80.
[16]Gangopadhyay N N,Luketich J D,Opest A,et al.Inhibition of poly (ADP-Ribose) polymerase (PARP) induces apoptosis in lung cancer cell lines[J].Cancer Investing,2011,29(9) :608-11.
[17]Olaussen K A,Adam J,Vanhecke E,et al.PARP1 impact on DNA repair of platinum adducts: Preclinical and clinical read-outs[J].Lung Cancer,2013,80(2) :216-22.
Study of reversal effect of PARP-1 inhibitor PJ34 on cisplatin-resistance in human lung adenocarcinoma cells
YAO Yuan-yuan,HAO Ji-qing
(The First Affiliated Hospital of Anhui Medical University,Hefei 230022,China)
Abstract:AimTo investigate the reversal effect of PARP-1 inhibitor PJ34 on cisplatin-resistance in human lung adenocarcinoma A549/DDP cells and the mechanism.Methods A549/DDP cells were treated with PJ34 alone or combined with cisplatin.The effects of proliferation inhibition were assayed by MTT method.The apoptosis ratios of cells were analyzed by flow cytometry.The protein expression of PARP-1 and LRP,GST-π were measured by Western blot assay.Results
PJ34 could inhibit the proliferation of A549/DDP cells alone.The non-toxic dose of PJ34 could significantly resensitize A549/DDPcellstocisplatin,induceapoptotic,lower the expression of PARP-1 and resistance-associated protein LRP and GST-π.Conclusion
PJ34 could inhibit the proliferation of A549/DDP cells and resensitize A549/DDP cells,partially reverse cisplatin-resistance in A549/DDP cells,with a probable mechanism relating to increased apoptotic rate,and lowered expression of PARP-1 and resistance-associated protein LRP and GST-π.
Key words:lung adenocarcinoma; PARP-1 inhibitors; cisplatin; drug resistance; apoptosis; mechanism
作者简介:姚圆圆(1988-),女,硕士生,研究方向:胸部肿瘤的个体化治疗,E-mail: yao18955179781@163.com;郝吉庆(1969-),女,博士,副教授,主任医师,硕士生导师,研究方向:胸部肿瘤的个体化治疗,E-mail: ayfy_hjq@ 163.com
基金项目:安徽省自然科学基金计划项目(No 1308085MH142) ;安徽省对外科技合作计划项目(No 1503062023)
收稿日期:2015-01-14,修回日期:2015-03-19
文献标志码:A
文章编号:1001-1978(2015) 06-0865-06中国图书分类号: R329.24; R730.53; R734.202.2; R979.1
doi:10.3969/j.issn.1001-1978.2015.06.025

