蛇葡萄素钠联合卡铂对人肺腺癌GLC-82细胞增殖及凋亡的影响
王 霞,韩 伟,葛 斌,吴勇杰
(1.兰州大学基础医学院药理学研究所,甘肃省新药临床前研究重点实验室,甘肃兰州 730000; 2.甘肃省人民医院,甘肃兰州 730000;3.甘肃中医学院定西校区,甘肃定西 743000)
蛇葡萄素钠联合卡铂对人肺腺癌GLC-82细胞增殖及凋亡的影响
王霞1,2,韩伟3,葛斌2,吴勇杰1
(1.兰州大学基础医学院药理学研究所,甘肃省新药临床前研究重点实验室,甘肃兰州730000; 2.甘肃省人民医院,甘肃兰州730000;3.甘肃中医学院定西校区,甘肃定西743000)
摘要:目的探讨蛇葡萄素钠(AMP-Na)单用及其与卡铂(CBP)合用对人肺腺癌GLC-82细胞增殖的抑制作用及可能的机制。方法四甲基偶氮唑盐(MTT)比色法测定两药单用及合用对GLC-82细胞的体外杀伤活性;透射电子显微镜(TEM)观察GLC-82细胞超微结构的变化;流式细胞仪(FCM)检测GLC-82细胞凋亡和caspase-3的表达。结果对于GLC-82细胞,AMP-Na与CBP合用,CBP的IC(50)由(17.10±4.78) mg·L(-1)降低到<3.12 mg·L(-1)(P<0.01),表明Amp-Na对卡铂抑制GLC-82细胞增殖的作用具有协同效应(CDI<1)。TEM及FCM检测结果表明,单用AMP-Na及与卡铂合用均可诱导GLC-82细胞凋亡、坏死,两药合用后坏死率由(2.56±0.41) %升高到(71.83± 5.43) % (P<0.01)。AMP-Na单用及与卡铂合用作用于GLC-82细胞48 h后,caspase-3的表达均明显增高。结论AMP-Na和CBP具有协同诱导GLC-82细胞凋亡的作用,机制可能与激活细胞内caspase-3介导的信号转导通路相关。
关键词:蛇葡萄素钠;卡铂;人肺腺癌GLC-82细胞;细胞凋亡;细胞坏死; caspase-3
蛇葡萄素(ampelopsin)是存在于葡萄科植物中的一类重要的黄酮类化合物。近年来的研究发现,蛇葡萄素具有体内外抗肿瘤、消炎镇痛、祛痰止咳、保肝护肝等作用[1-2]。蛇葡萄素钠(ampelopsin sodium,AMP-Na)是本实验室为了提高蛇葡萄素的溶解性及稳定性,使其成为更适合临床使用的药物剂型而制备的高水溶性钠盐。AMP-Na联合卡铂(CBP)后对肿瘤细胞的作用是否有改变,目前尚不确定,所以在前期实验的基础上,采用MTT法研究AMP-Na与CBP合用对人肺腺癌GLC-82细胞的细胞毒作用,应用流式细胞仪检测其对细胞凋亡的影响,初步探讨AMP-Na与CBP合用对GLC-82细胞增殖的抑制作用及机制。
1 材料与方法
1.1药品与试剂蛇葡萄素钠(AMP-Na)冻干剂:每支50 mg,批号:051115,纯度98.8 %; AMP-Na冻干剂专用稀释液(0.1 mol·L-1,pH=6.8磷酸盐缓冲液:每支5 mL,批号051118),均由广东泰禾医药科技有限公司提供。卡铂:江苏齐鲁制药有限公司产品,批号:5090061 DA。新生小牛血清:杭州四季青生物工程有限公司产品,批号: 050126。RPMI 1640培养基: Gibco Invitrogen Corporation,USA产品。MTT: Fluka公司产品,用pH=7.4的PBS配制成5 g·L-1,过滤除菌分装,4℃保存(2周内有效)。
1.2细胞系人肺腺癌GLC-82细胞,购自中科院上海细胞生物研究所细胞库。
1.3仪器CO2培养箱: Shellab 2306、Shellab 2323均为USA产品。超净工作台: SW-CJ-IFD苏州净化设备有限公司产品。ELX800型酶联免疫检测仪: USA产品。流式细胞仪: Coulter Epics XL型,Beckman-Coulter Inc,Fullerton,CA,USA产品。倒置显微镜: OLYMPUS产品。透射电子显微镜: JEN-100CX日本电子公司产品。高速离心机: Anke TDl-5上海安亭科学仪器厂产品。
1.4MTT比色法测定AMP-Na单用及与CBP合用对人肺腺癌GLC-82细胞增殖的抑制作用取对数生长期(传代后24~48 h)的GLC-82细胞,用0.25 %的胰蛋白酶消化、离心(1 000 r·min-1,5 min),弃上清液,保留细胞沉淀,在细胞沉淀中加RPMI 1640培养液调整各细胞浓度至5×107·L-1,在96孔培养板中以每孔90 μL加入细胞悬液,培养24 h,待细胞贴壁后每孔加入药物10 μL,继续培养48 h。于实验终止前4 h每孔加入MTT 10 μL,实验终止时每孔加入10 % SDS 100 μL,置37℃、5% CO2的培养箱中过夜,次日先震荡10 min,然后于波长570 nm处测定吸光值。根据下式计算抑制率和药物相互作用指数(CDI),并计算IC50值。

本实验数据中阴性OD值为减去空白对照的值,受试药OD均值为减去颜色对照的值。药物相为两药联合用药组与对照组570 nm吸光值的比值,A或B是各药单独用药组与对照组570 nm吸光值的比值。当CDI<1时,两药有协同作用;当CDI<0.7时,协同作用非常显著; CDI=1,则两药作用性质为相加; CDI>1时,则两药作用性质为拮抗)。本实验整体分为5组,具体实验设计如下:阴性对照组: RPMI 1640完全培养液+细胞+溶媒(pH=6.8 PBS) ;阳性对照组: RPMI 1640完全培养液+细胞+ CBP;空白对照组: RPMI 1640完全培养液+溶媒;受试药组: RPMI 1640完全培养液+细胞+ AMP-Na系列浓度; RPMI 1640完全培养液+细胞+50 mg·L-1的AMP-Na+ CBP系列浓度; AMP-Na颜色对照组: RPMI 1640完全培养液+50 mg·L-1的AMP-Na。每个组的每个浓度设3个复孔,以3个复孔OD值的均数作为一次实验的数据。
1.5流式细胞仪检测细胞凋亡和caspase-3的表达
取对数生长期的GLC-82细胞,用含10 %小牛血清的RPMI 1640完全培养液调节细胞浓度1×108·L-1,以每瓶9 mL接种100 mL容量的6个培养瓶内,分别作为阴性对照组、卡铂对照(25 mg·L-1)组、AMP-Na (50 mg·L-1)单用组、AMP-Na (100 mg·L-1)单用组、AMP-Na (50 mg·L-1)+卡铂(25 mg·L-1)组、AMP-Na (100 mg·L-1)+卡铂(25 mg·L-1)组。培养24 h待细胞贴壁后,分别以每瓶1 mL加入药物或生理盐水,继续培养48 h。实验终止时,先将培养液离心(室温,1 000 r·min-1,5 min)弃上清,保留细胞沉淀;再用0.25%胰蛋白酶消化贴壁细胞,在显微镜下观察当细胞间隙增大、胞质回缩、胞核变圆(约2~3 min)后,加含10 %小牛血清的RPMI 1640培养液中止消化,用吸管吹打均匀后将含细胞的培养液离心(1 000 r·min-1,5 min),混合所得细胞沉淀,制备样本,用Multicycle软件分析,计算凋亡细胞百分数和各细胞周期百分数及caspase-3的表达;用FACScan进行流式细胞术检测分析。
2 结果
2.1细胞增殖抑制试验实验结果表明,AMP-Na 对GLC-82细胞的增殖具有明显的抑制作用,有浓度依赖性。AMP-Na 50 mg·L-1与卡铂系列浓度合用后,对GLC-82细胞的抑制率较两者单用时均增高,表明AMP-Na可以协同卡铂抗GLC-82细胞的增殖。见Tab 1。
Tab 1 Inhibition effects and IC50of AMP-Na or combinedwith carboplatin on GLC-82 cells(±s,n=9)

Tab 1 Inhibition effects and IC50of AMP-Na or combinedwith carboplatin on GLC-82 cells(±s,n=9)
**P<0.01 vs negative group;△P<0.05,△△P<0.01 vs AMPNa;#P<0.05,##P<0.01 vs carboplatin
Negative control 0 Carboplatin 3.12 1.5±13.28 Carboplatin 6.25 7.9±7.99 Carboplatin 12.5 30.5±4.16**Carboplatin 25 80.4±2.80**Carboplatin 50 88.6±5.06**AMP-Na 25 -13.0±9.37 AMP-Na 50 47.0±17.41**AMP-Na 100 75.2±3.92**AMP-Na 200 81.0±2.89**AMP-Na+ CBP 50+3.12 63.5±11.37**##AMP-Na+ CBP 50+6.25 69.7±0.11**#AMP-Na+ CBP 50+12.5 67.7±18.45**△##AMP-Na+ CBP 50+25 84.6±1.44**△△##AMP-Na+ CBP 50+50 91.7±3.31**△△#IC50of AMP-Na 57.39±17.35 IC50of CBP 17.10±4.78 IC50of AMP-Na+ CBP<3.12
2.2Annexin V/PI双染法检测凋亡Annexin-VFITC/PI双标检测显示,药物作用48 h后,阴性对照组活细胞、凋亡细胞、坏死细胞占总细胞的百分比分别为(98.3±0.45) %、(0.53±0.13) %和(0.39± 0.34) %。卡铂25 mg·L-1处理组活细胞明显减少,凋亡细胞明显增多。100 mg·L-1的AMP-Na单用组及与卡铂合用组,几乎没有活细胞,大部分细胞处于坏死状态,尚有部分处于凋亡状态(Tab 2、Fig 1)。
实验结果表明,100 mg·L-1的AMP-Na作用于GLC-82细胞48 h后,大部分细胞处于凋亡和坏死状态。由于100 mg·L-1的AMP-Na单独使用时就产生了强大的细胞毒作用,所以其与卡铂合用后对GLC-82细胞的作用与卡铂单用比较,无明显变化(P>0.05)。
2.3AMP-Na单用及与卡铂合用对GLC-82细胞caspase-3表达的影响卡铂25 mg·L-1、AMP-Na 100 mg·L-1处理GLC-82细胞48 h后,caspase-3的表达均明显增高,与阴性对照组比较,差异有显著性(P<0.01)。AMP-Na 100 mg·L-1与卡铂25 mg· L-1联合用药组细胞,caspase-3的表达明显增高,与阴性对照组比较,差异有显著性(P<0.01),与卡铂25 mg ·L-1比较,无明显变化(P>0.05)。见Tab 3、Fig 2。

Fig 1 Apoptotic rate of GLC-82 cells in different groups
Tab 2 Apoptosis and necrosis ratio of GLC-82 cells induced by AMP-Na or combined 48 h with carboplatin (珋±s,n=3)
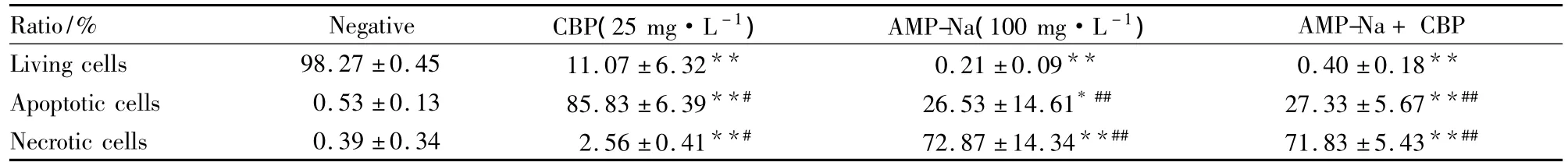
Tab 2 Apoptosis and necrosis ratio of GLC-82 cells induced by AMP-Na or combined 48 h with carboplatin (珋±s,n=3)
*P<0.05,**P<0.01 vs negative group;#P<0.05,##P<0.01 vs carboplatin group
Apoptotic cells 0.53±0.13 85.83±6.39**# 26.53±14.61* ## 27.33±5.67**##Necrotic cells 0.39±0.34 2.56±0.41**# 72.87±14.34**## 71.83±5.43**##
Tab 3 Expression of caspase-3 induced by AMP-Na or combined with carboplatin on GLC-82 cells±s,n=3)

Tab 3 Expression of caspase-3 induced by AMP-Na or combined with carboplatin on GLC-82 cells±s,n=3)
**P<0.01 vs negative group
Caspase-3 Control CBP(25 mg·L-1) AMP-Na(100 mg·L-1)AMP-Na+ CBP Positive rate/% 57.87±5.30 97.70±0.95** 80.00±3.82** 97.43±2.97**MFI 2.32±0.13 3.97±0.40** 3.03±0.13** 4.81±0.98**
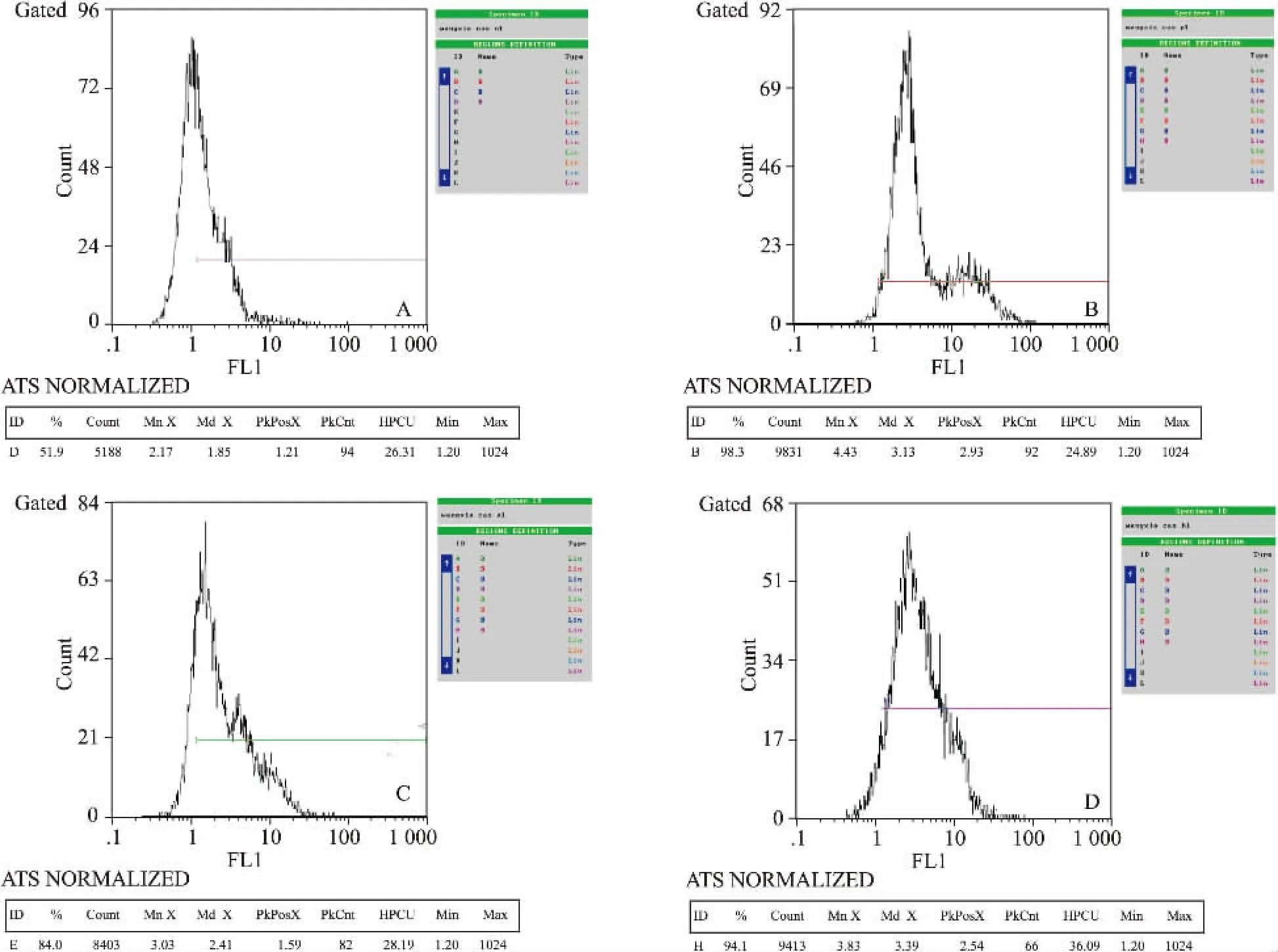
Fig 2 The expression of caspase-3 in different groups
2.4透射电镜观察细胞形态的变化阴性对照组GLC-82细胞胞膜完整,微绒毛丰富,胞质中细胞器丰富,核膜清晰完整,染色质均匀分布(Fig 3A) ;卡铂处理组细胞胞膜完整,微绒毛减少,核膜清晰,线粒体扩张,胞质中出现大量空泡(Fig 3B) ; AMP-Na单用组,细胞表面光滑,微绒毛消失,细胞核固缩,核质比例增大,染色质凝集为团块状,分布与核膜边缘呈月牙状,细胞内出现大量空泡,线粒体肿胀(Fig 3C) ; AMP-Na与卡铂联用组,细胞膜表面的微绒毛明显减少,线粒体明显肿胀,染色质凝集并边集于核膜(Fig 3D)。
3 讨论
近年来肺癌已成为恶性肿瘤患者死亡的主要疾病,其中非小细胞肺癌(NSCLC)占肺癌发病率的80%左右,预后较差,而化疗是晚期NSCLC的主要治疗方法,以铂类药物为基础的联合化疗虽能改善晚期NSCLC患者的生存期、症状和生活质量,但其疗效已经达到了平台期[3],提高疗效关键在于推出高效低毒的新药。目前对于NSCLC的治疗,主张应用联合化疗,含铂方案目前是治疗晚期NSCLC的标准方案。但含铂方案有抗瘤谱窄、易产生耐药性等缺点,主要不良反应有骨髓抑制、消化道反应、脱发、肾毒性、肝毒性、神经毒性等[4-5]。由于以上原因,使得卡铂在临床上的使用受到限制。据国外报道,在临床上与卡铂协同用药可使预后差的许多肿瘤得到有效治疗[6-7]。所以找到一种与卡铂等化疗药物具有协同作用且低毒的药物,在提高其疗效的作用下,同时能大大降低其用药剂量,以克服其在临床使用中的不良反应、提高患者疗效是非常有意义的。本实验结果表明,50 mg·L-1的AMP-Na单用,对GLC-82细胞的IR为(53.6±11.07) %。卡铂3.12~12.5 mg·L-1单用的IC50为(17.10±4.78) mg ·L-1。AMP-Na 50 mg·L-1与卡铂3.12~12.5 mg ·L-1合用时,卡铂对GLC-82细胞的IC50<3.12 mg ·L-1。表明50 mg·L-1的AMP-Na对卡铂抑制GLC-82细胞增殖的作用具有协同效应,且主要对低、中浓度的卡铂协同作用较强。
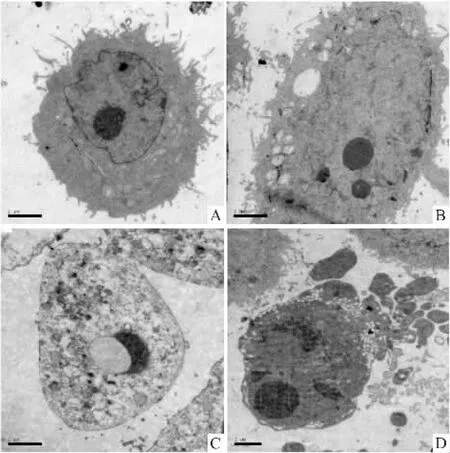
Fig 3 Ultrastructure change of apoptotic GLC-82 cells with transmission electron microscope (48 h,×10 000)
随着科学研究的深入,人们发现凋亡在肿瘤的发生、发展上也起着重要作用。目前的抗肿瘤药物作用主要有直接杀死或抑制肿瘤细胞生长,以及诱导肿瘤细胞凋亡两个方面。而是否能引起肿瘤细胞凋亡又是评价化疗药物优劣的重要指标。本实验通过透射电镜观察可见,AMP-Na处理组及与卡铂联用组出现典型的凋亡相关的形态学变化,这说明AMP-Na可诱导GLC-82细胞凋亡,是其抗肿瘤作用机制之一。细胞凋亡的发生是一个极其复杂的过程,受多种机制调节和制约。凋亡发生机制中最关键的环节之一是caspase的激活,而caspase-3是目前已知与凋亡关系最密切的caspase家族成员之一。本实验结果表明,AMP-Na可以活化细胞内的caspase-3,而活化的caspase-3能裂解DNA修复相关分子、凋亡抑制蛋白、细胞外基质蛋白及骨架蛋白等,促使细胞凋亡。此外,由于caspase-3是多种凋亡途径共同作用的因子,其蛋白表达水平的高低决定着细胞凋亡程度[9]。所以本实验结果提示,AMPNa诱导肿瘤细胞凋亡的机制之一可能是通过激活细胞内的caspase-3介导的信号转导通路,从而促进凋亡的发生。总之,细胞凋亡的发生是一个极其复杂的过程,有关AMP-Na诱导肿瘤细胞凋亡的机制还有待进一步研究。
参考文献:
[1]周春权,姚欣,陈晓明,倪峰.藤茶提取物的抗肿瘤作用研究[J].中药新药与临床药理,2011,22(6) :640-2.
[1]Zhou C Q,Yao X,Chen X M,Ni F.Studies on anti-tumor effect of ampelopsis grossedentata extracts[J].Tradit Chin Drug Res Clin Pharmacol,2011,22(6) :640-2.
[2]张琼,刘德育.蛇葡萄素改变Bcl2/Bax表达和激活caspase-3诱导人肝癌细Bel27402凋亡[J].中国药理学通报,2009,25 (11) :1502-6.
[2]Zhang Q,Liu D Y.Ampelopsin induces apoptosis via altering expression of Bcl-2/Bax and activating caspase-3 in human hepatoma cell line Bel-7402[J].Chin Pharmacol Bull,2009,25(11) :1502 -6.
[3]王萍,宋玉仙,窦精杰,候亚义.新化合物D261抑制非小细胞肺癌NCI-H460细胞增殖及其作用机制[J].中国药理学通报,2013,29(3) :442-3.
[3]Wang P,Song Y X,Dou J J,Hou Y Y.Inhibitory effect of a novel compound D261 on human NSCLC NCI-H460 cells[J].Chin Pharmacol Bull,2013,29(3) :442-3.
[4]Pal S K,Figlin R A,Reckamp K.Targeted therapies for non-small cell lung cancer: an evolving landscape[J].Mol Cancer Ther,2010,9(7) :1931-44.
[5]饶进军,何关生,毛楠,钟小懿.沉默EZH2表达逆转人非小细胞肺癌顺铂耐药性[J].中国药理学通报,2014,30(8) : 1084 -90.
[5]Rao J J,He G S,Mao N,Zhong X Y.Reverse effect of silencing EZH2 expression on human cisplatin-resistant non small cell lung cancer[J].Chin Pharmacol Bull,2014,30(8) :1084-90.
[6]Isabelle M,Patrick S,Hubert C,et al.PhaseI/Ⅱstudy of escala-[8]ting dose of vinorel binein combination with oxaliplation with inpatiens with advanced non-small cells lung cancer[J].J Clin Oncol,2001,19(2) :485-63.
[7]孙华燕,徐风华,郭荣荣.吉西他滨联合铂类与其他含铂方案治疗非小细胞肺癌的Meta分析[J].中国现代应用药学,2014,31(7) :884-90.
[7]Sun H Y,Xu F H,Guo R R.Gemcitabine plus platinum chemotherapy compared with other platinum containing regimens in advanced non-small-cell lung cancer: a Meta-analysis of survival outcomes[J].Chin J Mod Appl Pharm,2014,31(7) :884-90.
[8]Mimeault M,Hauke R,Batra S K.Recent advances on the molecular mechanisms involved in the drug resistance of cancer cells and novel targeting therapes[J].Clin Pharmacol Ther,2008,83(5) : 673-91.
[9]施剑明,殷嫦嫦,孙维君,杜桂花.槲皮素联合顺铂对人骨肉瘤MG-63细胞增殖及凋亡的影响[J].中国药理学通报,2014,30(10) :1361-6.
[9]Shi J M,Yin C C,Sun W J,Du G H.Effect of combined with cisplatin on proliferation and apoptosis of human osteosarcoma cell line MG-63[J].Chin Pharmacol Bull,2014,30(10) :1361-6.
Effect of ampelopsin sodium combined with carboplatin on the proliferation and apoptosis of human lung adenocarcinoma cell GLC-82
WANG Xia1,2,HAN Wei3,GE Bin2,WU Yong-jie1
(1.Dept of Pharmacology,School of Basic Medical Science,Gansu Key Laboratory of Preclinical Study for New Drugs,Lanzhou University,Lanzhou 730000,China;2 Dept of Pharmacy,Gansu Provincial Hospital,Lanzhou 730000,China; 3.Dingxi Campus of Gansu University of Traditional Chinese Medicine,Dingxi Gansu 743000,China)
Abstract:AimTo investigate the cytotoxic effect and mechanism of ampelopsin sodium (AMP-Na) on human lung adenocarcinoma cell line GLC-82 alone or combined with carboplatin (CBP).MethodsThe cytotoxic effect of human lung adenocarcinoma cell line GLC-82 was investigated by 3-(4,5-dimethylthiazol-2-yl) -2,5-diphenyltetrazolium bromide (MTT) colorimetric assay.Ultrastructure change of apoptotic GLC-82 cells was observed with transmission electron microscope.The changes of the cell apoptosis and the expression of caspase-3 were analyzed with flow cytometer.ResultsCombined with AMP-Na,the IC(50)of CBP decreased from (17.10±4.78) mg·L(-1)to<3.12 mg·L(-1)(P<0.01),showed that the combination of AMP-Na and CBP had synergistic effect on GLC-82 cells (CDI<1).As with transmission electron microscope and flow cytometric analysis,the apoptosis and necrosis ratios also increased in the combination group.The necrosis ratios increased from (2.56± 0.41) % to (71.83±5.43) % (P<0.01).The expression of caspase-3 was increased significantly after treated with AMP-Na or combined with CBP.Conclusions There is a synergistic cytotoxic effect on GLC-82 cells treated with AMP-Na combined with CBP.Apoptotic cells and necrotic cells are found in GLC-82 cells treated with AMP-Na alone or combined with CBP.One of the mechanisms to induce apoptosis is probably that activation of caspase-3 mediates signal transduction pathway in cells.
Key words:ampelopsin sodium; carboplatin; human lung adenocarcinoma cell line GLC-82; apoptosis; necrosis;caspase-3
作者简介:王霞(1980-),女,硕士,主管药师,研究方向:药理学、临床药学,Tel: 0931-8281726,E-mail: wangx-2008 @ 163.com;吴勇杰(1955-),男,教授,博士生导师,研究方向:肿瘤药理学,通讯作者,Tel: 0931-8915092,E-mail: wuyj@ lzu.edu.cn
基金项目:广东省科技厅省部产学研合作项目(No 2007A090302025)
收稿日期:2015-01-31,修回日期:2015-03-10
文献标志码:A
文章编号:1001-1978(2015) 06-0838-06中国图书分类号: R329.24; R329.25; R734.202; R734.205.3; R979.1
doi:10.3969/j.issn.1001-1978.2015.06.020

