姜黄素衍生物C085对K562细胞的作用及机制研究
吴 莺,陈瑞家,吴丽贤,许建华
(福建医科大学药学院1.福建省天然药物药理学重点实验室、2.天然药物学系,福建福州 350108)
姜黄素衍生物C085对K562细胞的作用及机制研究
吴莺1,2,陈瑞家1,吴丽贤1,许建华1
(福建医科大学药学院1.福建省天然药物药理学重点实验室、2.天然药物学系,福建福州350108)
摘要:目的研究姜黄素衍生物C085对K562细胞增殖、凋亡的影响,并探讨其作用机制。方法采用MTT法观察C085对细胞增殖的影响; Annexin V-FITC/PI双荧光染色后流式细胞仪检测C085对细胞凋亡的影响;蛋白免疫印迹探讨C085引发K562细胞凋亡的机制,检测其对BCR-ABL及其下游信号转导通路蛋白的磷酸化及对其他凋亡相关蛋白表达的影响; JC-1荧光染色法检测C085对细胞线粒体膜电位的影响。结果C085在低浓度下抑制K562细胞,IC(50)只有其母体姜黄素的1/5甚至更低;在24h即对K62细胞有较强的诱导凋亡作用,主要是中、晚期凋亡。与阳性对照药IM相比,诱导凋亡作用明显。对其作用机制研究发现,C085可下调BCR-ABL的自磷酸化和下游信号转导通路蛋白Stat 5 和Crkl的磷酸化水平,作用均强于IM。JC-1荧光染色法结果表明,C085通过直接作用于线粒体的PT孔使其开放,下调Bcl-2、上调Bax,诱导细胞凋亡,促凋亡作用强于IM。结论C085可抑制BCR-ABL+K562细胞的生长,与其抑制BCR-ABL蛋白激酶活性,下调相关信号通路;直接作用于线粒体的PT孔使其开放,激活凋亡相关蛋白,诱导细胞凋亡有关。
关键词:C085;姜黄素; IM; BCR-ABL;增殖;凋亡;机制
慢性粒细胞白血病(chronic myelogenous leukemia,CML)是发生于造血干细胞的血液系统恶性克隆增生性疾病,以t(9;22) (q34; q11)染色体易位形成的断裂点簇集区(breakpoint cluster region,BCR)-艾贝尔逊白血病病毒(Abelson leukemia virus,ABL)融合基因为主要标志,约95 %的CML患者可检出。bcr-abl融合基因表达的BCR-ABL蛋白具有持续活化、不受机体调控的酪氨酸激酶活性,并活化细胞内相关的信号转导通路,从而调控细胞的分裂与增殖,与CML的发病机制密切相关,是CML治疗的重要分子靶点[1-2]。目前,酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)已成为抗癌研究的热点,以PTK为靶点的抗癌药物研发受到世界各大制药集团的重视。
伊马替尼(imatinib,IM)又称格列卫(STI571),是最具代表性的第一代TKI,在靶向治疗CML上取得了巨大的成功。但其治疗后易复发[3]。产生耐药原因主要有Bcr-Abl激酶点突变、Bcr-Abl基因的扩增、Bcr-Abl蛋白浓度的增加、mdr-1基因及其产物P-gp的过表达,以及白血病干细胞对IM不敏感等[4-6]。目前,以达沙替尼和尼罗替尼为代表的第2代BCR-ABL酪氨酸激酶抑制剂已经上市。目前正在开发的主要有: MK-0457、伯舒替尼、INNO-406、AZD053、AP系列、PD系列等。
姜黄素(curcumin,Cur)是从姜科植物姜黄中提取的一种植物多酚,具有降血脂、抗突变、抗癌、抗氧化等生理功能[7],其价格低廉、用药安全等特点而引起众多研究者的关注。然而,Cur存在水溶性差,水溶液易水解,首过消除现象明显,生物利用度低等问题,这些因素都阻碍了其应用于肿瘤治疗[8]。而通过结构修饰获得Cur的衍生物及类似物是提高生物利用度的好方法[9]。近年来,国内外多个研究小组和机构对Cur进行结构改造和修饰,合成了一系列的Cur衍生物。本实验室也在这方面做了大量工作和研究。
C085是本实验室利用拼合原理合成的Cur衍生物(Fig 1A),我们对其与BCR-ABL激酶的结合进行了计算机模拟,发现和IM与BCR-ABL激酶的结合模式完全不同。本文以K562细胞为模型,对Cur衍生物C085的体外抗慢性粒细胞白血病细胞活性进行初步评价及探讨。
1 材料与方法
1.1材料
1.1.1药品与试剂姜黄素及姜黄素衍生物C085由本课题组合成并纯化,经质谱验证、HPLC分析鉴定,纯度为95%以上; RPMI l640培养基(Hyclone,Australia) ;新生牛血清(杭州四季青公司) ;人全血CD34+分选试剂盒(Stem Cell Technologies,Vancouver,Canada) ; AnnexinV细胞凋亡检测试剂盒、JC-1线粒体凋亡检测试剂盒、蛋白定量检测试剂盒(南京凯基生物发展有限公司) ; MTT(Sigma USA) ; Phospho-c-Abl,Phospho-Stat5 and Phospho-CrkL Multiplex Western Detection Cocktail、Bax、Bcl-2、β-actin (Cell signaling Technology,USA) ; DMSO (Sigma-Aldrich,USA) ;蛋白分子Marker(Bio-Rad,USA) ; ECL荧光底物(Amersham,USA) ;其它试剂均为进口分装分析纯。
1.1.2主要仪器5%CO2培养箱(Thermo Fisher,美国) ;免疫印迹成像系统(Carestream,加拿大) ;倒置显微镜(Olympus,日本) ;流式细胞仪(BD美国) ;酶标仪(Thermo Fisher,美国) ;台式高速冷冻离心机(Beckman,美国) ; 6孔培养板(Corning,德国)。
1.1.3细胞株及培养方法K562购自中科院上海细胞所,为人慢性粒细胞白血病(CML)急变细胞系,稳定表达BCR-ABL蛋白。用RPMI 1640+10%胎牛血清+双抗(1×105IU·L-1青霉素+ 100 mg ·L-1链霉素)培养于37℃,5% CO2饱和湿度条件下,取对数生长期的细胞用于以下实验。
1.2方法
1.2.1MTT法观察C085对细胞增殖的影响取对数生长期细胞,调整细胞浓度为1×107·L-1,接种于96孔培养板,每孔180 μL,加入不同浓度的药物,每个浓度均设3个复孔。加药后置于37℃、5% CO2饱和湿度的培养箱内培养一定时间后,每孔加入MTT (5 g·L-1) 20 μL,继续培养4 h后2 000 r·min-1离心5 min,甩板扣干,各孔再加入150 μL的DMSO,震荡溶解,在570 nm处测定OD值,计算细胞生长抑制率。实验重复3次,取平均值。
细胞生长抑制率/%=(对照组OD570值-实验组OD570值)/对照组OD570值×100%
以同一药物的不同浓度对细胞生长抑制率作图,可得到量效反应曲线,根据线性回归方程求出该药物的半数抑制浓度IC50。
1.2.2Annexin V-FITC/PI双荧光染色法检测细胞凋亡调整细胞浓度为3×108·L-1,经不同浓度药物作用24 h后,离心收集(2 000 r·min-1,5 min),用PBS洗涤细胞2次(2 000 r·min-1,5 min),收集1×105~5×105细胞,加入500 μL的Bingding buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀,室温避光反应5~15 min,流式细胞仪分析药物对K562细胞凋亡的影响。
1.2.3蛋白免疫印迹观察细胞信号蛋白的表达药物处理细胞24 h,收集细胞,以0.01 mol·L-1预冷PBS(pH 7.2)洗2次,加入去污裂解缓冲液于4℃裂解30 min,离心,吸出上清,即为细胞总蛋白,用BCA法进行蛋白定量。各组均采用同样的蛋白量上样,在SDS聚丙烯酰胺凝胶中进行电泳。电泳后转膜,封闭液封闭,加一抗4℃摇床孵育过夜,TBST洗去未结合的一抗。加二抗(1∶5 000稀释)室温摇床孵育1 h。将ECL试剂盒中的A和B两试剂等体积混合,滴加到Image Station 4000MM成像仪上。将PVDF膜正面朝下覆盖在ECL试剂上,按成像仪的操作说明进行曝光。采用Photoshop软件对图像进行灰密度分析。
1.2.4JC-1荧光染色法检测细胞线粒体膜电位变化取对数生长期细胞,调整浓度为3×108·L-1,加入0、2.5、5、10 μmol·L-1的C085及IM作用24 h后,离心收集(2 000 r·min-1,5 min),用PBS洗涤细胞2次(2 000 r·min-1,离心5 min),收集1× 105~5×105细胞,加入JC-1荧光染料,37℃,5%饱和湿度CO2培养箱反应15~20 min。室温离心收集细胞,用1×Incubation buffer洗涤两次。吸取500 μL 1×Incubation buffer重新悬浮细胞。转移入流式管中,4℃避光,冰上保存,于60 min内上机检测。流式细胞仪检测线粒体膜电位△Ψm值,通过检测红绿荧光的相对比例来衡量线粒体去极化的比例。
1.3统计学方法采用SPSS16.0统计软件进行统计分析,实验数据采用±s表示,实验独立重复3次。凡符合方差齐性的数据,采用单因素方差分析(One-way ANOVA),两组间比较采用Dunnett法。对不符合方差齐性的数据,则进行秩和检验(Kruskal Wallis法),多组间两两比较采用Mann Whiteney U法。
2 结果
2.1C085对K562细胞增殖的抑制作用用不同浓度的C085 (1.25~20 μmol·L-1)作用于K562细胞24、48和72 h,IC50分别为2.82、2.46和2.3 μmol·L-1,而Cur作用K562细胞48h的IC50为15.28 μmol·L-1(Fig 1B)。C085呈浓度、时间依赖性地抑制K562细胞的增殖,48 h的IC50低于姜黄素的1/5。

Fig 1 In vitro K562 cells-killing activity of C085
2.2C085对K562细胞凋亡的影响为了明确C085对K562细胞的杀伤作用是否与其诱导细胞凋亡有关,我们采用Annexin V-FITC/PI双荧光染色法,流式细胞术测定细胞凋亡率。
实验结果提示,C085在24 h即对K562细胞有较强的诱导凋亡作用,主要是中、晚期凋亡,10 μmol ·L-1时凋亡率可达65.9%。与阳性对照药IM相比,诱导凋亡作用明显(Fig 2,Tab 1)。
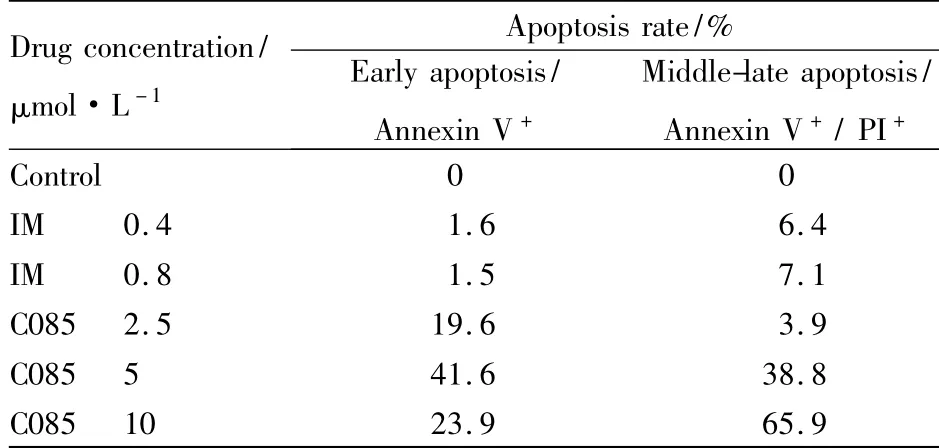
Tab 1 Effect of C085 on induction of apoptosis in K562 cells
2.3C085对K562细胞中p210BCR/ABL及其下游信号通路蛋白的影响BCR-ABL主要通过持续激活下游信号转导通路促使细胞恶性转化。BCR-ABL的下游促生长通路主要有PI3K-AKT-mTOR、Ras-Raf-MEK-ERK及Stat3、Stat5。我们已知C085可诱导K562细胞凋亡,为进一步研究其作用机制,我们采用抗磷酸化位点抗体测定p210BCR-ABL蛋白及其下游相关信号分子的磷酸化水平,从Fig 3可知,C085可浓度依赖性的下调BCR-ABL蛋白及其下游增殖相关通路信号分子的磷酸化水平,作用效果明显强于IM。
2.4C085通过线粒体凋亡途径促细胞凋亡线粒体跨膜电位的耗散被认为是细胞凋亡级联反应过程中最早发生的事件。在细胞凋亡过程中线粒体跨膜电位ΔΨm的耗散主要是由于线粒体内膜的通透性孔道(PT孔道)开放,线粒体内膜的通透性增加,细胞色素C等物质释放入胞质,触发细胞凋亡级联反应[10]。我们采用JC-1试剂盒配合流式细胞术检测C085对CML细胞线粒体跨膜电位△Ψm的影响。
从Fig 4A看出C085可对K562细胞线粒体跨膜电位产生影响,线粒体膜电位红绿比值降低,10 μmol·L-1时改变尤其明显。而IM无此作用。说明C085能够直接作用于线粒体的PT孔,引起线粒体膜电位△Ψm的改变,造成线粒体的损伤,诱导细胞凋亡。
具有增强的PTK活性的BCR-ABL蛋白,可激活其下游与增殖、凋亡相关的蛋白信号分子。那么,C085在下调BCR-ABL蛋白及其下游信号分子磷酸化活性的同时,是否也会影响其下游与增殖、凋亡相关的蛋白信号分子?我们用蛋白免疫印迹法观察Bax和Bcl-2的表达变化。Bcl-2的减少和Bax的增加,
进一步证明了C085通过线粒体凋亡途径促进细胞凋亡(Fig 4B)。
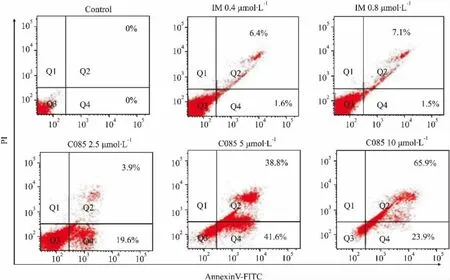
Fig 2 Effect of C085 on induction of apoptosis in K562 cells
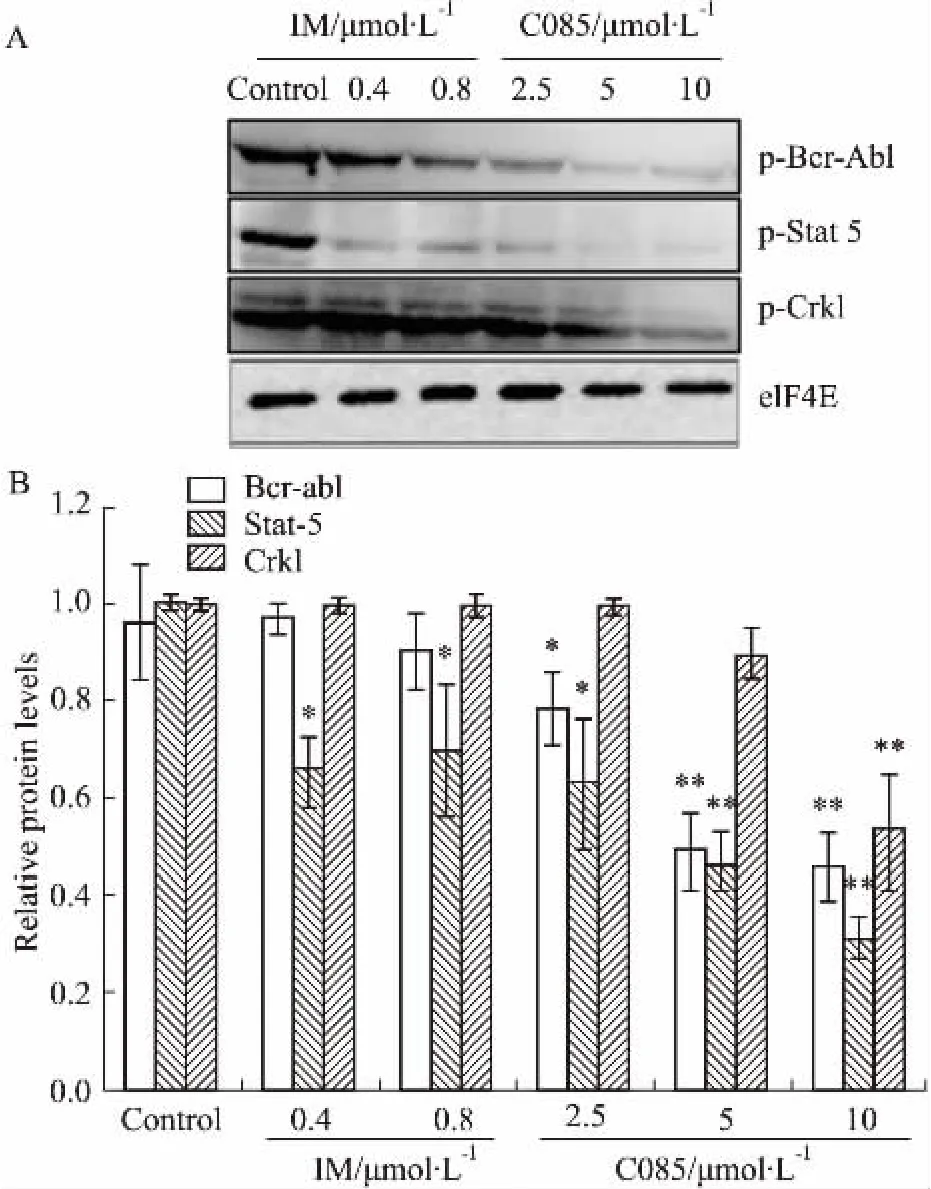
Fig 3 C085 inhibits tyrosine phosphorylation of Bcr-Abl and downstream targets
3 讨论
姜黄素单体有明显的体内外抗癌活性,诱导肿瘤细胞凋亡是其重要的作用方式,可阻断细胞周期进程于G2-S期,属于优势杀灭增殖期细胞的周期时相非特异抗癌药[11-12]。Cur可诱导BCR-ABL表达阳性的CML细胞凋亡,尤其是Cur可在短时间内明显下调CML特异的BCR-ABL蛋白含量,并抑制BCR-ABL蛋白的PTK活性,提示对CML可能有特殊的治疗意义[13]。为了进一步提高Cur的抗肿瘤活性,我们合成了一系列的衍生物,C085即是应用拼合原理的姜黄素衍生物。
在初合成的抗肿瘤活性筛选中发现C085对多种肿瘤细胞具有较强的抑制作用,在此基础上,我们对其抗CML细胞活性及机制做了初步研究。结果发现,C085对K562细胞有明显的抑制作用,呈量效和时效关系,其抑制活性明显优于姜黄素,48 h 的IC50低于姜黄素的1/5。
BCR-ABL融合蛋白是CML恶性转化的关键蛋白。与Abl蛋白酪氨酸激酶相比,其激酶活性大大增强,主要是自身磷酸化水平明显提高。可激活多条与CML恶性表型有关系的细胞信号通路,如Ras/MAPK信号通路、PI3K/AKT信号通路、CRKL有关的信号通路、Src激酶通路及Jak-STAT通路等。这些信号通路的异常使骨髓细胞发生癌变、增殖异常、分化和凋亡受到抑制。C085在2.5 μmol·L-1时即可明显抑制BCR-ABL的自磷酸化,BCR-ABL的自身磷酸化水平的下调随之抑制了其下游信号分子Stat 5、Crkl的磷酸化,具有较强的抗CML作用,呈明显的量效关系。同时,IM对BCR-ABL蛋白及其下游信号分子的磷酸化水平及蛋白含量的下调无作用或仅轻微的影响。

Fig 4 C085 triggers mitochondrial pathway of apoptosis in K562 cells
细胞凋亡是由体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程,主要有线粒体通路和死亡受体通路[14]。线粒体通路中细胞色素C (Cty-C)从线粒体向细胞质释放是很关键的一步。目前普遍认为,Cyt-C是通过线粒体PT孔或Bcl-2家族成员形成的线粒体跨膜通道释放到细胞质中的。线粒体跨膜电位ΔΨm是维持线粒体正常功能所必需的,反映线粒体功能的完整性,是评价线粒体功能的敏感指标。ΔΨm的耗散被认为是细胞凋亡级联反应过程中最早发生的事件,而PT孔道的开放会引起ΔΨm的下降。JC-1为阳离子脂质荧光染料,有单体和多聚体两种存在状态,两者的发射光谱不同。正常健康线粒体的膜电位具有极性,使JC-1被迅速摄入线粒体内,并因浓度增高而在线粒体内形成多聚体,流式细胞检测时为红色荧光(Q2象限) ;当线粒体跨膜电位降低时,JC-l从线粒体内释放,红光强度减弱,以单体的形式存在于胞质内,流式细胞检测时为绿色荧光(Q4象限),红/绿比值能较好的反映线粒体膜电位的高低[15]。JC-1试剂盒配合流式细胞术检测结果表明,C085能够直接作用于线粒体的PT孔使其开放,降低膜电位,造成线粒体损伤从而诱导细胞凋亡。而IM无此作用。
CML的BCR-ABL癌蛋白主要通过影响Bcl-2 ?家族蛋白抑制细胞凋亡。Bcl-2家族蛋白主要位于线粒体内外膜、内质网膜及细胞核外膜,其可形成离子通道或小孔,从而直接影响线粒体膜通透性以调节线粒体Cty-C、凋亡诱导因子(apoptosis inducing factor,AIF)等的释放,从而调节caspases的活化抑制或促进凋亡。抗凋亡蛋白Bcl-2可通过抑制线粒体释放Cty-C和直接与Apaf-1结合,抑制“Cty-CApaf-1-pro caspase-9”复合物的形成来抑制细胞凋亡,促凋亡蛋白Bax的作用正好相反。此外Bcl-2还可以反阻断线粒体及内质网释放Ca2+,降低Ca2+超载及阻止与细胞凋亡相关Ca2+依赖性核酸内切酶的活化而阻止caspase-9的激活;将caspases运输到细胞内的膜结构(如线粒体膜),阻止caspases活化[16]; Bcl-2还是一种抗氧化剂,可抑制氧自由基的产生,减少细胞凋亡发生。我们的研究结果(Fig 3B)可看出C085可以引起Bcl-2的减少和Bax的增加,这进一步证明了C085可通过线粒体凋亡途径促细胞凋亡,而IM组相关蛋白的变化均没有C085组明显,说明其促凋亡作用弱于C085,这与之前MTT及流式检测细胞凋亡率的结果相符。
综上所述,C085可抑制BCR-ABL+CML细胞的生长与其抑制BCR-ABL蛋白激酶活性,下调相关信号通路有关。BCR-ABL基因是重要的抑制凋亡基因之一,而其编码的融合蛋白质是细胞恶性转化的根本原因,C085能以此为作用靶点,抑制其表达,将有望从发病本质上杀伤CML细胞。
(本课题完成于福建省天然药物药理学重点实验室,在此对实验室的各位老师、同学的帮助表示由衷的感谢! )
参考文献:
[1]Federico Innocenti.Genomics and pharmacogenomics in anticancer drug development and clinical response[M].New Jersey: Humana Press,2009:127-50.
[2]Deininger M W,Goldman J M,Melo J V.The molecular biology of chronic myeloid leukemia[J].Blood,2000,96(10) :3343-56
[3]Kagita S,Uppalapati S,Jiwatani S,et al.Incidence of Bcr-Abl kinase domain mutations in imatinib refractory chronic myeloid leukemia patients from South India[J].Tumor Biol,2014,35(7) : 7187-93.
[4]Von Bubnoff N,Schneller F,Peschel S,Duyster J.BCR-ABL gene mutations in relation to clinical resistance of Philadelphia-chromosome-positive leukaemia to STI571: a prospective study[J].Lancet,2002,359: 487-91.
[5]Perl A,Carroll M.BCR-ABL kinase is dead; long live the CML stem cell[J].J Clin Invest,2011,121: 22-5.
[6]Corbin A S,Agarwal A,Loriaux M,et al.Human chronic myeloid leukemia stem cells are insensitive to imatinib despite inhibition of BCR-ABL activity[J].J Clin Invest,2011,121(1) : 396-409.
[7]富徐燕,赵丕文,李亚东,等.姜黄素对人循环纤维细胞增殖及COLⅠ表达影响的研究[J].中国药理学通报,2014,30(7) : 942-7.
[7]Fu X Y,Zhao P W,Li Y D,et al.Effects of Curcumin on proliferation and COLⅠexpression of human Circulating fibrocytes[J].Chin Pharmacol Bull,2014,30(7) :942-7.
[8]Anand P,Kunnumakkara A B,Newman R A,Aggarwal B B.Bioavailability of curcumin: problems and promises[J].Mol Pharm,2007,4:807-18.
[9]Mosley C A,Liotta D C,Snyder J P.Highly active anticancer curcumin analogues[J].Adv Exp Med Biol,2007,595:77-103.
[10]Green D R,Kroemer G.The pathophysiology of mitochondrial cell death[J].Science,2004,305(5684) :626-9
[11]许建华,陈元仲,赵蓉,柯丹如.姜黄素对人白血病K562细胞凋亡的影响[J].中药药理与临床,1998,14:19-22.
[11]Xu J H,Chen Y Z,Zhao R,Ke D R.Effects of Curcumin on inducing apoptosis of K562 cells[J].Pharmacol Clin Chin Mat Med,1998,14:19-22.
[12]许建华,赵蓉,柯丹如,黄自强.姜黄素对人肝癌Bel7402细胞杀伤动力学及周期时相的影响[J].福建医科大学学报,1998,32:236-9.
[12]Xu J H,Zhao R,Ke D R,Huang Z Q.Effect of Curcumin on Cellkill Kinetics and Cell Cycle Phases of Human Hepatocarcinoma Bel7402 Cell[J].J Fujian Med Univ,1998,32:236-9.
[13]Xu J H,Chen Y Z.Huang X W.Curcumin inducing apoptosis and inhibiting expression of P210bcr-abl protein in human chronic myelogenous leukemia K562 cells[J].FASEB J,2000,14(8) :1169.
[14]刘丽君,彭建新,洪华珠,等.线粒体在细胞凋亡中的变化与作用[J].细胞生物学杂志,2005,27:117-20.
[14]Liu L J,Peng J X,Hong H Z,et al.Mitochondrial changes and role in apoptosis[J].Chin J Cell Biol,2005,27:117-20.
[15]郑艇.PARP-1依赖性程序性细胞死亡(Parthanatos)在布比卡因致SH-SY5Y细胞损伤中作用的研究[D].南方医科大学,2014.
[15]Zheng T.Research on the role of PARP-1-dependent programmed cell death(Parthanatos) in bupivacaine induced SH-SY5Y cell damage[D].Southern medical university,2014.
[16]朱玉山,卢铁元,王蕊,等.Bcl-2家族蛋白调控线粒体膜通透性和细胞色素C释放的新机制生命科学[J].生命科学,2011,23(11) :1076-81.
[16]Zhu Y S,Lu T Y,Wang R,et al.Functional conversion of Bcl-2 into a pro-apoptotic molecule to regulate mitochondrial cytochrome c release[J].Chin Bull Life Sci,2011,23(11) :1076-81.
◇复方药物药理学◇
Effects of curcumin derivatives C085 on K562 cells and its mechanism
WU Ying1,2,CHEN Rui-jia1,WU Li-xian1,XU Jian-hua1
(1.Fujian Key Laboratory of Natural Medicine Pharmacology,2.Dept of Natural Medicines,School of Pharmacy,Fujian Medical University,Fuzhou 350108,China)
Abstract:AimTo explore the anti-proliferation and apoptotic effects of C085,a curcumin derivative,on K562 cells and its mechanism.Methods MTT assay and flow cytometry were used to examine cell proliferation and apoptosis,respectively.The phosphorylation levels of Bcr-Abl initiated signaling proteins were analyzed using Western blot.Results The results showed that C085 suppressed the growth of K562 cells and the IC(50)value was about 5-fold lower than that of Cur.C085 also induced significant apoptosis on K562 cells in 24 hours when compared with imatinib.Western blot results demonstrated that C085 down-regulated the phosphorylation of Bcr-Abl in K562 cells in a dose-dependent manner.The phosphorylation of Stat 5 and Crkl,which were downstream signaling proteins of Bcr-Abl kinase,was also inhibited by C085.C085 caused the opening of mitochondrial PT holes as detected by JC-1 fluorescent,which inhibited Bcl-2 and enhanced Bax,then induced apoptosis.ConclusionC085 inhibited BCR-ABL+K562 cells through inhibiting BCRABL kinase activity and down-regulating its downstream signal proteins.Directly acting on mitochondrial PT hole and then activating apoptosis-associated proteins are also involved in the pro-apoptotic effect of C085.
Key words:C085; curcumin derivative; IM; BCRABL; proliferation; apoptosis; mechanism
作者简介:吴莺(1979-),女,硕士,讲师,研究方向:药理学,Tel: 0591-22862016,E-mail: wuying97414@ tom.com;许建华(1958-),男,博士,教授,研究方向:药理学,E-mail: xjh@ mail.fjmu.edu.cn
基金项目:福建省教育厅中青年教师资助项目(No JA13150)
收稿日期:2015-02-19,修回日期:2015-03-26
文献标志码:A
文章编号:1001-1978(2015) 06-0870-06中国图书分类号: R282.71; R284.1; R329.24; R329.25
doi:10.3969/j.issn.1001-1978.2015.06.026

