苯甲醛左氧氟沙星席夫碱诱导人肝癌细胞凋亡作用
霍 菲,唐乃夫,范媛媛,刘诗濛,张 莹,梁红霞,胡国强,刘 彬
(河南大学1.护理学院神经生物学研究所、2.淮河临床学院、3.药学院,河南开封 475004)
苯甲醛左氧氟沙星席夫碱诱导人肝癌细胞凋亡作用
霍菲1,唐乃夫1,范媛媛1,刘诗濛2,张莹2,梁红霞1,胡国强3,刘彬1
(河南大学1.护理学院神经生物学研究所、2.淮河临床学院、3.药学院,河南开封475004)
摘要:目的研究苯甲醛左氧氟沙星席夫碱化合物对人肝癌SMMC-7721细胞凋亡的诱导作用。方法用不同浓度的(S) -1,8-(2-甲基亚乙氧基) -6-氟-7-(4-甲基-哌嗪-1-基) -3-[S-苄基硫基-4-(对硝基苯甲叉基氨基) -1,2,4-均三唑-3-基]-喹啉(1-H) -4-酮(M18)与SMMC-7721细胞、人乳腺癌细胞MB-231、人结肠癌细胞HCT-116、人肝癌细胞HEPG-2和小鼠骨髓间充质干细胞体外培养。MTT法检测M18对各种细胞的生长抑制作用; Hoechst 33258荧光染色法、TUNEL法检测细胞凋亡变化;高内涵活细胞成像系统测定细胞线粒体膜电位(△ψm)变化; Western blot方法测定caspase-3、p53蛋白表达量的改变,以及细胞色素C在线粒体内外的分布。结果M18在4~32 μmol·L(-1)的浓度范围内能明显抑制SMMC-7721细胞、MB-231细胞、HCT-116细胞、HEPG-2细胞增殖,呈浓度、时间依赖关系,作用于细胞24 h的IC(50)值分别为8.65、9.37、12.74和9.40 μmol·L(-1);左氧氟沙星盐酸盐作用于SMMC-7721细胞24 h的IC(50)值为735.10 μmol· L(-1),M18作用于骨髓间充质干细胞24 h的IC(50)值为38.96 μmol·L(-1);不同浓度M18作用人肝癌SMMC-7721细胞24 h,细胞凋亡率高于对照组(P<0.05)。M18作用于SMMC-7721细胞后,细胞线粒体膜电位降低,与对照组相比差异有统计学意义; M18明显增加SMMC-7721细胞的p53和caspase-3蛋白表达量,其中caspase-3活性裂解片段增加明显; M18作用使细胞线粒体内细胞色素C明显减少,胞质内细胞色素C明显增加。结论苯甲醛左氧氟沙星席夫碱能够诱导人肝癌细胞凋亡,作用与线粒体凋亡通路有关。
关键词:氟喹诺酮席夫碱;肝癌细胞;细胞增殖;凋亡;线粒体膜电位; p53
氟喹诺酮羧酸是一类广泛应用于临床的化学合成抗菌药物,作用靶点是细菌的DNA回旋酶(gyrase),抑制细菌增殖[1]。真核生物的拓扑异构酶Ⅱα和Ⅱβ的一级结构序列与细菌的回旋酶非常相似,其中拓扑异构酶ⅡN端结构域(1-670氨基酸)与DNA回旋酶的B亚基(GyrB)具有同源性。拓扑异构酶Ⅱ的中部结构域(671-1200氨基酸)与DNA回旋酶的A亚基(GyrA)具有同源性,结构中包含的酪氨酸活性位点对催化DNA断裂和再连接十分必要[2]。目前,已有多种临床应用抗肿瘤药物的作用靶酶是拓扑异构酶Ⅱ[3]。部分抗菌氟喹诺酮羧酸对真核细胞增殖有较弱的抑制作用,例如环丙沙星、诺氟沙星、氧氟沙星等[4]。课题组的前期研究结果显示,将氟喹诺酮羧酸的C-3羧基与酰腙类化合物结合所合成的新型氟喹诺酮衍生物对拓扑异构酶Ⅱ具有较强的抑制作用[5-6],促进拓扑异构酶Ⅱ介导的PBR332质粒DNA解旋和断裂,抑制DNA再连接反应,作用与临床应用的拓扑异构酶Ⅱ毒剂依托泊苷一致[7-8]。本研究以左氧氟沙星为先导化合物,用12种结构单元替代左氧氟沙星分子结构的C-3羧基,合成一系列左氧氟沙星C-3酰腙衍生物。其中苯甲醛左氧氟沙星席夫碱(S) -1,8-(2-甲基亚乙氧基) -6-氟-7-(4-甲基-哌嗪-1-基) -3-[S-苄基硫基-4-(对硝基苯甲叉基氨基) -1,2,4-均三唑-3-基]-喹啉(1-H) -4-酮(M18,Fig 1)活性最强,IC50值达8.65 μmol·L-1,具有进一步研究开发的价值。

Fig 1 Structure of(S) -1,8-(2-methyl phosphate ethoxy) -6-fluorine-7-(4-methyl-piperazine-1-base) -3-[S-benzyl s-based-4-(for nitrobenzene methylene group amino) -1,2,4-all triazole-3-base]-quinoline (1-H) -4-ketone
1 材料与方法
1.1主要试剂与仪器
1.1.1诱导剂苯甲醛左氧氟沙星席夫碱由河南大学化学生物学研究所设计、改造并合成,HPLC法测定纯度>99%,溶解在二甲基亚砜(DMSO,Solarbio公司)中,浓度为1×10-2mol·L-1。
1.1.2细胞株和主要试剂人肝癌细胞系SMMC-7721和HEPG-2、人乳腺癌细胞MB-231、人结肠癌细胞HCT-116购自中国医学科学院基础医学研究所,生长在含体积分数为0.1的胎牛血清(杭州四季青生物工程材料有限公司)的DMEM培养基(Gibco公司)中,置体积分数为0.05的CO2、37℃恒温培养。
四甲基偶氮唑盐(MTT),DeadEndTMFluorometric TUNEL System(Promega公司) ;线粒体分离试剂盒(上海碧云天生物技术有限公司) ; caspase-3、p53、细胞色素C抗体(Cell Signaling Technology) ;β-actin抗体、HRP标记的羊抗兔IgG、HRP标记的羊抗鼠IgG(中杉金桥公司) ; Hoechst 33258 (Sigma公司)。其余试剂为国产分析纯产品。
1.1.3主要仪器二氧化碳培养箱(Thermo Forma,3121,USA) ;酶标仪(Thermo Multiskan Ascent,USA) ; BX51荧光显微镜(Olympus公司) ; DYY-7C型转移电泳仪、垂直电泳仪、半干式电转装置、凝胶成像系统(北京六一仪器厂) ;高内涵活细胞成像系统(Thermo Fisher Scientific,USA)。
1.2方法
1.2.1MTT法测定药物对细胞增殖的影响细胞以16×107·L-1浓度接种于96孔细胞培养板,加入不同浓度的M18,分别培养24、48、72 h后吸去培养液,每孔加入DMSO 0.15 ml振荡10 min,至蓝色结晶完全溶解,酶标仪测570 nm吸收度(A)值并计算抑制率。以含等体积的培养液和DMSO的无细胞孔测的吸光度值为空白对照。根据中效方程式[fa/fu=(D/Dm) m]计算出中效浓度(IC50)[9]。细胞生长抑制率/%=[1-(处理组吸收度-空白对照组吸收度)/(对照组吸收度-空白对照组吸收度)]×100%。
1.2.2骨髓间充质干细胞(BMSCs)的分离培养法取C57BL/6J小鼠两只,6~8周龄。在无菌条件下迅速取出双下肢骨,用含10%胎牛血清的低糖DMEM培养液冲洗骨髓腔,再用4号针头吹打细胞制成单细胞悬液,按照600×107·L-1到800×107·L-1的密度接种至培养瓶中,培养48 h后,每3天更换培养液,细胞密度达80%后传代培养。
1.2.3Hoechst 33258染色法观察细胞凋亡形态变化
细胞以1×108·L-1浓度接种于放置盖玻片的6孔板,待细胞贴壁后,加入不同浓度的M18培养24 h,PBS洗2次,多聚甲醛固定15 min,30 μL Hoechst 33258工作液于盖玻片上,室温染色10 min。PBS漂洗2次,中性甘油封片,荧光显微镜下观察并记录。
1.2.4TUNEL法测定细胞凋亡率取1×108·L-1细胞数接种细胞于放置盖玻片的6孔板,用不同浓度的M18作用24 h,按Promega公司的试剂盒说明书操作,检测细胞凋亡率。
1.2.5线粒体膜电位(△ψm)测定以8×107· L-1的浓度接种细胞到6孔板,用不同浓度的M18培养24 h,每孔加入1 mL的Rh-123稀释液1 h,PBS 洗3遍,加入终浓度为5 mg·L-1的Hoechst 33342避光染色10 min,PBS洗涤,高内涵活细胞成像系统观察分析。
1.2.6线粒体蛋白的分离常规收集经不同浓度M18作用24 h的细胞,12 000 r·min-1离心10 min,PBS洗涤,按照细胞线粒体分离试剂盒说明书提取细胞线粒体蛋白与胞质蛋白。
1.2.7Western blot检测蛋白表达不同浓度M18作用细胞24 h,RIPA裂解液200 μL充分裂解细胞,4℃离心(12 000 r·min-1) 5 min提取蛋白,考马斯亮蓝G250法分光光度计测样品蛋白浓度,12% SDSPAGE电泳分离。电转移蛋白至PVDF膜,5%脱脂奶粉封闭1 h,一抗(1∶2 000) 4℃封闭过夜,二抗(HRP标记的羊抗兔或羊抗鼠抗体1∶4 000)孵育1 h,化学发光法显示结果,凝胶图像分析系统拍照。
1.3统计学分析所有资料均采用SPSS 14.0软件包进行统计学处理。计量资料用±s表示,组间比较采用t检验分析。
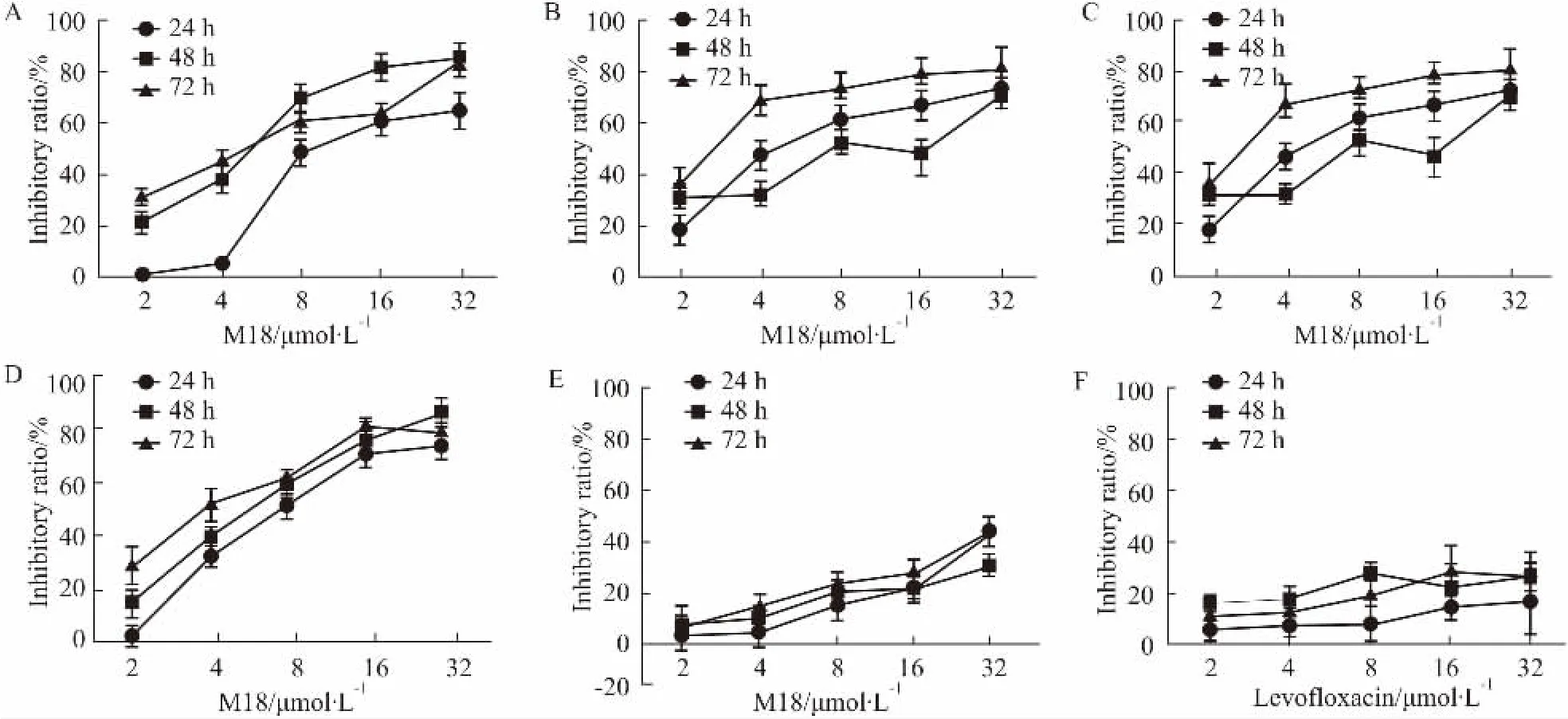
Fig 2 Proliferation inhibition effect of M18 and levofloxacin on human cancer cells and BMSCs
2 结果
2.1M18对各种肿瘤细胞和小鼠骨髓间充质干细胞增殖的抑制作用不同浓度的M18分别作用于SMMC-7721、MB-231、HCT-116和HEPG-2细胞24、48 和72 h,M18对肿瘤细胞有较强增殖抑制作用,并呈时间与浓度依赖关系,24 h的IC50值分别是8.65 μmol·L-1(r2=0.8841)、9.37 μmol·L-1(r2=0.8523)、12.74 μmol·L-1(r2=0.7994)和9.40 μmol ·L-1(r2=0.8218) ; M18分别作用于骨髓间充质干细胞24、48和72 h,对细胞的增殖抑制作用不明显,24 h的IC50值为38.96 μmol·L-1(r2=0.7822) ; M18合成原料左氧氟沙星对人肝癌SMMC-7721细胞增殖的影响不明显,24 h的IC50值为735.10 μmol·L-1(r2=0.6854) (Fig 2)。
2.2M18诱导SMMC-7721细胞凋亡作用Hoechst 33258染色结果显示,M18作用于SMMC-7721细胞24 h,出现细胞膜皱缩、染色质凝集、核呈碎片状等凋亡形态学变化(Fig 3)。TUNEL结果显示,随着M18浓度增加,凋亡细胞明显增多,呈浓度依赖性(Fig 4,Tab 1)。
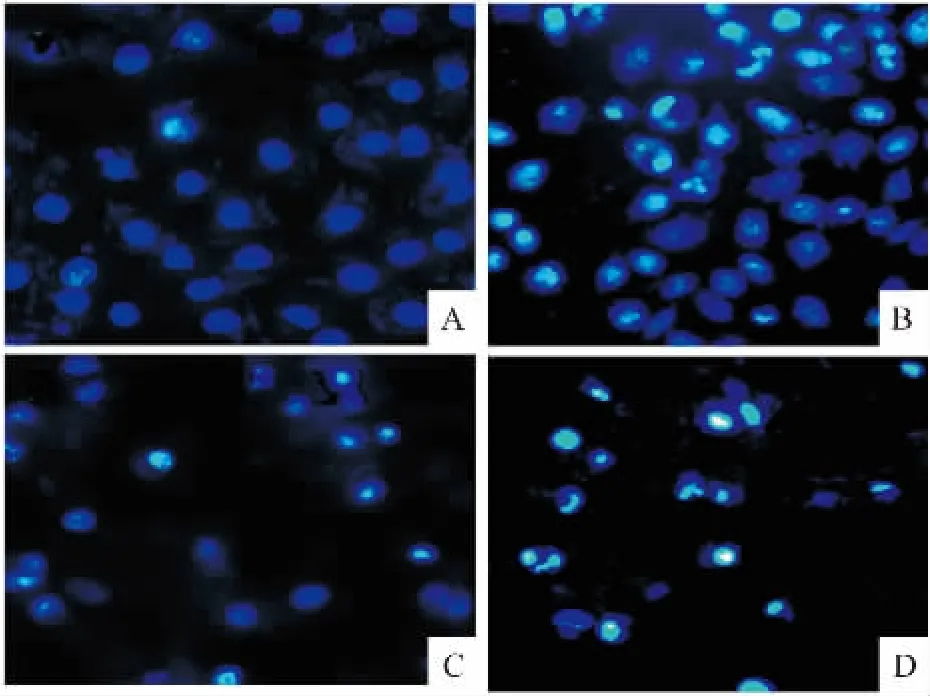
Fig 3 SMMC-7721 cell apoptosis under fluorescent microscope stained by Hoechst 33258 (×200)
2.3M18对线粒体膜电位的影响Rh-123荧光强度可以间接反映线粒体膜的破坏程度。M18作用于SMMC-7721细胞24 h,随着化合物浓度增加,荧光强度逐渐增大,表明细胞线粒体膜电位降低,与对照组比较,分别降低(8.97±4.15) %、(31.82±5.29) %、(47.25±6.03) %,差异有统计学意义(P<0.01),见Fig 5。
2.4M18对p53、caspase-3蛋白表达和细胞色素C线粒体内外分布的影响以2.467、8.650、26.401 μmol·L-1M18分别作用于SMMC-7721细胞24 h,Western blot法检测p53、caspase-3的表达和细胞色素C线粒体内外分布。与对照组相比,M18作用后细胞p53蛋白表达明显增加,呈明显的浓度依赖关系,caspase-3蛋白表达量增多,活性片段增多。细胞线粒体内细胞色素C分布降低,细胞质内细胞色素C分布增多,提示M18诱导SMMC-7721细胞凋亡作用可能与线粒体凋亡通路有关,见Fig 6。

Fig 4 Induction of apoptosis of SMMC-7721 cells treated with M18 for 24 h evaluated by TUNEL assay
Tab 1 Apoptotic effects of M1?8 on SMMC-7721 cells (±s,n=9)

Tab 1 Apoptotic effects of M1?8 on SMMC-7721 cells (±s,n=9)
*P<0.05 vs control
Group Dose/μmol·L-1Apoptotic ratio/% Control 0.0113±0.00418 M18 2.476 0.1950±0.01586*8.650 0.3822±0.03639*26.401 0.5306±0.06966*
3 讨论
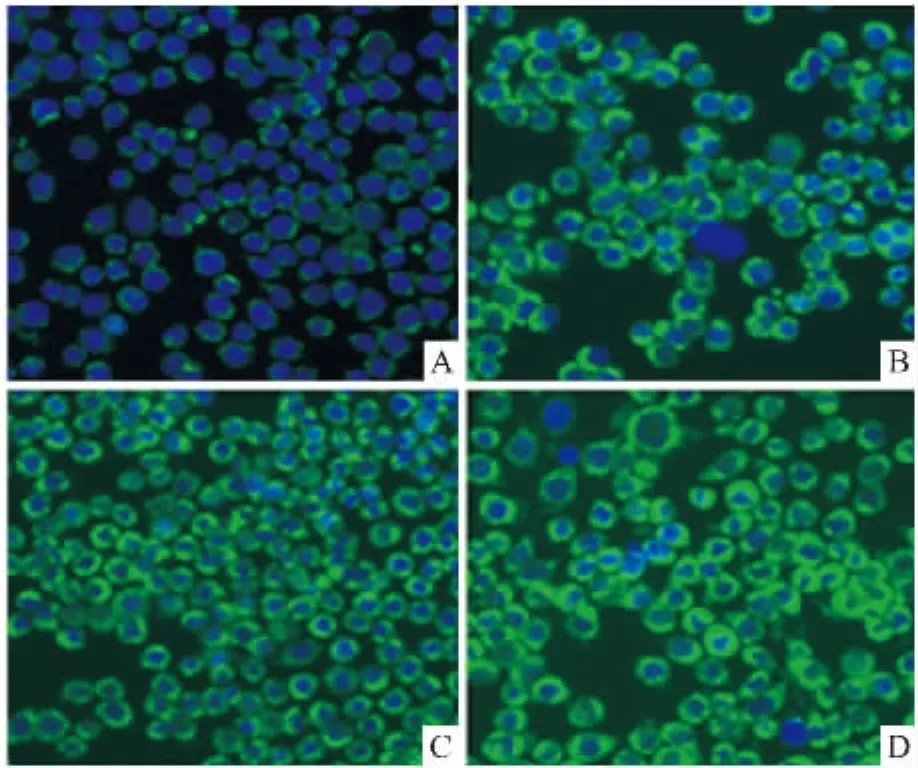
Fig 5 Changes in MMP of SMMC-7721 cells induced by M18 for 24 h and analyzed by HCS after staining with Rh-123
部分临床常用的氟喹诺酮类抗菌药物对真核细胞的拓扑异构酶Ⅱ有较弱的抑制作用[10]。研究发现,氟喹诺酮羧酸C-3位羧基对抗菌活性必需,对抗肿瘤活性并非必要,为寻找新型抗肿瘤氟喹诺酮候选物提供思路[11-12]。本课题组以左氧氟沙星为底物,用结构单位替代C-3位羧基,合成12种左氧氟沙星衍生物,用MTT法检测12种喹诺酮类衍生物对SMMC-7721细胞增殖的抑制作用,多数化合物显示出对SMMC-7721细胞的不同程度生长抑制作用,IC50值在50 μmol·L-1以下,其中M18对细胞的增殖抑制作用效果最好,24h的IC50值达8.65 μmol· L-1,其合成原料左氧氟沙星对SMMC-7721细胞增殖的影响不明显,IC50值达735.10 μmol·L-1,说明化合物改造符合理论推测,具有较好的研究开发价值。为了解M18对各种肿瘤组织作用的差异,本研究选用4种不同类型的肿瘤细胞株(结肠癌HTC-116细胞、乳腺癌MB-231细胞、人肝癌HEPG-2细胞、人肝癌SMMC-7721细胞),检测M18对细胞的生长抑制作用。结果证明,M18对多种肿瘤细胞均有明显增殖抑制作用,并呈时间与浓度依赖性。本研究同时应用原代培养骨髓间充质干细胞,检测M18的细胞生长抑制作用,IC50值为38.96 μmol· L-1,明显高于M18对SMMC-7721细胞作用的IC50值。说明M18对肿瘤细胞具有较好的选择性,在未来临床应用中可能具有较小的毒副作用。
本课题组前期实验已经证明,经C-3羧基改造的氟喹诺酮衍生物的作用靶点是DNA拓扑异构酶Ⅱ,造成肿瘤细胞的DNA损伤,这种作用可能激活p53蛋白,诱导细胞凋亡[13-14]。本实验应用Western blot法检测p53表达量的改变,提示M18杀伤SMMC-7721细胞的作用可能通过DNA损伤,p53增加,进而诱导细胞进入凋亡途径。应用Hoechst 33258荧光染色法观察SMMC-7721细胞核形态变化,观察到M18作用24h凋亡SMMC-7721细胞增加,表现为细胞核染色质凝集、核边移、核碎裂,出现凋亡小体等凋亡细胞核形态学改变。TUNEL法显示,随着M18浓度增加,细胞凋亡率明显升高。Western blot结果也证明,随着M18浓度的增加,caspase-3表达量增多,裂解片段增加。说明通过激活caspase-3途径诱导细胞凋亡[15]。从理论上推测,p53介导的凋亡通路以线粒体凋亡通路为主。本研究用M18导致SMMC-7721细胞线粒体内细胞色素C流出,线粒体膜电位下降,说明M18诱导细胞凋亡主要通过线粒体凋亡通路进行。
综上所述,经改造后的氟喹诺酮衍生物M18明显抑制肿瘤细胞的增殖,并有较好的选择抑制作用,M18诱导人肝癌SMMC-7721细胞凋亡,此作用与线粒体凋亡通路有关。

Fig 6 Effects of M18 on caspase-3,p53 protein expressions and release of cytochrome C from mitochondria to cytosol in SMMC-7721 cells
参考文献:
[1]Rhee H K,Park H J,Lee S K,et al.Synthesis,cytotoxicity,and DNA topoisomerase II inhibitory activity of benzofuroquinolinediones[J].Bioorg Med Chem,2007,15(4) :1651-8.
[2]McClendon AK,Osheroff N.DNA topoisomerase II,genotoxicity,and cancer[J].Mutat Res,2007,623(1-2) : 83-97.
[3]Pogorelˇcnik B,Perdih A,Solmajer T.Recent developments of DNA poisons-human DNA topoisomerase IIα inhibitors-as anticancer agents[J].Curr Pharm Des,2013,19(13) : 2474-88.
[4]Williams G M,Brunnemann K D,Smart D J,et al.Relationship of cellular topoisomerase IIalpha inhibition to cytotoxicity and published genotoxicity of fluoroquinolone antibiotics in V79 cells[J].Chem Biol Interact,2013,203(2) : 386-90.
[5]Shi Z Y,Li Y Q,Kang Y H,et al.Piperonal ciprofloxacin hydrazone induces growth arrest and apoptosis of human hepatocarcinoma SMMC-7721 cells[J].Acta Pharmacol Sin,2012,33(2) : 271-8.
[6]付建民,王德辉,孙金平,等.对甲氧基肉桂醛左氧氟沙星酰腙诱导人肝癌SMMC-7721细胞凋亡的作用[J].中国药理学通报,2011,27(6) :801-5.
[6]Fu J M,Wang D H,Sun J P,et al.p-Methoxycinnamaldehyde levofloxacin-3-ylhydrazone induces apoptosis of human hepatocarcinoma SMMC-7721 cells[J].Chin Pharmacol Bull,2011,27 (6) : 801-5.
[7]Sun J P,Shi Z Y,Liu S M,et al.Trimethoxy-benzaldehyde levofloxacin hydrazone inducing the growth arrest and apoptosis of human hepatocarcinoma cells[J].Cancer Cell Int,2013,13(1) : 67.
[8]任争,康玉华,石贞玉,等.肉桂醛氧氟沙星酰腙诱导人肝癌SMMC-7721细胞凋亡的作用[J].药学学报,2010,45(9) :1109 -15.
[8]Ren Z,Kang Y H,Shi Z Y,et al.Cinnamaldehyde ofloxacin-3-ylhydrazone induces apoptosis of human hepatocarcinoma SMMC-7721 cells[J].Acta Pharm Sin,2010,45(9) : 1109-15.
[9]皇甫超申,马永超,房娜,等.三氮唑席夫碱衍生物对人肝癌细胞分化和凋亡的影响[J].中国药理学通报,2008,24(4) : 498-503.
[9]Huangfu C S,Ma Y C,Fang N,et al.Effects of trizole Schiff base derivative on the differentiation and apoptosis of human hepatocarcinoma cells[J].Chin Pharmacol Bull,2008,24(4) : 498-503.
[10]Kamat A M,DeHaven J I,Lamm D L.Quinolone antibiotics: a potential adjunct to intravesical chemotherapy for bladder cancer [J].Urology,1999,54(1) : 56-61.
[11]胡国强,毋晓魁,王新,等.氟喹诺酮C3杂环取代衍生物的合成及抗肿瘤活性研究(I) :环丙沙星噻二唑希夫碱[J].药学学报,2008,43(11) :1112-5.
[11]Hu G Q,Wu X K,Wang X,et al.Synthesis and antitumor activity of C3 heterocyclic-substituted floroquinolone derivatives (I) : ciproflxacin aminothiodiazole Schiff-bases[J].Acta Pharm Sin,2008,43(11) : 1112-5.
[12]You Q D,Li Z Y,Huang C H,et al.Discovery of a novel series of quinolone and naphthyridine derivatives as potential topoisomerase I inhibitors by scaffold modification[J].J Med Chem,2009,52(18) :5649-61.
[13]Sheng Z,Cao X,Peng S,et al.Ofloxacin induces apoptosis in microencapsulated juvenile rabbit chondrocytes by caspase-8-dependent mitochondrial pathway[J].Toxicol Appl Pharmacol,2008,226(2) :119-27.
[14]Smart D J,Halicka H D,Traganos F,et al.Ciprofloxacin-induced G2 arrest and apoptosis in TK6 lymphoblastoid cells is not dependent on DNA double-strand break formation[J].Cancer Biol Ther,2008,7(1) :113-9.
[15]E Kuranaga.Beyond apoptosis: caspase regulatory mechanisms and functions in vivo[J].Genes Cells,2012,17(2) : 83-97.
Benzaldehyde levofloxacin schiff base induces apoptosis of human hepatocarcinoma cells
HUO Fei1,TANG Nai-fu1,FAN Yuan-yuan1,LIU Shi-meng2,ZHANG Ying2,
LIANG Hong-xia1,HU Guo-qiang3,LIU Bin1
(1.Institute of Neurobiology,College of Nursing,2.Huaihe Clinical College,3.College of Pharmacy,Henan University,Kaifeng Henan 475004,China)
Abstract:AimTo study the effect of (S) -1,8-(2-methyl phosphate ethoxy) -6-fluorine-7-(4-methyl- piperazine-1-base) -3-[S-benzyls-based-4-(for nitrobenzene methylene group amino) -1,2,4-all triazole-3 base]-quinoline(1-H) -4-ketone (M18) on apoptosis of hepatocarcinoma SMMC-7721 cells in vitro.Methods With different concentrations of M18 at different time used to treat SMMC-7721 cells,human breast cancer MB-231cells,human colon cancer HCT-116 cells,human hepatocarcinoma HEPG-2 cells,mouse bone marrow mesenchymal stem cells (BMSCs) in vitro,the inhibition effects of M18 on cell proliferation were examined by MTT assay.Cell apoptosis was determined using Hoechst 33258 fluorescence staining and TUNEL method.Mitochondrial membrane potential (△ψm) was measured using a high content screening image system.Protein expression of caspase-3,p53 and cytochrome C was detected with Western blot analysis.ResultsTreatment with M18 (4~32 μmol·L(-1)) potently inhibited the proliferation of the cancer cells in time-and dose-dependent manners (the IC(50)value at 24 h in SMMC-7721 cells,MB-231cells, HCT-116 cells and HEPG-2 cells was 8.65 μmol· L(-1),9.37 μmol·L(-1),12.74 μmol·L(-1)and 9.40 μmol·L(-1),respectively).In contrast,M18 had weak cytotoxicity against BMSCs with IC(50)value of 38.96 μmol·L(-1).Levofloxacin had weak cytotoxicity against SMMC-7721 cells with IC(50)value of 735.10 μmol·L(-1).Treatment of SMMC-7721cells with different concentrations of M18 for 24 h increased the percentage of the apoptosis cells (P<0.05) and decreased the mitochondrial membrane potential.In addition,M18 increased protein expression of p53,caspase-3 and the cleaved activated forms of caspase-3 in SMMC-7721 cells.Treatment of SMMC-7721 cells with M18 significantly increased cytochrome C in the cytosol,and decreased cytochrome C in the mitochondrial compartment.ConclusionThe mitochondrialdependent pathways are involved in M18 induction of apoptosis of SMMC-7721 cells.
Key words:fluoroquinolones schiff base; hepatocarcinoma cells; cell proliferation; apoptosis; mitochondrial membrane potential; p53
作者简介:霍菲(1990-),女,硕士生,研究方向:肿瘤分子药理学,E-mail: 805767095@ qq.com;刘彬(1959-),男,硕士,教授,硕士生导师,研究方向:肿瘤分子生物学,通讯作者,Tel: 0371-23880399,E-mail: lbgood5912@ sina.com
基金项目:国家自然科学基金资助项目(No 21072045) ;河南省科技厅科技攻关重点项目(No 112102310307)
收稿日期:2015-01-25,修回日期:2015-03-20
文献标志码:A
文章编号:1001-1978(2015) 06-0821-06中国图书分类号: R329.25; R735.702.2; R979.1
doi:10.3969/j.issn.1001-1978.2015.06.017

