超临界流体构筑微粒技术作为药物制剂研发平台的应用
朱 彬,洪鸣凰,任福正,任国宾
(华东理工大学药学院药物晶体工程与技术实验室,上海200237)
研究一种新型有效的药物递送系统一直是制药工业的热点[1],尤其是对于难溶性、组织毒性、体内易分解、难以代谢、生物利用度差和目标组织靶向性差的药物[2-3]。药物递送过程主要包括治疗药物进入人体,在体内药物活性成分的释放和吸收,然后生物活性物质跨过生物膜进入组织,到达靶点。近年来,越来越多的候选药物被开发,这些候选药物在构效关系或者体外活性都有良好的效果。但其中大部分候选药物都存在溶解性差问题,导致生物利用度不佳,往往是阻碍其通过临床研究的一大障碍。随着新的药物递送系统研究的进一步深入,固态药物的微粒设计在药物制剂开发中占有越来越重要的地位。
超临界流体技术,作为一种绿色环保的技术,可作为许多传统微粒构筑技术的替代[4]。超临界流体技术在药物递送系统创新的应用,主要包括纳微米级药物粒子制备、复合微粒制剂和固体药物晶型控制等[5-6]。超临界流体技术根据粒子微观结构调控的机理,能可调式构筑药物活性成分的微观结构,包括活性药物成分(active pharmaceutical ingredient,API)的粒度、晶型、晶习、粒度分布及复合制剂。
1 超临界流体构筑微粒技术
超临界流体法制备微粒或晶体是近十几年来国内外积极开发的新技术。与传统的粉碎及结晶技术相比,本法可避免大量使用有机溶剂及由此而造成的环境污染和除去产品中残留有机溶剂的繁琐步骤,并可用于热敏感、结构不稳定及易失活变性的蛋白质、多肽类药物[7]。
1.1 超临界流体性质
超临界流体技术是基于超临界流体(supercritical fluid,SCF)具有的特殊理化性质,当物系所在的环境达到或超过其临界点(Tc、Pc)时,流体就进入到超临界区。此时气液界面消失,变为一种特别的超临界相。图1就是典型的单元流体的压力(P)-温度(T)曲线图,图1中AO表示气-固平衡的升华曲线,线BO表示液-固平衡的熔融曲线,线CO表示气-液平衡的饱和液体的蒸气压曲线,点O是气-液-固三相共存的三相点。
CO2是超临界流体技术最常用的流体介质,主要是因为:1)CO2的压力和温度临界点比较适宜,Pc为7.38 MPa,降低了对设备的要求,降低成本;2)Tc为31.4℃,适用于热敏性药物,尤其是蛋白类等生物药;3)CO2廉价易得,性质稳定,无毒不易燃。表1为超临界流休与液体常见性质的比较。
1.2 超临界流体构筑微粒技术原理及分类
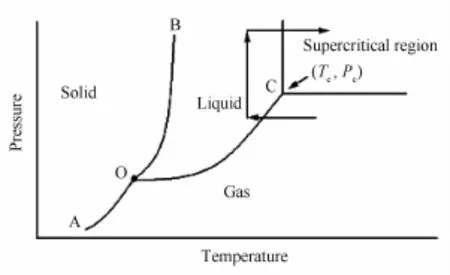
图1 单组分的压力-温度相图Fig.1 The P-T phase curve of single component

表1 超临界流体与气、液理化性质的比较Table 1 Comparison of physicochemical properties of supercritical fluid with gas and liquid
超临界流体构筑微粒技术经过了一次次改进,种类繁多。依据超临界流体在制粒成剂过程中的作用,可以分为三大类。1)作为溶剂;2)作为溶质;3)作为反溶剂。与之对应的分别是SCF构筑微粒技术的三大工艺:超临界流体溶液快速膨胀法(rapidexpansionsolutionbysu-percriticalfluid,RESS);饱和气体溶液制粒法(p-articles from gassaturated solution process,PGSS),气体反溶剂法(gas anti-solvent process,GAS)。表2列出了三大工艺的主要改型及其操作参数。
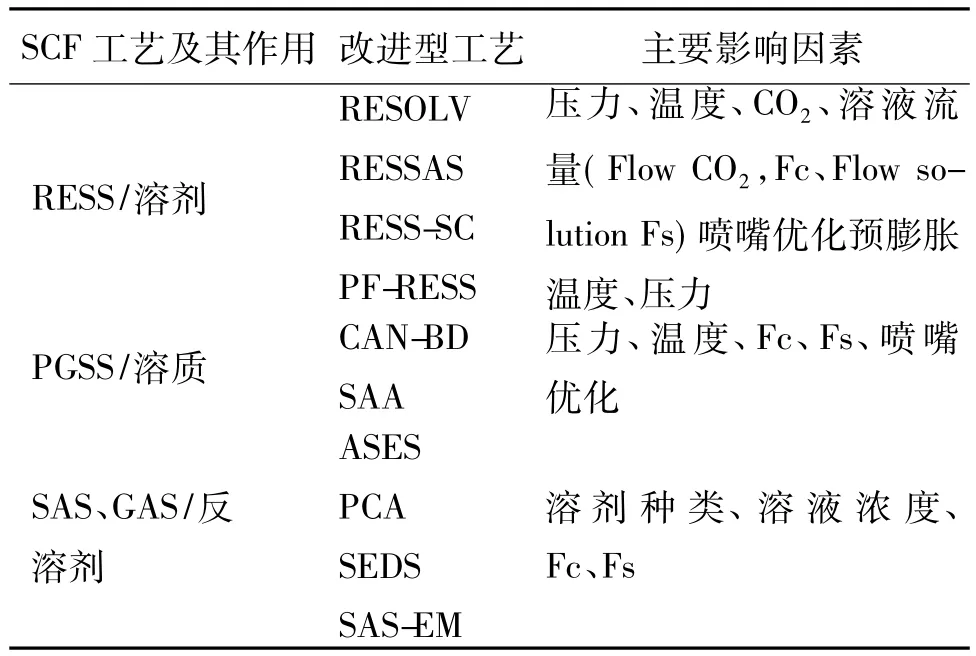
表2 不同类型的超临界流体工艺特点Table 2 The characteristics of different types of supercritical fluid technology
Krukonis等[8]首次应用SCF技术对药物进行重结晶,得到粒度分布均匀的超细颗粒,并将这项技术命名为RESS。Smith[9]发表了不同化合物在SCCO2溶解度的专利,促进了 RESS应用的进展。RESS主要是两步制粒,先将药物溶解在SCF中,压力急剧减少,SCF气化后大大将其溶解能力,瞬间形成了极大的过饱和度。药物溶质在气相中暴发成核、生长。这些粒子是完全干燥,无溶剂残留的。然而,RESS最大的局限就是SCF的溶解能力。由于大部分药物在SCF-CO2中溶解度有限,导致此工艺放大生产存在较大难度。因此,许多RESS的改进型工艺被报道,包括超临界流体溶液快速膨胀至液体溶剂法(RESS into a liquid solvent,RESOLV),超临界流体溶液快速膨胀至极性溶液法(RESS into an aqueous solution,RESSAS),超临界流体溶液快速膨胀联合固体共溶剂法(RESS with solid cosolvent,RESS-SC),预过滤超临界流体溶液快速膨胀法(pre-filtration RESS,PF-RESS)等。
RESS及其改进型的工艺流程图见图2[7]。
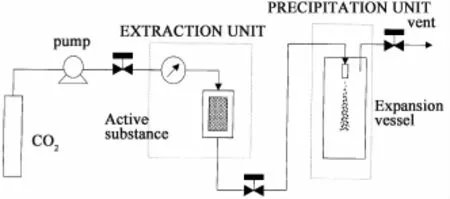
图2 RESS工艺流程图[7]Fig.2 A schematic diagram of RESS[7]
Graser等[10]首次提出PGSS概念,其流程图如图3,与RESS将SCF作为溶剂不同,它是将SCF-CO2作为溶质溶解于熔融物或液态溶液中,形成所谓的饱和气体溶液,然后利用溶解在溶液中的SCF的膨胀作用及其引起的Joule-Thomson效应,使饱和气体溶液通过喷嘴雾化后被减压膨胀,同时在沉淀槽内迅速冷却,即可沉积得到超细颗粒。PGSS的优点是CO2用量少,且无溶剂残留。PGSS是处理熔点较低的材料的良好工艺,如蛋白、聚合物和脂质。主要是因为CO2在聚合物中的溶解度较大,PGSS制备的聚合物微粒性质会有改善,如玻璃化转变温度和熔点。将药物溶解或悬浮于聚合物中可以得到复合粒子。但是,由于蛋白药物和脂质的特殊的理化性质,往往会有团聚而形成非均一的大颗粒。因此基于PGSS原理开发其改进型,如鼓泡干燥式二氧化碳辅助喷雾(CAN-BD),超临界辅助雾化法(SAA)。溶析结晶属溶液结晶范畴。传统的溶析结晶是含有良溶剂和溶质的溶液与反溶剂混合,从而降低良溶剂的溶解能力,形成高过饱和度而析出晶体或微粒。Gallagher等[11]借鉴反溶剂溶析结晶法,提出了GAS,其流程图如图4。在GAS中,SCF作为反溶剂与预先溶解定量溶质的有机溶剂混合。
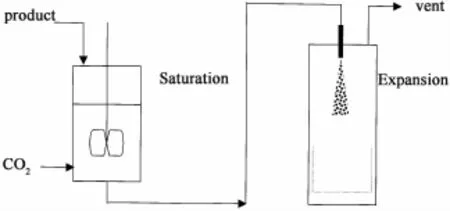
图3 PGSS工艺流程图[7]Fig.3 A schematic diagram of PGSS[7]
高压气体或SCF与有机溶剂互溶,两者扩散相互扩散或者自成一相,使其膨胀降低溶液密度,大大降低其有机溶剂溶解能力,从而使溶剂中的原有溶质过饱和后形成结晶或无定形沉淀。该法特别适用于在CO2中溶解度低而在与CO2互溶的有机溶剂溶解度高的溶质沉淀。大部分药物在SCF-CO2中溶解度低且SCF-CO2与常用有机溶剂都可以互溶,所以超临界流体反溶剂法在制药原料药中应用最广泛。GAS法是批次操作,大大限制了产量,另外其控制粒度,粒度分布和晶型的难度也相对较高。
在GAS的基础上,发展了大量改进型,如超临界反溶剂法(supercritical anti-solvent,SAS)、压缩反溶剂沉淀法(precipitation with compressed antisolvent,PCA)、气溶胶溶剂萃取系统(aerosol solvent extraction system,ASES)。含有溶质的溶液通过一个高压雾化喷嘴喷入沉淀槽,SCF使雾化液滴迅速膨胀并析出结晶,形成的粒子沉降在容器下部的过滤装置上。含有溶剂的SCF从罐底流入减压罐,使气液分离。SAS/PCA/ASES连续过程的影响因素还要考虑喷嘴形状、经喷嘴雾化后的液滴大小及喷射压力等物理参数。Hanna等[12]发明的超临界流体提高溶液分散技术(solution enhanced disper-sion by supercritical fluids,SEDS),它将 SCF和含有活性物质的溶液同时导入一个特制的具有共轴双层喷嘴,利用SCF的高速流动性将溶液分散成小液滴并喷入沉淀釜,在减小液滴粒径的同时,加快了液滴在SCF中的分散和膨胀速度,有利于减少粒径和团聚。

图4 GAS及其改进型工艺流程图[7]Fig.4 A schematic diagram of GAS and its modification[7]
除了改变混合方式和喷嘴设计,Chattopadhya-y等[13]发展了传质增强式超临界反溶剂沉淀技术(Supercritical anti-solvent precipitation with enhanced mass transfer,SAS-EM),增加了超声传质单元。由于超声的空化和破碎效应,射流分散更充分。超声域增强了传质和湍流波动,还可通过改变超声的频率调节粒子的大小和形态。
2 超临界流体构筑微粒技术的成粒机理和粒子结构控制机制
超临界流体构筑微粒技术存在不同种类的工艺及其大量的改进型,对于某一特定的药物,需要根据其具体的理化性质选择合适的工艺。另外,大量的工艺参数影响所得微粒或晶体的固态化学性质。其实,每个工艺参数都对应于一种的沉淀制粒或结晶机理,或者是多种机理的综合影响。因此,必须针对粒子形成和生长的机理进行研究,用于指导工艺参数的筛选和优化,从而便于设计需要的特定功能化的粒子结构。
2.1 超临界流体构筑微粒技术的热力学研究2.1.1 溶解度研究
在超临界流体构筑微粒技术中,热力学研究主要是高压下物质在SCF中的溶解度,还有有机溶剂与SCF-CO2的互溶程度。这对温度、压力和有机溶剂的选择至关重要,也有大量的相关文献通过建模计算或实验测定SCF-CO2中溶解度。Gupa等[14]整理了2004之前的700多种不同化合物在SCF-CO2的溶解度数据。Skerget等[15]总结了关于 2005~2010年之间固态物质在SCF-CO2中溶解度数据。然而,这些溶解度数据大部分是二元体系(溶质+SCF或溶剂+SCF)的相图,但在超临界流体构筑微粒技术中,往往是三元体系。Jiang等[16]采用静态法测定包括聚乳酸/聚乙二醇和CO2三元体系的超临界相行为。
2.1.2超临界流体相行为
纯固体物质在SCF中的溶解度是P和T的函数。超临界流体的相行为模型有多种方案,其中最常用的是将SCF看作是致密气体,采用气体状态方程(EOS)计算溶质在SCF的逸度系数,例如Peng-Robinson(PR)方程:

式(1)中,P是压力,T是温度,v是分子摩尔体积,a是分子间吸引力,b是共体积参数。
PR方程将P、T与摩尔体积(v)建立关系式。但上式是理想气体状态方程,实际应用中还需要考虑能量参数a和共体积参数b。另外,还有大量的半经验关联式,如Chrastil’s方程:
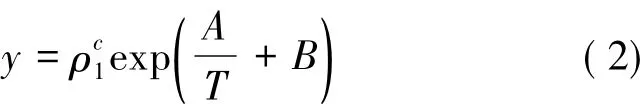
方程(2)中ρ是密度,c是平均热力学速度。此方程是基于溶质和SCF在平衡状态下形成溶剂化物的关系式,然后根据实验数据确定3个参数(c,A和B)确定方程,将实验数据复归理论值。
基于热力学研究,相图可决定不同种类SCF工艺路径。在RESS和PGSS工艺中,最常用的是溶质和SCF二元系统的相图。固液气平衡曲线和气液平衡曲线相接于2个点,低临界终点(LCEP)和高临界终点(UCEP)。对于RESS,膨胀和预膨胀的压力和温度决定了膨胀过程中相变路线,从而形成液滴或者直接进入气相,决定所得粒子形态。在UCEP区域内,溶质在SCF中的溶解度高,所以根据相图确定UCEP附近的P和T,在此条件下避免液相的产生[17]。
在SAS及其改进型工艺中,药物的粒子形态、粒度分布和晶型与体系所处的相图区域有关。Reverchon等[18]研究了改变相行为和雾化方式控制粒子或晶体形态和尺寸,结果显示在混合临界点之上制备的微粒与注射泵和设备无关,而在混合临界点附近,粒子形态和尺寸受温度和压力影响明显。其中主要是因为MCP上下,SCF与溶液的相行为显著不同,从而影响了相互传质。在MCP之上溶液与SCF完全互溶,两者混合后羽化,析出是较小的绵细状。在MCP附近或之下,溶液液滴与SCF-CO2存在相互传质。SCF进入溶液液滴,同时液滴里溶剂扩散到SCF-CO2。如果前者快于后者,较难析出颗粒,后者较慢往往形成黏连、多孔状。相反则易形成微细颗粒。另外,MCP随温度点升高而升高。因此,由P-x(压力-组分)相图指导得到不同温度点的MCP,在富含SCF区MCP附近或之下优化条件可以设计出各种所需的特定粒子。
2.2 超临界流体构筑微粒技术的流体动力学
关于超临界流体构筑微粒技术,流体动力学研究最重要的方面是射流流体动力学,主要与收敛喷嘴几何形状、尺寸、距离有关。
2.2.1射流流体动力学
Weber等[19]测量了毛细管几何形状对晶体粒度分布的影响,如管长径比。研究发现,毛细管内压力下降主要是由于摩擦,靠近出口处偏转。长毛细管内接近于等焓膨胀,而在短毛细管内则是等熵膨胀。长毛细管制备的晶体往往粒度分布宽。长径比越大,易出现二次暴发成核导致晶体双峰分布。然而长径比太短,预膨胀压力和温度降太快,会导致过早沉淀堵塞喷嘴。所以要选择合适的预膨胀压力和温度[20]。PGSS的射流流体动力学与RESS原理相似。
SAS工艺的流体动力学与RESS不同的是,其主要应用射流破碎理论。射流破碎的长度由雷诺数(Re)和韦伯数(We)相关。
然而,如上文相行为中(2.1.2)提到的,并非所有的溶液进入SCF中都是液滴状态,有时是羽化状态,这就不适用与射流破碎理论。Martin等[21]考虑羽化是溶液与SCF互溶产生,建立了k-ε湍流模型。Lengsfeld等[22]发明了预测动态液滴界面张力方法,结合线性射流破碎理论,准确预测了从不互溶到互溶的射流破碎长度。
2.2.2传质扩散
在SAS工艺中流体动力学研究的另一方面就是传质。一旦液滴形成,就出现界面,两相之间发生质量传递[23]。SCF-CO2进入液滴使其发生膨胀,溶剂扩散进SCF使液滴收缩。液滴直径决定了传质范围和扩散方式,因此确定液滴直径对于最终的粒子形态很有必要。目前传质模型主要与湍流液滴相关,简化的方程为:

式(3)中,ω是质量分数,γ是径向,z是坐标轴长度,jγ扩散流量。
另外,在SAS-EM工艺中,由于超声雾化和超声流增强传质的影响粒径明显较少,聚集减弱[24]。液滴直径与液膜表面张力的关系可用式(4)描述:
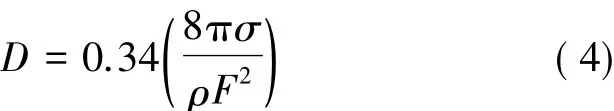
式(4)中,D是液滴直径,ρ是密度,σ是表面张力,F是振动频率。
3 超临界流体构筑微粒技术在药物制剂中的应用
超临界流体制粒技术可用于增加水不溶性药物的溶解度,设计缓控释递药系统和靶向、肺部吸入制剂等。实现这些新型给药系统的超临界过程主要是采用药物微粉化和共沉淀/包封技术。
超临界流体构筑微粒技术制备药物超细微粒是属于bottom-to-up,相对于传统up-to-bottom微粉化技术,具有绿色节能环保、粒子控制好等优点。基于上述超临界流体构筑微粒技术的粒子形成和结构控制机理,通过控制工艺条件,构筑特定要求的粒子,实现粒径、粒度分布、多晶型可控的纳微米级粒子。微粉化的粒子可以支持不同给药途径,提高固体制剂的生物利用度。另外,超临界流体构筑微粒技术还可以改变晶体结构,筛选多晶型微晶、共晶或制备无定型,提高溶解度和生物利用度。这些均符合欧美最新的药物制剂理念——质量源于设计(the quality by design,QbD)。
共沉淀/包封技术可以制备预想结构的功能粒子,实现特定的药物传递系统。超临界流体构筑微粒技术可以制备复合微球、微囊、包合物、固体分散体、靶向微粒等。这些功能化粒子通常结合生物可降解材料、聚合物,控制药物在体内的释放速率、时间和位置,改善治疗效果,提高患者顺应性。
3.1 超临界流体构筑微粒技术制备纳微米粒子
药物微粉化主要制备具有合适微观结构的纳微米药物粒子,在制药工业中地位日益重要。粒子的微观结构主要包括粒度、粒度分布、晶习和多晶型,这些性质直接影响固体药物制剂的质量。超临界流体构筑微粒技术可以一步生产纳微米粒子,并控制其结构,其与一些制药新理念如过程分析技术和质量源于设计相符。
Bahrami等[25]发表了利用超临界流体技术制备纳微米级复合粒子,并总结这些微粒的特点。Zarena等[26]总结了最新的亚微米和纳米级药物传递的SCF流体技术,罗列了2005~2010年SCF流体技术制备的药物微粒。Domingo等[27]总结了SCF流体技术制备的药物传递系统的分析表征,主要是理化性质,晶体学和毒理学。超临界流体构筑微粒技术可以制备纯药物或者配方粒子,并能控制粒子形态、粒度分布、多晶型。粒子尺寸可以由纳米至微米级别。
通过减小粒子大小,药物微粒的表面性质(粒度、表面积和表面自由能)显著改变。纳微米粒子的比表面积大,提高药物溶解度和溶出速率,从而改善药物吸收和生物利用度。表面积大,可使药物短时间内大程度释放,在吸收位点更快达到有效浓度。超临界流体构筑微粒技术可以将多种类药物微粉化,包括非甾体消炎药(布洛芬[29])、心血管药(非诺贝特[30]、洛伐他汀钙[31])、抗肿瘤药(5-氟尿嘧啶[32],喜树碱[33])、激素类药物(黄体酮[34])、抗病毒药 (阿德福韦酯[35])、生物大分子 (胰岛素[36])等。
Bahrami[37]和 Tandya[38]分别总结了采用超临界流体技术制备纳微米级粒子的方法和特点。Reverchon等[39]报道了利用SAS工艺制备阿莫西林可注射微粒(PS<0.5 μm),并达到中试规模,可以适用于肺部给药系统。
超临界流体构筑微粒技术制备纳微米粒子不仅可以改善药物粒子的固态化学性质以提高溶解度和生物利用度,还可以通过改变PS和PSD,使药物微粒满足一些特别的给药途径,特别是肺部给药制剂。不同粒径的粒子,在人体内有靶向性分布,0.1~0.3 μm 的粒子适用于注射给药,1~5 μm 的粒子可作为吸入给药。对于口服给药系统,0.1~100.0 μm的粒子都可以被吸收,体内分布取决于胃肠道溶出和吸收特性。对于注射给药,血管内微粒溶出到器官与粒度有关,<0.1 μm的粒子主要聚集在骨髓,0.1~7.0 μm 主要在肝脾,>7.0 μm 的主要聚集肺部。对于肺部给药,气体动力学中位数直径在1~5 μm的粒子沉降在支气管和肺泡内,最适合肺部渗透吸收。
Steckel等[40]用ASES工艺将八种不同的类固醇微粉化用于肺部给药,结果表明大部分粒子粒径均在5 μm以下,可用于肺部吸收。Todo等[41]利用SAS工艺制备了纯蛋白质干粉和促吸收成分(柠檬酸)用于肺部给药,提高了吸收率。
3.2 超临界流体构筑微粒技术制备纳微米多晶型
同一种固态化学药物,由于分子排列形式和对称规律的不同,形成不同的晶型固体状态,称之为药物多晶型现象,也称同质多晶现象。同种化合物的不同晶型之间由于排列方不一样,晶格不同,所以具有不同的空间、表面、力学和热力学性质。另外,固态化学药物还存在色多晶型和无定型状态。色多晶型是指药物在有序排列过程中,有种客体分子参与其中。当溶剂分子作为客体分子与药效分子形成规律性周期排列,称为溶剂化物;而客体分子式另一种固态化合物分子时,称为共晶。无定型药物是指药物分子无序排列,没有明显的单一晶格,所以无定型药物一般处于高能状态,稳定性低于晶型药物,而有较高的溶解度。尽管无定型药物的理化性质不稳定,但制药业一直希望开发出相对稳定的无定型或亚稳晶型药物,以提高难溶性药物的溶解度和溶出速率[42]。
药物多晶型对对同一种药物的药效有效期、制剂和制造工艺有显著影响,不同晶型药物之间存在明显的生物利用度、药效和毒性差异,因此药物多晶型的筛选和控制已成为制药研发中不可或缺的一环[43]。超临界流体构筑微粒技术是一种高效的筛选和纯化多晶型药物的方法。磺胺噻唑的多晶型现象一直受人关注,Kruger等[44]报道了磺胺噻唑有5种多晶型(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)和无定型。Kordikowski等[45]用甲醇作溶剂,SEDS制备了 3种纯多晶型和无定型药物。高温下得到晶型Ⅰ,低温下得到晶型Ⅲ、Ⅳ。丙酮作溶剂时,只能得到晶型1。超临界流体构筑微粒技术膨胀减压或溶析结晶过程中往往产生超高过饱和度,得到的晶型可能是无定型或亚稳晶型。Varshosaz等[46]用RESS制备了头孢呋辛酯纳米粒,平均粒径在158~513 nm之间。结果显示90%在3 min内从制剂内溶出,20 min内全部溶出。而市售头孢呋辛酯60 min内为完全溶出。Kim等[47]用SAS制备了洛伐他汀钙无定型纳米粒,粒径在152~863 nm之间。由于粒径减小和晶型变为无定型,洛伐他汀钙无定型纳米粒固有溶出速率提高3倍,血药浓度提高2倍。
另外,超临界流体构筑微粒技术也可以用来制备药物共晶,Shekunov等[48]用SAS制备对乙酰氨基酚(ACE)和P-乙酰基乙酰替苯胺(PAA)的复合晶体。结果显示共晶内部ACE和PAA的相互作用使晶体堆砌参数、表面自由能、粒径和晶习均发生明显变化。ACE-PAA的共晶形成一种新的固相,热力学行为改变,形成固体溶液。Padrela等[49]用SAS制备了吲哚美辛和糖精的共晶,与两种单独的药物粒子在多晶型和粒度分布都有显著差异。
3.3 超临界流体构筑微粒技术制备复合粒子
复合粒子是一种药物与生物相容性或生物可降解的材料的复合结构,聚合物材料作为基质,载负或包装药物活性分子。最早的复合粒子在制剂工业中得到重要关注,可以追溯到固体分散剂。固体分散剂通常是一种疏水性药物高度分散在亲水性基质复合粒子中,通过两者共溶混合物提高药物的生物利用度。传统制备复合微粒的工艺都有一定的局限性,例如恶劣的工艺条件和所得产品现在不佳。作为传统工艺的替代,超临界流体构筑微粒技术制备复合粒子可以改善一些传统工艺难以克服的缺点,如溶剂残留、低载药率和包封率等。超临界流体构筑微粒技术相对于传统工艺的一个特别优势是可以准确控制粒子性能[50]。常见的复合粒子的基质结构有多孔、镶嵌、包封和分散,而在这些共沉淀和包封过程中,药物和基质的结合方式主要分为两种方式:1)化学方式,如分子包合、界面聚合、分子共轭等;2)物理方式,如流化床喷涂、喷雾干燥等。
3.3.1超临界流体构筑微粒技术制备缓控释制剂
超临界流体构筑微粒技术可以贮备缓控释制剂。Lee等[51]用SAS-EM工艺制备了喜树碱控释制剂,体内释放研究结果显示载药量越大,药物释放越快慢。可能是因为药物微粒包裹在聚合物基质内部。Hu等[52]利用SEDS技术制备了叶黄素/玉米蛋白固体纳米粒,结果显示纳米粒释放曲线是零级释放,取代了原先的突释,说明复合纳米粒对叶黄素的释放有控释效果。Chattopadhyay[53]等利用超临界乳液萃取法(SFEE)制备了吲哚美辛和酮洛芬的脂肪酸甘油酯纳米悬浮液,体积平均粒径<30 nm,载药量(DL)在10%~20%(质量比)。悬浮液中溶剂残留<20 ppm(1 ppm=1×10-6,下同),并成功用 AERx系统气体溶胶化。采用阶式碰撞取样器和激光散射测试其气溶胶微粒分数,90%的气溶胶粒子的气体动力学直径<3.5 μm,适用于广泛采用此系统的溶液制剂。Salmaso[54]采用GAMA工艺制备80~120或200~400 nm的胰岛素脂质微粒干粉(溶剂含量<20 ppm),能保持70%活性。
3.3.2超临界流体构筑微粒技术制备靶向制剂
超临界流体构筑微粒技术还可以制备靶向药物传递体系。在载体中加入靶向性基团是一种靶向攻击某一特定类型细胞的方法。常见的靶向性基团有配体,多肽和核苷酸适配体。叶酸是最常见的靶向性基团,常键合在一系列的药物传递载体上。Zu等[55]利用SAS工艺制备叶酸-葡聚糖-喜树碱靶向纳米粒,平均粒径在 182 nm,载药量为36.12%,包封率为62.13%。
另一种靶向药物方法是使用聚合物/磁铁矿,主要利用靶点位置的磁场与载药复合微粒内部的磁矿石之间的吸引力,制成靶向药物。Vezzù等[56]利用PGSS制备了脂质磁性纳米粒,在一个简单的模拟装置内通过外加磁场实现了对纳米粒的磁力驱动。
3.3.3超临界流体构筑微粒技术制备生物药给药系统
生物大分子药物,如蛋白质、肽、治疗性基因和疫苗,可以加工成细干粉提高它们在某些疾病的治疗效果,如糖尿病、哮喘、慢性阻塞性肺疾病和肺部感染。超临界流体构筑微粒技术可以有效制备生物药干粉制剂,近室温条件和相对低的雾化速率减少了工艺对生物药的损害。SCF-CO2不会破坏生物大分子的二级结构,但生物大分子往往易溶于水等极性溶剂,因此,需要加入一种有机溶剂,即使SCFCO2可以消除有机溶剂,但还是不可避免的会破坏生物药活性。制备生物药干粉制剂常用极性有机溶剂,如DMSO和卤代醇或者乙醇+CO2。另一种方法是用SFEE法中的油包水(O/W)乳液。加入某些稳定剂(二糖、表面活性剂或缓冲液)也可以保护药物活性。Sievers等[57-58]利用CAN-BD法制备乙肝表面抗原(HBsAg)。带有稳定剂海藻糖的HBsAg制剂的活性完全保留,在-20~66℃之间保持43 d,无活性损失。Tservistas等[59]利用 SEDS法制备了plasmid pSV(6.9 kb)/甘露醇制剂,得到的质粒DNA含有天然DNA的80%螺旋结构,并能激光转染。Okamoto等[60]使用SEDS过程,以CS作为阳离子载体,采用分散巨细胞病毒启动子驱动的荧光素酶质粒DNA(pCMV-Luc)的水溶液制备了CS-pDNA微粒,用于基因药的肺部递送,并与无CS的微粒进行比较。结果表明与没有添加CS的pCMV-Luc粉或pCMV-Luc溶液相比,CS-pDNA微粒增加了小鼠肺的荧光素酶活性。
4 结语
超临界流体构筑微粒技术将药物微粉化,不仅可以改善难溶性药物的溶解度,溶出速率和生物利用度,也可以控制粒子结构,形成不同的给药体系。此技术应用于固体分散体、包合物、微囊、微球和脂质体等新复合剂型亦可以使粒子具有缓控、靶向释放等特性。另外相当一部分固体药物已经发现存在多晶型现象,由此发展起来的药物固态化学研究正受到极大的关注,超临界流体构筑粒子技术可以改善固体药物的晶型、制备共晶药物和新的盐型,提高药物的稳定性和生物利用度。
超临界流体构筑微粒技术还存在一些问题,如工业化生产、纳微米药物的安全性等问题。然而,由于超临界流体构筑微粒技术的诸多优点,其有希望成为21世纪制剂工业取得突破式发展的平台。
参考文献:
[1]Allen T M,Cullis P R.Drug delivery systems:Entering
the mainstream[J].Science,2004,303:1 818-1 822[2]Fahr A,Liu X.Drug delivery strategies for poorly water
soluble drugs[J].Expert Opin Inv Drug,2007,4:403-416
[3]Loira-Pastoriza C,Todoroff J,Vanbever R.Delivery strategies for sustained drug release in the lungs[J].Adv Drug Deliver Rev,2014,75:81-91
[4]Cansell F,Aymonier C.Design of functional nanostructured materials using supercritical fluids[J].J Supercrit Fluid,2009,47:508-516
[5]Jain A,Bollinger J A,Truskett T M.Inverse methods for material design[J].AIChE J,2014,60(3):2 732-2 740
[6]Yasuji T,Takeuchi H,Kawashima Y.Particle design of poorly water-soluble drug substances using supercritical fluid technologies[J].Adv Drug Deliv Rev,2008,60(3):388-398
[7]Jung J,Perrut M.Particle design using supercritical fluids:Literature and patent survey[J].Journal of Supercritical Fluids,2001,20:179-219
[8]Krukonis V.Supercritical fluid nucleation of difficult to comminute solids[C].San Francisc Annual Meeting A IChE,1984:11
[9]Smith R D.Supercritical fluid molecular spray film deposition and powder formation:US,4582731[P].1986-04-15
[10]Graser F,Wickenhaeuser G.Conditioning of finely divided crude organic pigments:US,4451654[P].1984-05-29
[11]Gallagher P M,Coffey M P,Krukonis V J.Gas anti-solvent recrystallization of RDX:Formation of ultrafine particles of a difficult-to-comminute explosive[J].J Supercrit Fluids,1992,5:130-142
[12]Hanna M,York P.Method and apparatus for formation of particles:WO,1995/01221[P].1994-06-30
[13]Chattopadhyay P,Gupta R B.Production of griseofulvin nanoparticles using supercritical CO2antisolvent with enhanced mass transfer[J].Int J Pharm,2001,228:19-31
[14]Gupta R B,Shim J J.Solubility in supercritical carbon dioxide[M].USA:CRC Press,2006
[15]Skerget M,Knez Z,Knez-Hrncic M.Solubility of solids in sub-and supercritical fluids:A review[J].J Chem Eng Data,2011,56:694-719
[16]Jiang Y,Liu M,Sun W,et al.Phase behavior of poly(lactic acid)/poly(ethylene glycol)/poly(lactic acid)(PLA-PEG-PLA)in different supercritical systems of CO2+dichloromethane and CO2+C2H5OH+dichloro methane[J].J Chem Eng Data,2010,55:4 844-4 848
[17]Diefenbacher A,Türk M.Phase equilibria of organic solid solutes and supercritical fluids with respect to the RESS process[J].Journal of Supercritical Fluids,2002,22(3):175-184
[18]Reverchon E,Caputo G,De Marco I.Role of phase behavior and atomization in the supercritical antisolvent precipitation[J].Ind Eng Chem Res,2003,42:6 406-6 414
[19]Weber M,Russell L M,Debenedetti P G.Mathematical modeling of nucleation and growth of particles formed by the rapid expansion of a supercritical solution under subsonic conditions[J].J Supercritical Fluid,2002,23:65-80
[20]Martín A,Cocero M J.Micronization processes with supercritical fluids:Fundamentals and mechanisms[J].Adv Drug Deliver Rev,2008,60:339-350
[21]Martín A,Cocero M J.Numerical modeling of jet hydrodynamics,mass transfer,and crystallization kinetics in the supercritical antisolven(SAS)process[J].J Supercritical Fluid,2004,32:203-219
[22]Lengsfeld C S,Delplanque J P,Barocas V H,et al.Mechanism governing microparticle morphology during precipitation by a compressed ntisolvent:Atomization vs nucleation and growth[J].J Phys Chem B,2000,104:2 725-2 735
[23]Werling J O,Debenedetti P G.Numerical modeling of mass transfer in the supercritical antisolvent process[J].J Supercrit Fluid,1999,16:167-181
[24]Chattopadhyay P,Gupta R B.Protein nanoparticles formation by supercritical antisolvent with enhanced mass transfer[J].AIChE J,2002,48:235-244
[25]Bahrami M,Ranjbarian S.Production of micro-and nanocomposite particles by supercritical carbon dioxide[J].J Supercritical Fluids,2007,40:263-283
[26]Zarena A S,Sankar K U.Design of submicron and nanoparticle delivery systems using supercritical carbon dioxide-mediated processes:An overview[J].Therapeutic Delivery,2011,2:259-277
[27]Domingo C,Saurina J.An overview of the analytical characterization of nanostructured drug delivery systems:Towards greenandsustainablepharmaceuticals:A review[J].Anal Chim Acta,2012,744:8-22
[28]Sun Y.Supercritical fluid particle design for poorly water-soluble drugs[J].Current Pharmaceutical Design,2014,20:349-368
[29]Chen W,Hu X,Hong Y,et al.Ibuprofen nanoparticles prepared by a PGSSTM-based method[J].Powder Technol,2013,245:241-250
[30]Dalvi S V,Azad M A,Dave R.Precipitation and sta-bilization of ultrafine particles of Fenofibrate in aqueous suspensions by RESOLV[J].Powder Technol,2013,236:75-84
[31]Kim M S,Jin S J,Kim J S,et al.Preparation,characterizationandin-vivoevaluationofamorphous atorvastatin calcium nanoparticles using supercritical antisolvent(SAS)process[J].Eur J Pharm Biopharm,2008,(69):454-465
[32]Esfandiari N,Ghoreishi S M.Synthesis of 5-fluorouracil nanoparticles via supercritical gas antisolvent process[J].J Supercrit Fluid,2013,84:205-210
[33]Zu Y,Wang D,Zhao X,et al.A novel preparation method for camptothecin(CPT)loaded folic acid conjugated dextran tumortargeted nanoparticles[J].Int J Mol Sci 2011;12:4 237-4 249
[34]Huang Z,Guo Y,Miao H,et al.Solubility of progesterone in supercritical carbon dioxide and its micronization through RESS[J].Powder Technol,2014,258:66-77
[35]Yim J H,Kim W S,Lim J S.Recrystallization of adefovir dipivoxilparticles using the aerosol solvent extraction system process[J].Ind Eng Chem Res,2014,53:1 663-1 671
[36]Todo H,Iida K,Okamoto H,et al.Improvement of insulin absorption from intratracheally administrated dry powder prepared by supercritical carbon dioxide process[J].J Pharm Sci,2003,92:2 475-2 486
[37]Bahrami M,Ranjbarian S.Production of micro-and nanocomposite particles by supercritical carbon dioxide[J].J Supercritical Fluids,2007,40:263-283
[38]Tandya A,Mammucari R,Dehghani F,et al.Dense gas processing of polymeric controlled release formulations[J].Int J Pharm,2007,328:1-11
[39]Reverchon E,De Marco I,Caputo G,et al.Pilot scale micronization of amoxicillin by supercritical antisolvent precipitation[J].J Supercritical Fluids,2003,26:1-7
[40]Steckel H,Thies J,Müller B W.Micronizing of steroids for pulmonary delivery by supercritical carbon dioxide[J].Int J Pharm,1997,152:99-110
[41]Todo H,Iida K,Okamoto H,et al.Improvement of insulin absorption from intratracheally administrated dry powder prepared by supercritical carbon dioxide process[J].J Pharm Sci,2003,92:2 475-2 486
[42]Rodriguez-Spong B,Price C P,Jayasankar A,et al.Generalprinciplesofpharmaceuticalsolid polymorphism:A supramolecular perspective[J].Adv Drug Del Rev,2004,56:241-274
[43]Knapman K.Polymorphic predictions[J].Modern Drug Discovery,2000,3:53-57
[44]Kruger G J,Gafner G.The crystal structures of polymorphs I and III of sulphathiazole[J].Acta Cryst,1972,B28:272-283
[45]Kordikowski A,Shekunov T,York P.Polymorph control of sulfathiazole in supercritical CO2[J].Pharm Res,2001,18:682-688
[46]Varshosaz J,Hassanzadeh F,Mahmoudzadeh M,et al.Preparation of cefuroxime axetil nanoparticles by rapid expansion of supercritical fluid technology[J].Powder Technol,2009,189:97-102
[47]Kim M S,Jin S J,Kim J S,et al.Preparation,characterizationandinvivoevaluationofamorphous atorvastatin calcium nanoparticles using supercritical antisolvent(SAS)process[J].Eur J Pharm Biopharm,2008,69:454-465
[48]Shekunov B Y,Bristow S,York P.Formation of composite crystals by precipitation in supercritical CO2[J].Crystal Growth and Design,2003,3(4):603-610
[49]Luis P,Miguel A,de Azevedo E G,et al.Formation of indomethacin-saccharincocrystalsusingsupercritical fluidtechnology[J]. EuropeanJournalof Pharmaceutical Sciences,2009,38:9-17
[50]Reverchon E,Volpe M C,Caputo G.Supercritical fluid processing of polymers:Composite particles and porous materials elaboration[J].Current Opinion in Solid State and Materials Sci,2003,7:391-397
[51]Lee L Y,Wang C H,Smith K A.Supercritical antisolvent production of biodegradable micro-and nanoparticles for controlled delivery of paclitaxel[J].J Control Release,2008,125:96-106
[52]Hu D,Lin C,Liu L,et al.Preparation,characterization,and in vitro release investigation of lutein/zein nanoparticles via solution enhanced dispersion by supercritical fluids[J].J Food Eng,2012,109:545-552
[53]Chattopadhyay P,Shekunov B Y,Yim D,et al.Production of solid lipid nanoparticle suspensions using supercritical fluid extraction of emulsions(SFEE)for pulmonary delivery using the AERx system[J].Adv Drug Del Rev,2007,59:444-453
[54]Salmaso S,Elvassore N,Bertucco A,et al.Production of solid lipid submicron particles for protein delivery usinganovelsupercriticalgas-assistedmelting atomization process[J].J Pharm Sci,2009,98:640-649
[55]Zu Y,Wang D,Zhao X,et al.A novel preparation method for camptothecin(CPT)loaded folic acid conjugated dextran tumortargeted nanoparticles[J].Int J Mol Sci,2011,12:4 237-4 249
[56]Vezzù K,Campolmi C,Bertucco A.Production of lipid microparticles magnetically active by a supercritical fluidbased process[J].Int J Chem Eng,2009,2009:1-9
[57]Sievers R E,Quinn B P,Cape S P,et al.Near-Critical fluid micronization of stabilized vaccines,antibiotics and anti-virals[J].J Supercritical Fluids,2007,42:385-391
[58]Burger J L,Cape S P,Braun C S,et al.Stabilizing formulationsforinhalablepowdersoflive-attenuated measles virus vaccine[J].J Aerosol Med Pulm Drug Deliv,2008,21:25-34
[59]Tservistas M,Levy M S,Lo-Yim M Y A,et al.The formation of plasmid DNA loaded pharmaceutical powders using supercritical fluid technology[J].Biotechnol Bioeng,2001,72:12-18
[60]Okamoto H,Nishida S,Todo H,et al.Pulmonary gene delivery by chitosan-pDNA complex powder prepared by a supercritical carbon dioxide process[J].J Pharm Sci,2003,92:371-380

