萃取精馏分离甲醇-丁酮萃取剂的选择
张亲亲,潘奋进,张爱笛,李文秀
(沈阳化工大学,辽宁省化工分离技术重点实验室,沈阳110142)
甲醇是一种重要的有机化工原料,主要用于生产甲醛、乙酸、氯甲烷等多种有机产品。除此之外,甲醇还可用作性能优良的能源和车用燃料。丁酮是一种重要的精细化工原料,可用于生产过氧化甲乙酮、甲基戊基酮、甲基烯丙基酮、甲乙酮肟等[1]。然而,在生产木醋液的过程中,会产生甲醇和丁酮的混合物[2]。由于甲醇和丁酮能形成共沸物[3],常规的精馏方法无法将其有效地分离[4]。萃取精馏是一种常用的分离共沸物的方法,它是通过引入适宜的萃取剂[5],增加了被分离组分之间的相对挥发度,进而实现共沸物的分离。但萃取精馏的缺点是溶剂比一般较大,从而导致整个分离过程能耗大。因此,选取高选择性、低污染、低能耗的萃取剂备受关注。
离子液体,又称室温熔盐,是一类完全由阴阳离子组成的新型介质。基于其独特的结构,离子液体具有可设计性强、蒸汽压极低、不易燃、液态温度范围宽、溶解性优良、化学和热稳定高等优点受到国内外许多学者的关注。近些年来,离子液体越来越多地被用作萃取精馏分离共沸物的萃取剂[6-8]。相比于传统的有机溶剂和无机盐萃取剂而言,离子液体可以克服有机溶剂损失率高的问题,易回收利用,同时还可克服无机盐易堵塞管路的问题,是一种非常具有应用前景的萃取剂。咪唑类离子液体作为萃取剂应用于甲醇-丁酮共沸物系的分离已有相关报道[2,9],针对咪唑类离子液体价格昂贵的缺点,吡啶类离子液体以其低廉易得的特点取得优势。本研究采用一步法合成了N-乙基吡啶溴盐([EPy][Br])、N-丁基吡啶溴盐([BPy][Br])和 N-己基吡啶溴盐([HPy][Br])3种离子液体,测定了101.3 kPa下它们对甲醇-丁酮共沸物系的溶剂选择性,并考察了溶剂比对其选择性的影响。这为工业上采用离子液体作为萃取剂分离甲醇-丁酮体系提供了基础数据和实验依据。
1 实验部分
1.1 试剂与仪器
吡啶,工业纯,浙江临海凯乐化工厂。甲醇,丁酮,乙酸乙酯,溴乙烷,溴代正丁烷,溴代正己烷,国药集团化学试剂有限公司。以上试剂均为分析纯,纯度≥98%(质量分数,下同)。
DF-101S型集热式恒温加热磁力搅拌器,上海亚荣生化仪器厂;RE52-CS-1型旋转蒸发仪,上海亚荣生化仪器厂;DZF-6020MBE型真空干燥箱,上海博讯实业有限公司;2XZ型系列双级旋片真空泵,无锡市四方真空设备有限公司;NEXUS 470型红外光谱仪,美国热电公司。
1.2 离子液体的合成
吡啶的预处理:放入旋转蒸发仪中,油浴加热到160℃左右,减压蒸馏(真空度0.08 MPa),放入棕色瓶中备用。
合成反应式[10]如图1所示。

图1 N-烷基吡啶溴盐的合成路线Fig.1 Synthesis route of N-alkylpyridinium bromide
实验过程:称取一定量的吡啶于三口烧瓶中,水浴加热到40℃,在快速搅拌下,用恒压滴液漏斗缓慢滴加溴代烷烃(溴乙烷,溴代正丁烷,溴代正己烷),用时约1 h。在70℃条件下回流8 h。反应结束后,将产物移入分液漏斗中。加入乙酸乙酯对产物进行洗涤,除去未反应的原料,洗涤4~5次后用旋转蒸发仪除去乙酸乙酯,最后将得到的产物置于真空干燥箱干燥24 h(温度:70℃,真空度:0.08 MPa)。
1.3 萃取剂的选择
1.3.1气液相平衡实验装置
实验釆用CE-2型单循环气液平衡釜,装置结构见图2。这种实验装置具有容积小(约60 mL)、使用样品少、取样分析相对简便等优点。平衡釜主要有加热、冷凝、取样等部分组成。本装置由贝克曼温度计控温,试样由接触变压器加热,釜身采用真空绝热保温,以防止气相遇冷凝结。
实验步骤:将配好的一定浓度的样品液倒入气液平衡釜内,加热1 h左右,溶液沸腾,温度保持恒定30 min后,通过微量注射器分别取气液两相的样品进行分析。
1.3.2分析方法
本次实验中的气相及液相组成由带有顶空进样器(G1888)的安捷伦GC7890A气相色谱仪检测,检测器FID,色谱柱为SP-7800型石英毛细管柱,柱长30 m,直径0.32 mm,膜厚0.25 μm,汽化室温度170℃,检测器温度200℃,采用面积归一化法。1)气相组分分析:由于离子液体不挥发,因此气相组分只含有易挥发性组分丁酮和甲醇,每次平衡釜达到平衡并且稳定一段时间后,气相的取样可以直接进入气相色谱仪进行分析。
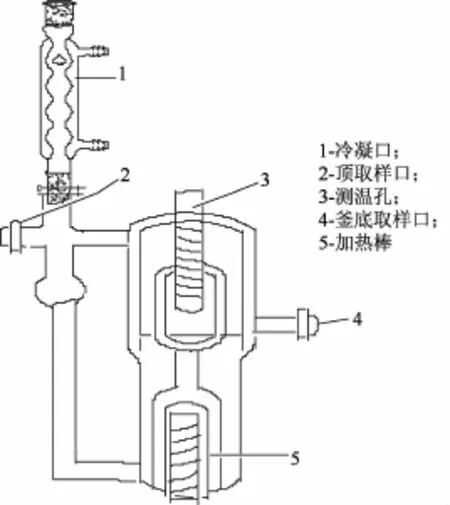
图2 气液相平衡实验装置Fig.2 Experimental setup for vapor-liquid equilibrium
2)液相组分分析:本实验采用顶空进样器来辅助分析实验数据,其原理是通过顶空进样器将顶空瓶中样品升温,要分离的物质被气化,然后进样器从样品的顶部空间取气态样品,与气相色谱结合,对气态样品进行分析。由于离子液体的难挥发性,通过顶空进样器后,只有甲醇和丁酮进入气相色谱仪进行分析。离子液体的含量可通过称质量法测定。
2 结果与讨论
2.1 红外光谱分析
3种离子液体的红外谱图如图3、图4和图5所示。

图3 [EPy][Br]的红外谱图Fig.3 The infrared spectrum of[EPy][Br]

图4 [BPy][Br]的红外谱图Fig.4 The infrared spectrum of[BPy][Br]

图5 [HPy][Br]的红外谱图Fig.5 The infrared spectrum of[HPy][Br]
由图3可知,3 422 cm-1处为水的O—H的伸缩振动峰(由于测试过程中样品接触空气吸收水分造成),3 060 cm-1处吡啶环上的 C—H伸缩振动峰,2 980 cm-1处为乙基上的 C—H伸缩振动峰,1 634 cm-1处为吡啶环上的 C N伸缩振动峰,1 488 cm-1处为吡啶环上的 C—N伸缩振动峰,1 174 cm-1处为吡啶环上的 C—H弯曲振动峰,780 cm-1处为吡啶环上的 C C弯曲振动峰,683 cm-1处为吡啶环上的 C—H变形振动峰。因此,可认为该产物为目标产物N-乙基吡啶溴盐离子液体[10-12]。由图4可知,3 447 cm-1处为水的O—H的伸缩振动峰(由于测试过程中样品接触空气吸收水分造成),3 055 cm-1处为吡啶环上的C—H伸缩振动峰,2 963 cm-1处为丁基上的C—H不对称伸缩振动峰,2 873 cm-1处为丁基上的C—H对称伸缩振动峰,1 633 cm-1处为吡啶环上的CN伸缩振动峰,1 488 cm-1处为吡啶环上的C—N伸缩振动峰,1 173 cm-1处为吡啶环上的C—H弯曲振动峰,774 cm-1处为吡啶环上的CC弯曲振动峰,685 cm-1处为吡啶环上的C—H变形振动峰。从红外光谱图分析可知,该产物为目标产物N-丁基吡啶溴盐离子液体。
由图5可知,3 421 cm-1处为水的O—H的伸缩振动峰(由于测试过程中样品接触空气吸收水分造成),3 052 cm-1处为吡啶环上的C—H伸缩振动峰,2 957 cm-1处为己基上的C—H不对称伸缩振动峰,2 859 cm-1处为己基上的C—H对称伸缩振动峰,1 633 cm-1处为吡啶环上的CN伸缩振动峰,1 487 cm-1处为吡啶环上的C—N伸缩振动峰,1 171 cm-1处为吡啶环上的C—H弯曲振动峰,775 cm-1处为吡啶环上的C—C弯曲振动峰,685 cm-1处为吡啶环上的C—H变形振动峰。因此,可认为该产物为目标产物N-己基吡啶溴盐离子液体。
2.2 实验装置校正
在101.3 kPa条件下,使用图2所示实验装置测量甲醇(1)-丁酮(2)二元气液相平衡数据如表1所示,其中x1为甲醇在液相中的摩尔分数,y1为甲醇在气相中的摩尔分数。
将本实验所得的甲醇+丁酮二元物系的气液相平衡实验数据与文献[2]中的数据进行对照作图,如图6所示。
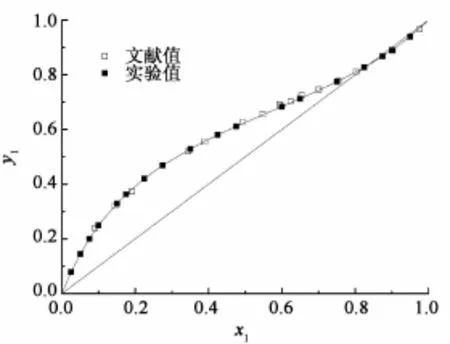
图6 101.3 kPa下甲醇(1)-丁酮(2)的气液相平衡数据与文献值的比较Fig.6 Isobaric VLE data for methanol(1)+butanone(2)system at 101.3 kPa

表1 101.3 kPa下,甲醇(1)-丁酮(2)气液相平衡数据Table 1 Experimental VLE data for the methanol(1)+butanone(2)binary system at 101.3 kPa
从图6可以看出,实验数据与文献数据基本吻合,说明实验装置具有可行性。
2.3 离子液体的选择
萃取精馏中溶剂的选择性S12定义为被分离物系两关键组分在加入萃取剂后的相对挥发度(α12)S与未加萃取剂的相对挥发度α12之比。

由于实验在常压下进行,被考察的物系可视为理想低压(气相为理想气体)的气液平衡物系。萃取精馏分离的物系为近沸点或共沸点体系,α12约等于1,故选择性可表示为:

式(2)中,x1,x2为组分1、2在液相中的摩尔分数;y1,y2为组分1、2在气相中的摩尔分数。
不同离子液体及不同溶剂比(质量比)下,计算离子液体对甲醇-丁酮共沸物系的选择性,结果如图7所示。

图7 离子液体的选择性随离子液体类型和溶剂比的变化Fig.7 The variation of the selectivities of ILs as a function of ILs type and solvent ratio
由图7可知,在3种吡啶类离子液体的作用下,丁酮对甲醇的相对挥发度都大于1.0,因此3种离子液体对于甲醇+丁酮共沸物系的分离都有显著的效果。改变溶剂比,离子液体的选择性发生变化,溶剂比越大,离子液体的选择性越大,即分离效果越好。由图7还可以看出,在3种离子液体中,[EPy][Br]的效果最好,其次是[BPy][Br],最后是[HPy][Br]。研究表明离子液体的极性较大[13],而甲醇的极性大于丁酮,根据相似相溶原理,离子液体与甲醇的作用大于丁酮,因此在共沸比条件下,丁酮对甲醇的相对挥发度都大于1.0。对于3种吡啶离子液体而言,阴离子都是溴离子,不同的是阳离子的侧链取代基。对于侧链取代基来说,链越长电子云分布越分散,电子云密度越低[14],与甲醇的静电作用的强度越弱。因此,根据离子液体的结构可知,[EPy][Br]的侧链最短,它对甲醇-丁酮共沸物系的选择性最大,可作为萃取精馏分离甲醇-丁酮共沸物系的萃取剂。
前期已有文献[15]报道了以二乙酮为萃取剂分离甲醇-丁酮共沸物系,通过比较可得:以二乙酮为萃取剂,当溶剂比达到40%(物质的量之比)时,甲醇对丁酮的相对挥发度达到了 1.67;以[EPy][Br]、[BPy][Br]和[HPy][Br]3 种离子液体为萃取剂时,当溶剂比为1.0(物质的量之比),即约20%(摩尔比)时,丁酮对甲醇的相对挥发度即可超过1.67。由此可得出结论:与有机溶剂相比,离子液体在甲醇-丁酮共沸物系分离中具有显著优势。
3 结论
本实验合成的[EPy][Br]、[BPy][Br]和[HPy][Br]3种吡啶类离子液体都可提高甲醇对丁酮的相对挥发度;增大溶剂比,可显著提高离子液体的选择性;3种离子液体分离甲醇-丁酮共沸物系的性能大小顺序为[EPy][Br]>[BPy][Br]>[HPy][Br];与传统的有机溶剂相比,离子液体在共沸物系的分离方面具有显著优势。[EPy][Br]可以作为一种萃取精馏分离甲醇+丁酮共沸物系的萃取剂。
参考文献:
[1]崔小明.国内外甲乙酮的市场分析[J].精细与专用化学品,2012,20(6):15-23 Cui Xiaoming.Market analysis of methyl ethyl ketone at home and abroad [J].Fine and Specialty Chemicals,2012,20(6):15-23(in Chinese)
[2]Li Q,Sun X,Cao L.Effect of ionic liquids on the isobaric vapor-liquid equilibrium behavior of methanolmethyl ethyl ketone[J].J Chem Eng Data,2013,58(5):1 133-1 140
[3]Britton E C,Nutting H S,Horsley L H.Seperation of ketonesandalcoholsfrommixturesthereof:US,2324256[P].1943-07-13
[4]Langston P,Hilal N.Simulation and optimization of extractive distillation with water as solvent[J].Chem Eng Pro,2005,44(3):345-351
[5]华超.间歇萃取精馏新操作方式及相关应用基础研究[D].天津:天津大学,2005 Hua Chao.Novel operation mode and related application fundamentals ofbatchextractivedistillation [D].Tianjin:Tianjin University,2005(in Chinese)
[6]李卫坤.离子液体在萃取分离乙醇-水体系中的绿色应用[D].杭州:浙江工业大学,2008 LiWeikun.Thegreenapplicationonextraction separation ethanol-water with ionic liquids[D].Hangzhou:Zhejiang University of Technology,2008(in Chinese)
[7]孟凡宝,李东风.离子液体在萃取精馏领域应用的基础性研究进展[J].石油化工,2010,39(12):1 395-1 401 Meng Fanbao,Li Dongfeng.Fundamental research advance in application of ionic liquids to extractive distillation[J].Petrochemical Technology,2010,39(12):1 395-1 401(in Chinese)
[8]Domanska U,Zawadzki M,Krolikowski M.Phase equi-libria study of binary and ternary mixtures of{N-octylisoquinolinium bis{(trifluoromethyl)sulfonyl}imide+hydrocarbon,or an alcohol,or water}[J].Chem Eng J,2012,(181/182):63-71
[9]李群生,孙雪婷,曹玲,等.甲醇-甲乙酮-1-辛基-3-甲基咪唑六氟磷酸盐物系等压汽液相平衡数据的测定[J].北京化工大学学报,2014,41(1):14-18 Li Qunsheng,Sun Xueting,Cao Ling,et al.Vaporliquid equilibria for the methanol-methyl ethyl ketone-1-octyl-3-methylimidazoliumhexafluorophosphate([OMIM]PF6)system[J].Journal of Dalian Polytechnic University,2008,27(1):62-65(in Chinese)
[10]秦天灵,田鹏,张洪波,等.溴化N-乙基吡啶制备和溶解性的研究[J].沈阳师范大学学报,2012,30(4):528-530 QinTianling, Tianpeng, ZhangHongbo, etal.Synthesis and solubility research of N-ethyl pyridine bromide preparation[J].Journal of Shenyang Normal University,2012,30(4):528-530(in Chinese)
[11]于长顺,马春,闵庆旺,等.超声合成吡啶类离子液体的研究[J].大连工业大学学报,2008,27(1):62-65 Yu Changshun,Ma Chun,Minqingwang,et al.Ultrasonic synthesis of pyridinium-like ionic liquid[J].Journal of Dalian Polytechnic University,2008,27(1):62-65(in Chinese)
[12]何冬梅,李方林,曹红,等.超声波辅助咪唑基和吡啶基离子液体的合成[J].石河子大学学报,2010,28(6):745-749 He Dongmei,Li Fanglin,Cao Hong,et al.Synthesis of imidolium-based andpyridinium-basedionicliquids under ultrasonic irradiation[J].Journal of Shihezi University,2010,28(6):745-749(in Chinese)
[13]田鹏.离子液体的物理化学性质[J].沈阳师范大学学报,2011,29(2):129-137 Tian Peng.Physicochemical properties of ionic liquids[J].Journal of Shenyang Normal University,2011,29(2):129-137(in Chinese)
[14]Li W,Su D,Zhang T.Phase equilibrium study of binary and ternary mixtures of ionic liquids+acetone+methanol[J].J Chem Eng Data,2014,59(12):3 975-3 981
[15]Privott W J,Paul D R,Jolls K R,et al.Vapor-Liquid equilibria of methanol-methyl ethyl ketone(MEK)in the presence of diethyl ketone[J].J Chem Eng Data,1966,11:331-333

