干扰PAK4 表达对肝细胞癌迁移侵袭的影响①
王子航 李春实 康劲松 米旭光 刘 磊 (延边大学医学院,延边 133002)
肝细胞癌(Hepatocellular carcinoma,HCC)是消化系统常见的恶性肿瘤,约80%的病例发生在发展中国家,其中约55%发生在中国,我国每年约11 万人死于肝癌,占全世界肝癌死亡人数的45%[1-4]。现阶段肝癌治疗方法有了显著进步,但是死亡率仍高居不下,主要是因为肝癌的复发及肝内外转移[5]。因此,寻找有关肝细胞癌转移的有效治疗靶点和治疗方法是当前研究的热点之一。
1 材料与方法
1.1 细胞培养 肝细胞癌SMMC-7721,人胚肾HEK293T 使用含10%胎牛血清(四季青生物公司,中国)的DMEM 培养基(Invitrogen,USA),添加含青霉素100 U/ml,链霉素100 μg/ml,37℃5%CO2条件下培养。
1.2 主要实验试剂耗材 Transwell 小室(Corning,美国)、基质胶(Sigma,美国)、microRNA-199a-3p mimcs(Biomics,中国)、D-luciferin(上海科敏生物科技有限公司,中国)、PVDF 膜(Millipore,德国)、鼠抗PAK4 和HRP 标记羊抗鼠二抗(CST,美国)、pRNAT-U6.1/Hygro-PAK4 干扰载体为本实验室构建、其他常规试剂(北京化工,中国)。
1.3 荧光素酶报告分析 pmirGLO-PAK4 3'UTR和pmirGLO-PAK4 3'UTR mut 荧光素酶报告基因载体是将人PAK4 的3'UTR 序列(或miR-199a/b-3p结合位点突变后的PAK4 的3'UTR 序列)克隆至pmirGLO-Firefly 荧光素酶报告基因载体中(Promega公司)。HEK293T 细胞使用Lipofectamine 2000(Invitrogen,USA)转染相应质粒和miR-199a/b-3p mimcs(30 nmol/L),48h 后检测荧光素酶活性。
1.4 免疫印迹分析 提取细胞总蛋白后,进行常规SDS-PAGE 电泳转膜,TBST 配制的脱脂奶粉封闭液封闭24 h,标记鼠抗PAK4 一抗(1∶1 000)室温1.5 h,TBST 清洗3 次,标记HRP 标记羊抗鼠二抗(1∶1 000),TBST 清洗3 次,ECL 显影。
1.5 迁移能力的检测 在6 孔板中接种1 ×106个SMMC-7721 细胞,培养24 h 贴壁后,划线,拍照。继续培养,在24 h、48 h 时拍照,Image J 软件分析。
1.6 侵袭能力的检测 用无血清的DMEM 培养基重悬细胞,饥饿24 h,然后调整细胞浓度为1 ×105ml-1,将200 μl 细胞悬液接种于Transwell(Transwell小室内预铺Matrigel 胶)小室的上室内;在24 孔板中加入600 μl 含有20% 胎牛血清的DMEM 培养基,然后将Transwell 小室放入24 孔板中;37℃5%CO2条件下培养24 h;取出Transwell 小室,用0.01 mol/L 的PBS 轻柔冲洗,然后用棉签轻柔擦除上室内黏附的细胞,在95%的乙醇中固定,最后采用结晶紫染色;在倒置显微镜下,随机选择5 个视野(×200),观察穿透小室的细胞数量,取其平均值,每实验组设3 个重复,每组实验均重复3 次。
1.7 统计学分析 采用SPSS16.0 软件对所得数据进行统计分析,选用成组设计的单因素方差分析。P<0.05 差异显著。
2 结果
2.1 miR-199a/b-3p 抑制PAK4 表达 在HEK 293T 细胞中,miR-199a/b-3p mimcs 和pmir GLOPAK4 3'UTR 共转组的荧光素酶活性显著低于对照组(图1),而miR-199a/b-3p mimcs 对pmirGLOPAK4 3'UTR 突变体没有抑制作用。在肝细胞癌SMMC-7721 细胞中,miR-199a/b-3p mimcs 转染组内源PAK4 蛋白表达被显著抑制(图2)。
2.2 miR-199a/b-3p 抑制SMMC-7721 细胞迁移侵袭 MiR-199a/b-3p mimcs 转染24 h、48 h 后的SMMC-7721 细胞,细胞迁移率与对照相比均降低(图3A);转染miR-199a/b-3pmimcs可显著抑制SMMC-7721 细胞的侵袭能力(图3B)。
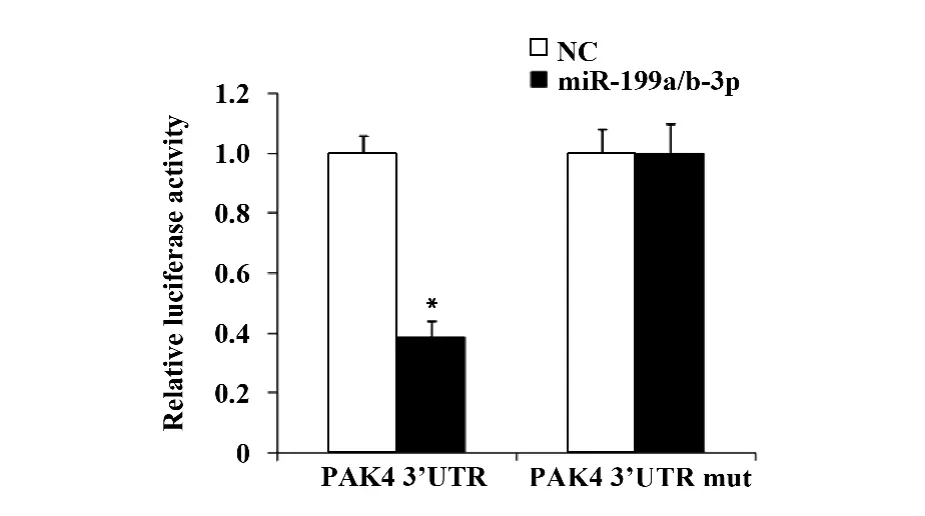
图1 miR-199a/b-3p 抑制PAK4 3'UTR 报告基因活性Fig.1 Inhibition effect of miR-199a/b-3p on PAK4 3'UTR
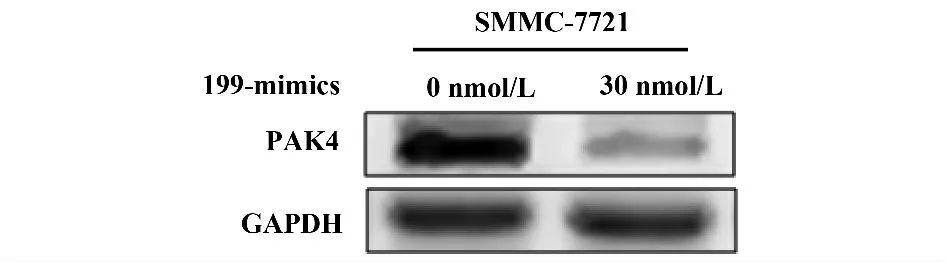
图2 miR-199a/b-3p 抑制内源PAK4 蛋白表达Fig.2 Expression of PAK4 inhibited by miR-199a/b-3p
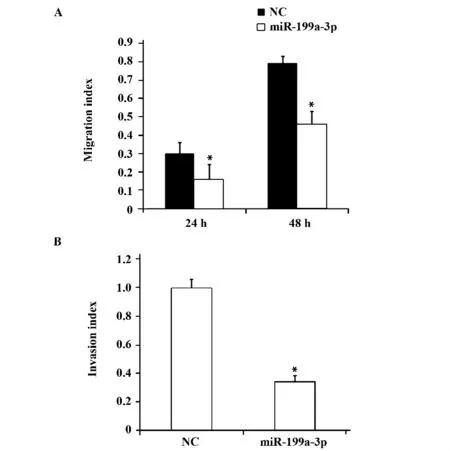
图3 miR-199a/b-3p 抑制SMMC-7721 迁移(A)、侵袭(B)Fig.3 Migration (A)and invasion (B)index of SMMC-7721 inhibited by miR-199a/b-3p
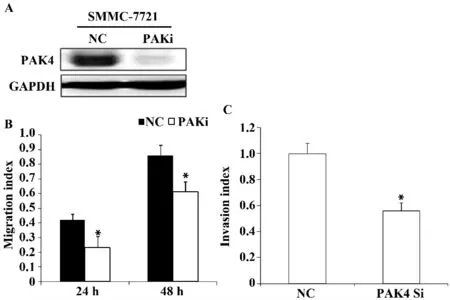
图4 SMMC-7721 干扰PAK4 表达后PAK4 表达量变化(A),干扰PAK4 抑制迁移(B)和侵袭(C)Fig.4 Expression (A),migration (B)and invasion (C)of PAK4 in SMMC-7721 cells transfected PAK4i
2.3 干扰PAK4 表达抑制SMMC-7721 细胞迁移侵袭 在肝细胞癌SMMC-7721 细胞中,转染PAK4 Si 24 h 后,检测PAK4 蛋白表达,与对照相比PAK4 蛋白表达量显著降低(图4A);抑制PAK4 表达24、48 h 后的SMMC-7721 细胞,细胞迁移率与对照相比均降低(图4B);而抑制PAK4 表达48 h 后SMMC-7721 细胞侵袭能力显著降低(图4C)。
3 讨论
肝细胞癌死亡率在我国占恶性肿瘤死亡率的第二位。接受根治性治疗的患者五年复发率可高达60%~70%,转移是其预后不良的主要原因[3,4]。因此,探索肝癌发生、发展和侵袭转移的分子机制,寻求新的治疗靶点,对于提高肝癌的疗效具有重要意义。microRNA(miRNA)是近年来发现的一类长度约为20~25 个核苷酸的具有转录后调节功能的非编码单链的小分子RNA,在人类基因组中,miRNA 多聚集在与肿瘤相关的一些基因多变区以及脆性位点[6],并且microRNA 可通过胞外体、微囊泡等形式由细胞主动分泌至血液中,再被受体细胞所摄取,从而调控受体细胞的功能,其异常表达与多种肿瘤的发生发展密切相关[7,8]。因此,miRNA 在肿瘤诊断、肿瘤分型、预后判断及基因治疗的作用越来越受到关注。
有研究显示miR-199a/b-3p 在肾癌细胞和骨肉瘤细胞中明显低表达,在78%(14/18)的肾癌组织中亦明显低表达;上调miR-199a/b-3p 可显著抑制肾癌细胞的增殖、存活和侵袭并能诱导细胞周期G1期阻滞[9,10]。而miR-199a/b-3p 在肝细胞癌(HCC)组织样本的表达水平与正常肝组织相比显著下调,在肝细胞癌细胞中外源表达miR-199a/b-3p 可显著抑制肝细胞癌细胞的增殖,超表达miR-199a/b-3p可抑制肝细胞癌异种移植物体积[11,12]。由此说明miR-199a/b-3p 抑制的靶基因在HCC 的存活发展中发挥重要作用,但其是否对于HCC 的转移具有抑制作用未见研究。因此,本研究拟探究miR-199a/b-3p对于HCC 转移的影响及相应的分子机制。在肝细胞癌SMMC-7721 中超表达miR-199a/b-3p 后,细胞的迁移侵袭能力明显下降,说明miR-199a/b-3p 具有抑制HCC 转移的能力。并且,miR-199a/b-3p 可以下调内源PAK4 蛋白的表达量,因此我们推测其抑制HCC 转移侵袭可能是通过下调PAK4 实现的。通过干涉内源的PAK4 表达,SMMC-7721 细胞迁移侵袭能力明显减弱,说明miR-199a/b-3p 抑制HCC转移,至少部分是通过靶向抑制PAK4 表达实现的。
[1]Bosch FX,Ribes J.Primary liver cancer:Worldwide incidence and trends[J].Gastroenterology,2004,127(15):S5-S16.
[2]陈建国,陈万青,张思维,等.2003-2007 年肝癌发病率与死亡率分析[J].中华流行病学杂志,2012,33(6):547-553.
[3]王永川,魏丽娟,刘俊田,等.发达与发展中国家癌症发病率与死亡率的比较与分析[J].中国肿瘤临床,2012,39(10):679-682.
[4]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90.
[5]中华人民共和国卫生部.原发性肝癌诊疗规范(2011 年版)[J].临床肝胆病杂志,2011,27(11):1141-1160.
[6]Acunzo M,Romano G,Wernicke D,et al.microRNA and cancer-a brief overview[J].Adv Biol Regul,2015,57:1-9.
[7]Yates LA,Norbury CJ,Gilbert RJ.The long and short of microRNA[J].Cell,2013,153(3):516-519.
[8]Lin XJ,Chong Y,Guo ZW,et al.A serum microRNA classifier for early detection of hepatocellular carcinoma:a multicentre,retrospective,longitudinal biomarker identification study with a nested case-control study[J].Lancet Oncol,2015,16(7):804-815.
[9]Jiang L,Cheng Q,Zhang BH.Circulating microRNAs as biomarkers in hepatocellular carcinoma screening:a validation set from China[J].Medicine (Baltimore),2015,94(10):e603.
[10]陶良俊,秦 超,曹 强,等.MicroRNA-199a-3p 在肾癌中的表达及作用[J].现代泌尿生殖肿瘤杂志,2012,4(4):229-232.
[11]沈艺南,卢军华.肝细胞病相关分子靶向治疗进展[J].临床肝胆病杂志,2015,31(1):130-134.
[12]李 强,卓其武,黄玉仙,等.从微小RNAs 看肝细胞癌诊治新视点[J].临床肝胆病杂志,2015,31(6):971-981.