参附注射液对脑缺血再灌注损伤大鼠Nrf2 信号通路的影响①
江承平 吴碧华 王柏强 罗 飞 何效平 王晓明 刘黎明
(川北医学院附属医院药剂科,南充 637007)
随着我国老龄化人口的加剧,缺血性脑血管病的发病率、致死率和致残率呈现逐年增加的趋势,给社会和家庭带来沉重的经济和精神负担[1]。对于缺血性脑血管病的治疗主要是在早期恢复缺血区的血流供应,然而再灌注后导致的脑损伤可以导致缺血所致的结构破坏和功能障碍进一步加重,因此,如何治疗缺血再灌注导致的神经损害,是目前研究的难点和热点。在以往研究中,本课题组及其他实验室均发现参附注射液可以在脑缺血再灌注损伤模型中发挥显著的神经保护作用[2,3],然而对于其发挥神经保护作用的具体机制,目前尚未完全阐明。Nrf2 是碱性亮氨酸拉链蛋白家族中的一员,以往研究发现其在脑缺血再灌注损伤、脑外伤、蛛网膜下腔出血和脊髓损伤等中枢神经系统急性损伤中的病理过程中发挥重要作用[4],本文通过探讨参附注射液对Nrf2 信号通路的影响,以期进一步阐述参附注射液发挥脑保护作用的机制。
1 材料与方法
1.1 实验动物及分组 68 只健康雄性成年SD 大鼠,体重230~270 g,清洁级,由川北医学院实验动物中心提供,许可证号SCXK(川2008-18),按随机数字表法分为:假手术组,脑缺血再灌注组,参附注射液治疗组;参附注射液购自雅安三九药业有限公司生产,批号为: 991202;脑缺血再灌注模型的制作参照以往文献[5]:使用水合氯醛(4 mg/kg)腹腔内注射将大鼠麻醉后,固定于手术台上,常规剔除颈毛消毒,铺无菌巾,将颈部皮肤切开后,暴露、分离出右侧颈总动脉、颈内动脉、颈外动脉和翼腭动脉,用丝线将颈总动脉近心端结扎,并用丝线在颈外动脉起始端结扎,采用微动脉夹将颈内动脉的远端夹住,在颈总动脉的备用线近端距离颈外动脉分叉0.6 cm处,采用显微剪刀剪开一小口,然后将先栓插进颈总动脉至微动脉夹处,使用备用线扎紧,松开动脉夹后,将线栓继续插入到大脑中动脉起始部,以阻断大脑中动脉的血流,当大鼠右侧虹膜颜色开始变浅时,开始记录缺血时间,同时逐层缝合切口出组织,于缺血后2 h 小心抽出栓线以实现缺血再灌注。术中严密监测大鼠的心率、血压和体温,使用电热毯将大鼠体温维持在生理范围内。参附注射液在术后1 h 通过尾静脉注射(8 mg/kg),假手术组和模型组于术后1 h 给予尾静脉注射生理盐水处理(8 mg/kg),所有实验大鼠饲养于清洁环境,室温20℃~24℃,避免强光及噪声刺激,自由进食和饮水。
1.2 大鼠外伤后神经功能评分 大鼠缺血再灌注损伤后24 h 的神经功能评分采用Longa 法[6]:0 分未出现神经损伤症状,1 分不能完全伸展对侧前爪;2 分:向对侧转圈;3 分:向对侧倾倒;4 分:不能自发行走,意识丧失。
1.3 Western blot 法检测 脑缺血再灌注24 h 后,使用水合氯醛将大鼠麻醉,经心尖灌注100 ml 的生理盐水,取右侧额顶叶脑皮质放入-80℃冰箱中保存待用。细胞核和细胞浆蛋白的提取参照试剂盒说明书进行,Bradford 法蛋白定量,按1∶4比例加入5×loading 沸水中煮10 min,变性,按每孔加入35 μg蛋白,电泳、转膜后封闭1 h,加入Nrf2、cleavedcaspase-3、血红素加氧酶1(heme oxygenase 1,HO-1),醌氧化还原酶1[NAD(P)H,quinine oxidoreductase 1,NQO1],β-actin,H3(1∶1 000,均购自美国cell signaling 公司)一抗稀释液,4℃摇床过夜,加入二抗稀释液,室温孵育1 h,洗膜,滴加ECL 发光液,曝光,Image J 软件进行灰度分析。
1.4 尼氏染色结果分析 尼氏染色步骤参考以往文献[7]。石蜡切片(4 μm)经 二甲苯中充分脱蜡后,将切片依次放入 无水乙醇5 min,90%乙醇2 min,70%乙醇2 min,蒸馏水2 min;然后放入尼氏染色液(碧云天)染色8 min,染色时温度控制在37℃,蒸馏水洗涤2 次,95% 乙醇约5 s,可以用70%乙醇洗涤2 次后透明和封片,镜下观察并计数。
1.5 免疫组化染色步骤 将石蜡包埋的脑切片常规脱蜡和水化,PBS 充分冲洗后,蒸馏水浸泡后抗原修复,洗涤后滴加过氧化酶阻断溶液,室温孵育30 min。PBS 洗涤后滴加免疫血清封闭液(碧云天),室温孵育30 min 后滴加cleaved-caspase-3 稀释液(1∶50)。PBS 冲洗后在37℃烘箱孵育1 h 后,PBS洗涤后滴加生物素标记的二抗(中山金桥,羊抗兔IgG),室温孵育1 h。PBS 冲洗后滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min 后采用DAB显色剂显色。蒸馏水冲洗后,采用苏木素复染,酒精脱水干燥,二甲苯透明,中性树胶封片,镜下观察并计数。
1.6 统计学分析 采用SPSS15.0 软件进行结果的处理,数据以±s 表示,神经功能评分采用Kruskal-Wallis 检验,其余多组间比较采用单因素方差分析进行。
2 结果
2.1 一般情况和神经功能评分 本研究共使用大鼠68 只,死亡8 只,假手术组大鼠未出现死亡,其中模型组死亡5 只,参附注射液治疗组3 只,两组死亡率无明显差异,每组大鼠数量随机补齐。假手术大鼠未出现神经功能评分缺损,与假手术组相比,脑缺血再灌注组大鼠的神经功能缺损评分显著增加(4.05 ±0.19);参附注射液治疗组的神经功能评分显著降低(2.82 ±0.09),两组相比有显著统计学差异(P<0.05)。
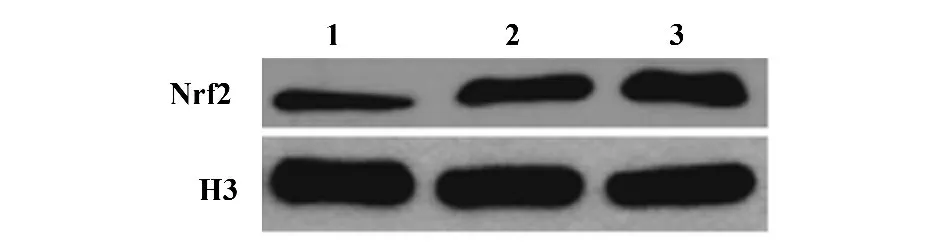
图1 各组中Nrf2 蛋白的表达量Fig.1 Expression of Nrf2 in each group
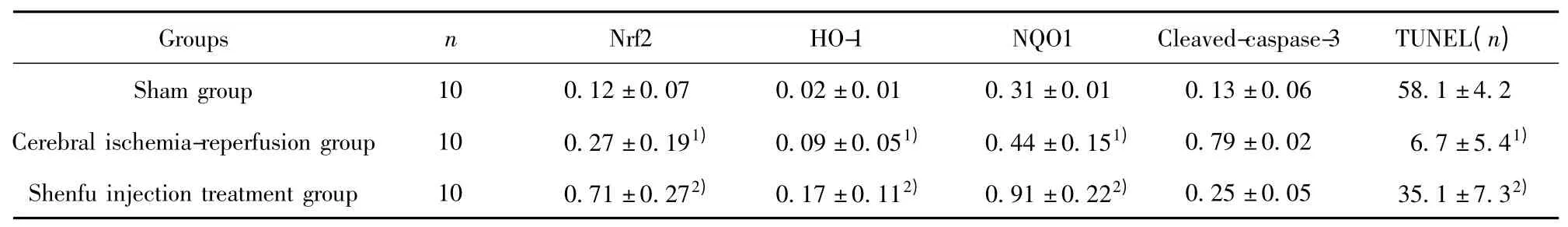
表1 各组中Nrf2、HO-1、NQO1 和cleaved-caspase-3 表达量及尼氏染色结果Tab.1 Analysis of Nrf2,HO-1,NQO1 and cleaved-caspase-3 expression and Nissl staining in each group
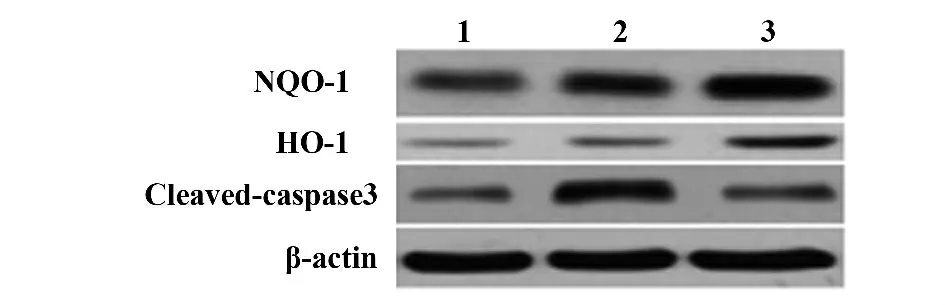
图2 各组中HO-1,NQO1 和cleaved-caspase-3 的表达Fig.2 Expression of HO-1,NQO1 and cleaved-caspase-3 in each group
2.2 参附注射液对于Nrf2、HO-1 和NQO1 表达的影响 与假手术组相比(图1,2;表1),缺血再灌注组脑组织中Nrf2、HO-1 和NQO1 蛋白的表达明显增加(P<0.05);与缺血再灌注组大鼠相比,参附注射液治疗可以进一步增加Nrf2,HO-1 和NQO1 蛋白的表达(图1,2;表1,P<0.05)。此外,参附注射液可以抑制脑缺血再灌注引起的cleaved-caspase-3 蛋白的表达(图2;表1,P<0.05),这个结果在免疫组化染色中得到进一步的印证(图3)。
2.3 尼氏染色结果 尼氏染色结果显示,在假手术组中神经元大而圆,细胞形态完好;脑缺血再灌注组中,出现大量固缩的神经元,完整无损伤的神经元个数显著减少(图3,表1,P<0.05);参附注射液治疗组中,固缩神经元的数量明显减少,完整神经元较脑缺血再灌注组显著增加(图3,P<0.05)。
3 讨论
在生理状态下,Nrf2 主要与细胞质接头蛋白Keap1 结合形成复合体存在于细胞浆中,当细胞受到亲电试剂或者ROS 刺激时,Nrf2 发生磷酸化并与Keap1 蛋白发生解偶联,脱离Keap1 蛋白束缚的蛋白质从胞浆中转移到胞核内,与基因启动子区域中的抗氧化反应元件序列结合,并启动抗氧化酶、蛋白酶体和泛素酶的基因表达,显著提高细胞的抗氧化应激能力。以往研究发现Nrf2 在脑缺血再灌注损伤模型中的表达量在2 h 增加至8 h 达到高峰[8],给予Nrf2 的激活剂叔丁基对苯二酚可以显著减少缺血再灌注导致的神经元凋亡和梗死面积,显著改善神经功能评分[9];而敲除Nrf2 基因的小鼠在脑缺血再灌注后其梗死面积明显增加,神经功能缺损明显加重;此外,研究还发现上调Nrf2 表达的药物可以显著减少神经元的损伤[10-12],显著改善神经功能的预后,提示上调Nrf2 信号通路的活性可以显著改善脑缺血再灌注损伤的预后。
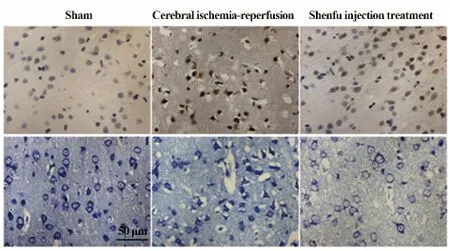
图3 各组大鼠脑组织中cleaved-caspase-3 的免疫组化染色(上图)和尼氏染色(下图)结果Fig.3 Immunohistochemical analysis and Nissl staining of cleaved-caspase-3 in each group
本研究结果发现,参附注射液治疗可以显著改善脑缺血再灌注损伤大鼠的神经功能评分,明显减少受损神经元的个数,这与以往的研究具有一致性[13],表明参附注射液具有良好的神经保护作用。进一步行机制研究发现,与假手术组相比,脑缺血再灌注损伤大鼠脑组织中Nrf2 蛋白的表达量在伤后24 h 显著升高;此外,参附注射液可以进一步上调Nrf2 下游蛋白HO1 和NQO1 的表达量,这可能是其发挥抗氧化作用的机制。Cleaved-caspase-3 是凋亡的关键执行蛋白,以往大量研究表明cleavedcaspase-3 蛋白的表达量在脑缺血再灌注的脑组织中增加,从而导致神经元凋亡的发生,抑制cleavedcaspase-3 蛋白的表达量可以显著减少脑缺血再灌注引起的神经元凋亡;在脑缺血再灌注模型中,Nrf2激活后可以显著抑制cleaved-caspase-3 蛋白的表达,减少神经元的损害[14];本研究结果表明参附注射液可以显著抑制凋亡关键执行蛋白cleavedcaspase-3 的表达量,从而减少神经元的损伤程度,改善神经功能缺损评分。结合以往研究结果,提示参附注射液可能通过上调Nrf2 信号通路的活性在脑缺血再灌注损伤中发挥神经保护作用。综上所述,参附注射液治疗可以显著上调脑缺血再灌注后Nrf2 蛋白的表达,并调节下游一系列产物的表达,这可能是参附注射液发挥神经保护作用的机制之一。
[1]刘 敏,方向华.脑卒中后残疾的研究进展[J].中华流行病学杂志,2013,34(11):1146-1150.
[2]江承平,刘 福,李 毅,等.脑缺血再灌注损伤模型大鼠参附注射液干预后热休克蛋白70 的表达[J].中国组织工程研究与临床康复,2011,15(41):7661-7664.
[3]江承平,刘 福,李 毅,等.参附注射液对脑缺血再灌注大鼠MDA、SOD、TXB2 及6-keto-PGF1a 的影响及意义[J].中国医科大学学报,2012,41(2):124-127.
[4]Zhang M,An C,Gao Y,et al.Emerging roles of Nrf2 and phase II antioxidant enzymes in neuroprotection[J].Prog Neurobiol,2013,100:30-47.
[5]Varshosaz J,Taymouri S,Pardakhty A,et al.Niosomes of ascorbic acid and alpha-tocopherol in the cerebral ischemia-reperfusion Model in male rats[J].Biomed Res Int,2014,2014:816103.
[6]Yan C,Zhang J,Wang S,et al.Neuroprotective effects of rutaecarpine on cerebral ischemia reperfusion injury[J].Neural Regen Res,2013,8(22):2030-2038.
[7]Zhuang Z,Zhou ML,You WC,et al.Hydrogen-rich saline alleviates early brain injury via reducing oxidative stress and brain edema following experimental subarachnoid hemorrhage in rabbits[J].BMC Neurosci,2012,13:47.
[8]Tanaka N,Ikeda Y,Ohta Y,et al.Expression of Keap1-Nrf2 system and antioxidative proteins in mouse brain after transient middle cerebral artery occlusion[J].Brain Res,2011,1370:246-253.
[9]Kam KY,Yu SJ,Jeong N,et al.p-Hydroxybenzyl alcohol prevents brain injury and behavioral impairment by activating Nrf2,PDI,and neurotrophic factor genes in a rat model of brain ischemia[J].Mol Cells,2011,31(3):209-215.
[10]Li M,Zhang X,Cui L,et al.The neuroprotection of oxymatrine in cerebral ischemia/reperfusion is related to nuclear factor erythroid 2-related factor 2(nrf2)-mediated antioxidant response:role of nrf2 and hemeoxygenase-1 expression[J].Biol Pharm Bull,2011,34(5):595-601.
[11]Ding Y,Chen M,Wang M,et al.Neuroprotection by acetyl-11-keto-beta-Boswellic acid,in ischemic brain injury involves the Nrf2/HO-1 defense pathway[J].Sci Rep,2014,4:7002.
[12]Ding Y,Chen M,Wang M,et al.Posttreatment with 11-Keto-beta-Boswellic acid ameliorates cerebral ischemia-reperfusion injury:Nrf2/HO-1 pathway as a potential mechanism[J].Mol Neurobiol,2014,10.1007/s12035-014-8929-9.
[13]江承平,刘 福,李 毅,等.参附注射液对大鼠脑缺血再灌注损伤后MMP-9 和TIMP-1 表达的影响[J].中华神经医学杂志,2012,11(1):20-23.
[14]Li M,Zhang X,Cui L,et al.The neuroprotection of oxymatrine in cerebral ischemia/reperfusion is related to nuclear factor erythroid 2-related factor 2(nrf2)-mediated antioxidant response:role of nrf2 and hemeoxygenase-1 expression[J].Biol Pharm Bull,2011,34(5):595-601.