Gab2 过表达对人结直肠癌SW480 细胞株增殖和迁移的影响①
丁陈波 冯继红 杨丽文 李龙梅 李姗姗 陈 超 罗军敏
(遵义医学院免疫学教研室,贵州省免疫学研究生教育创新基地,遵义 563003)
结直肠癌(Colorectal cancer,CRC)是临床常见的消化道恶性肿瘤之一,其发病率逐年增高,且死亡率在所有消化道肿瘤中增长最快。快的增长率和肿瘤细胞转移是导致其生存率降低的两大主要原因,抑制肿瘤生长及转移,促进其凋亡可以达到降低死亡率的目的。支架蛋白Gab2(Grb2-associated binding protein 2)作为Gabs 家族蛋白(Grb2-associated binder family proteins)最主要成员之一,在细胞增殖、迁移及凋亡等生理过程中发挥重要作用[1,2]。近年研究表明,Gab2 在多数人类恶性肿瘤中表达增高,且Gab2 过表达促进肿瘤细胞增殖及迁移能力,进而影响肿瘤的进程。我们前期研究发现Gab2 在直肠癌组织中高表达,且其表达水平与临床分期及淋巴结转移密切相关[3]。本研究在此基础上应用慢病毒载体感染人结直肠癌细胞SW480,初步观察Gab2 过表达后对SW480 增殖和迁移能力的影响,从而在细胞水平阐明Gab2 的生物学作用。
1 材料与方法
1.1 主要材料 人结直肠癌SW480 细胞株购自中科院上海细胞库;Leibovitz's L-15 (L-15)培养基购自Gibco 公司;胎牛血清购自Hyclone 公司;含Gab2基因过表达的重组慢病毒颗粒由Cyagen 公司包被完成;Gab2 兔抗人单克隆抗体购自OriGene 公司,HRP 标记的山羊抗兔多克隆抗体、β-actin 小鼠抗人单克隆抗体、HRP 标记的山羊抗小鼠多克隆抗体、ECL 发光液、BCA 蛋白浓度测定试剂盒和SDSPAGE 凝胶配制试剂盒购自碧云天公司;全蛋白提取试剂盒购自凯基生物科技有限公司;Trizol 试剂、反转录试剂盒和qRT-PCR 试剂盒购自TaKaRa 公司;PCR 引物由上海生工生物工程有限公司合成。
1.2 实验方法
1.2.1 细胞培养与慢病毒感染 人结直肠癌SW480细胞培养于含10%胎牛血清的L-15 培养基中,培养条件为37℃、5%CO2饱和湿度。取对数生长期的SW480 细胞接种于6 孔板中,待细胞生长融合约75%左右时,按慢病毒感染说明书进行感染。共分为3 组:以Gab2 基因过表达重组慢病毒颗粒(LV-Gab2-GFP)和对照慢病毒颗粒(LV-GFP)分别感染人结直肠癌SW480 细胞,作为实验组(LV-Gab2-GFP 组)和阴性对照组(LV-GFP 组),空白对照组细胞不作任何处理,常规培养。感染条件:每孔1 ml 培养基,含10%胎牛血清,109TU/ml 病毒液(10 μl),polybrene 5 μg,感染8 h 后倒去培养基,加入2 ml 完全培养基,48 h 后更换完全培养基,荧光显微镜下观察感染效率。大量扩增细胞,进入下一步实验。
1.2.2 qRT-PCR 检测细胞Gab2 mRNA 的表达 按照Trizol 说明书方法提取各组细胞总RNA,按反转录试剂盒说明反转录成cDNA,PCR 循环扩增。Gab2 上游引物:5'-GTGGGGGATCTGAATGTTTTTATG-3',下游引物:5'-GCCCCAGGGTAGAATGAAACG-3';内参GAPDH 上游引物:5'-GAAGGTGAAGGTCGGAGTC-3',下游引物:5'-GAAGATGGTGATGGGATTTC-3'。反应条件:95℃预变性5 min;45 个循环,95℃20 s,60℃1 min;72℃延伸5 min。运用2-ΔΔCT法计算mRNA 的相对表达量。实验重复3 次。
1.2.3 Western blot 检测细胞Gab2 蛋白的表达 以细胞裂解液裂解提取各组细胞总蛋白,用BCA 法测定蛋白含量。将蛋白于10%聚丙烯酰胺凝胶电泳分离,电转膜1.5 h,5% BSA 封闭1 h 后,分别加入Gab2 兔抗人单克隆抗体(1∶1 000)及β-actin 小鼠抗人单克隆抗体(1∶1 000),4℃孵育过夜漂洗,加二抗(1∶2 000)室温孵育1 h 滴加发光试剂暗室曝光显示条带。
1.2.4 CCK-8 法检测3 组细胞增殖的变化 参照CCK-8 试剂说明进行。分别取上述3 组细胞以4 ×103/孔的密度接种于96 孔培养板(100 μl/孔),37℃、5% 的CO2条件下培养24 h 后,加入10 μl CCK-8 继续孵育2 h 后,用酶标仪在450 nm 波长下检测各孔的吸光度值。每隔24 h 检测一次,每组设3 个复孔,实验重复3 次。
1.2.5 单细胞克隆形成实验 将3 组细胞接种至6 孔板(400 个/孔),置37℃、5%的CO2培养箱常规培养,连续15 d,终止培养后常规以PBS 缓冲液洗涤细胞,甲醛固定15 min,采用结晶紫染液染色后,在显微镜下计数细胞数>50 个的细胞克隆,计算克隆形成率:克隆形成率=克隆数/接种细胞数×100%。
1.2.6 细胞划痕实验 将3 组细胞以每孔1 ×105接种于24 孔板中,放入37℃、5%的CO2培养箱常规培养。待细胞贴壁后,取一无菌1 ml 枪头用其尖端分别在24 孔板各组细胞上垂直划痕。PBS 清洗细胞去除划下的细胞,加入完全培养基继续培养,在24 h 后倒置相差显微镜下观察划痕中细胞迁移情况并拍照。
1.3 统计学分析 所有数据采用SPSS19.0 统计分析,组间比较用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 感染SW480 细胞后荧光显微镜观察感染效果 慢病毒载体感染SW480 细胞48 h 后,通过荧光强度判断感染效果。倒置荧光显微镜观察发现,感染后大部分细胞均有GFP 表达,感染效率达70%以上(图1)。
2.2 Gab2 mRNA 在3 组细胞中的表达 RT-PCR检测结果显示,实验组(LV-Gab2-GFP 组)的Gab2 mRNA 表达较另外两组明显增强,而阴性对照组(LV-GFP 组)和空白对照组的Gab2 mRNA 表达均很弱,且两组间无明显差异性(图2A)。
2.3 Gab2 蛋白在3 组细胞中的表达 Western blot检测结果发现,实验组(LV-Gab2-GFP 组)较阴性对照组(LV-GFP 组)和空白对照组Gab2 蛋白表达水平明显上调,而阴性对照组(LV-GFP 组)和空白对照组无显著差异性(图2B)。
2.4 Gab2 过表达对SW480 增殖的影响
2.4.1 CCK-8 检测结果 培养24 h 时,3 组细胞的增殖速度均无明显差异性(P >0.05);从48 h 到72 h 各个时间点,实验组(LV-Gab2-GFP 组)的细胞增殖速度均明显高于另外两组(P<0.05),而阴性对照组(LV-GFP 组)与空白对照组相比,各个时间点的细胞增殖速度均无明显差异性(P >0.05)(图3)。实验结果表明Gab2 过表达能够增强SW480 细胞的增殖能力。

图1 慢病毒感染SW480 细胞荧光表达情况Fig.1 Lentivirus infection of SW480 cells and GFP expression
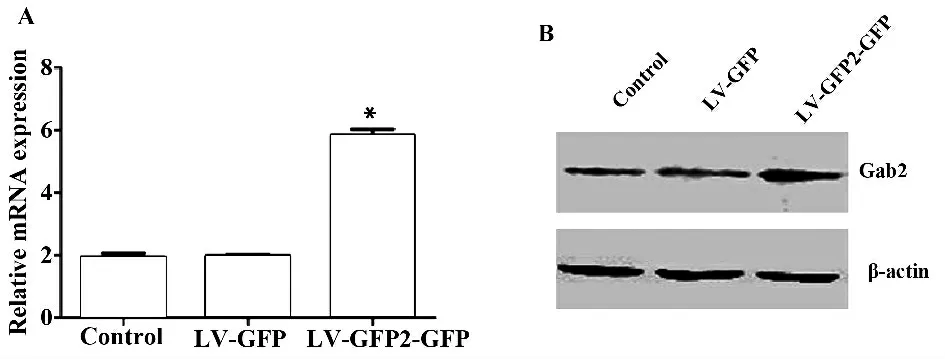
图2 RT-PCR 和Western blot 检测Gab2 在SW480 细胞中的表达Fig.2 Expression of Gab2 in SW480 cells were detected by RT-PCR and Western blot

图3 Gab2 过表达对SW480 细胞增殖能力的影响Fig.3 Effects of Gab2 overexpression on proliferation of SW480 cells

图4 Gab2 过表达对SW480 细胞克隆形成的影响Fig.4 Effects of Gab2 overexpression on clone formation of SW480 cells

图5 Gab2 过表达对SW480 细胞迁移能力的影响(SP,×40)Fig.5 Effects of Gab2 overexpression on migration of SW480 cells(SP,×40)
2.4.2 单细胞克隆形成结果 实验组(LV-Gab2-GFP 组)细胞克隆形成率(85.10 ±5.38)%明显高于阴性对照组(LV-GFP 组)细胞克隆形成率(51.13±10.46)%和空白对照组细胞克隆形成率(53.43±8.79)%,差异具有统计学意义(P<0.01),阴性对照组(LV-GFP 组)与空白对照组之间差异不显著(P >0.05)(图4)。实验结果表明Gab2 过表达能够增强SW480 细胞克隆形成的能力。
2.5 Gab2 过表达对SW480 细胞迁移能力的影响 划痕实验结果显示,实验组(LV-Gab2-GFP 组)细胞迁移能力较另外两组明显增强(P<0.05),阴性对照组(LV-GFP 组)与空白对照组差异不明显(P >0.05)(图5)。实验结果表明Gab2 过表达能够增强SW480 细胞的迁移能力。
3 讨论
结直肠癌的发病率逐年上升,现居全球癌症的第4 位[4]。尽管目前治疗手段多样,但疗效不尽人意,快的增长率和重要脏器的转移是结直肠癌患者死亡的主要原因。因此,与结直肠癌增殖及转移相关的生物学标志是目前结直肠癌研究的热点问题。
Gabs 家族蛋白(Grb2-associated binder family proteins)是一类广泛表达的支架蛋白,该家族成员包括哺乳动物内Gab1~Gab4,果蝇属DOS,海葵内Ne-Gab 及秀丽线虫内Soc1[1]。Gab2 作为Gabs 家族的重要成员之一,主要介导SHP2/ERK 途径和PI3K/AKT 途径,对细胞增殖、分化、粘附及迁移等生物学功能至关重要[1]。近些年来,随着对Gab2研究的不断深入,Gab2 在多种恶性肿瘤中所发挥的作用正逐渐被揭示,Gab2 可能作为一种致癌基因,在不同的肿瘤中发挥关键调节作用。在乳腺癌中,Gab2 蛋白和ErbB2 (Neu,HER2)表达同时增高时,通过Gab2 介导的SHP2/ERK 信号通路提高乳腺肿瘤的恶性程度及肿瘤细胞的侵袭能力[5]。Wohrle等[6]发现,Gab2 通过SHP2/RAS/ERK 及PI3K/AKT/mTOR 信号通路,可以增强慢性粒细胞白血病(CML)细胞的增殖和存活能力,而敲除Gab2 基因会明显抑制细胞增殖和存活。另外,在NRAS 突变诱导的黑色素瘤中,Gab2 通过激活RAS/ERK 信号通路,促进黑色素瘤细胞增殖及肿瘤血管的生成[7]。研究表明,在卵巢癌中通过激活PI3K/Zeb1通路,Gab2 过表达启动了上皮间质转换(Epithelialto-mesenchymal transition,EMT)程序,抑制了E-ca的表达,从而增加肿瘤细胞迁移和侵袭能力[8]。Dunn 等[9]也发现,Gab2 可以作为卵巢癌的一种致癌基因,可通过活化PI3K 信号途径诱导卵巢癌细胞发生转变。除此之外,Gab2 在肺癌、神经胶质瘤及胃癌中表达异常,并与肿瘤进程密切相关[10-12]。
本研究通过Gab2 基因的重组慢病毒颗粒(LVGab2-GFP)感染人结直肠癌SW480 细胞,观察Gab2过表达对细胞增殖和迁移能力的影响。我们发现LV-Gab2-GFP 慢病毒载体能够被高效的感染SW480 细胞,并在SW480 细胞过表达Gab2 mRNA和蛋白。进一步研究结果显示,过表达Gab2 的SW480 细胞增殖和迁移能力显著增强。提示Gab2在人结直肠癌细胞增殖及转移过程中发挥了重要作用,但Gab2 促进人结直肠癌细胞增殖和迁移的作用机制需要作进一步深入研究。
综上所述,Gab2 在人类多种恶性肿瘤的增殖、迁移及浸润过程中扮演了重要角色。本研究初步证实了Gab2 过表达能够促进人结直肠癌SW480 细胞增殖和克隆形成,并增强细胞迁移能力。这些提示Gab2 可能作为一个新的结直肠癌的癌基因被用于结直肠癌的早期诊断与治疗,也为进一步研究Gab2的生物学功能及其作用分子机制提供基础理论依据。
[1]Wohrle F U,Daly R J,Brummer T.Function,regulation and pathological roles of the Gab/DOS docking proteins[J].Cell Commun Signal,2009,7(22):10.1186.
[2]Nakaoka Y,Komuro I.Gab docking proteins in cardiovascular disease,cancer,and inflammation [J].Int J Inflam,2013,2013:141068.
[3]丁陈波,冯继红,于伟娜,等.Gab2 在结直肠癌组织中的表达及其意义[J].中国免疫学杂志,2015,31(2):160-162.
[4]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[5]Bentires-Alj M,Gil SG,Chan R,et al.A role for the scaffolding adapter GAB2 in breast cancer [J].Nat Med,2006,12(1):114-121.
[6]Wohrle F U,Halbach S,Aumann K,et al.Gab2 signaling in chronic myeloid leukemia cells confers resistance to multiple Bcr-Abl inhibitors[J].Leukemia,2013,27(1):118-129.
[7]Yang Y,Wu J,Demir A,et al.GAB2 induces tumor angiogenesis in NRAS-driven melanoma [J].Oncogene,2013,32 (31):3627-3637.
[8]Wang Y,Sheng Q,Spillman MA,et al.Gab2 regulates the migratory behaviors and E-cadherin expression via activation of the PI3K pathway in ovarian cancer cells[J].Oncogene,2012,31(20):2512-2520.
[9]Dunn G P,Cheung H W,Agarwalla P K,et al.In vivo multiplexed interrogation of amplified genes identifies GAB2 as an ovarian cancer oncogene[J].Proc Natl Acad Sci USA,2014,111(3):1102-1107.
[10]Zhang X,Zhang Y,Tao B,et al.Docking protein Gab2 regulates mucin expression and goblet cell hyperplasia through TYK2/STAT6 pathway[J].FASEB J,2012,26(11):4603-4613.
[11]Shi L,Sun X,Zhang J,et al.Gab2 expression in glioma and its implications for tumor invasion[J].Acta Oncol,2013,52(8):1739-1750.
[12]Lee SH,Jeong EG,Nam SW,et al.Increased expression of Gab2,a scaffolding adaptor of the tyrosine kinase signalling,in gastric carcinomas[J].Pathology,2007,39(3):326-329.