激活素A 与NGF 协同刺激鸡胚背根神经节神经突起生长①
方 琳 王轶楠 葛敬岩 刘海岩 李晨光 李继茹 柳忠辉
(长春医学高等专科学校基础医学部,长春 130031)
激活素A(Activin A)属于转化生长因子-β(TGF-β)超家族成员的多功能生长和分化因子[1,2],具有多种生物学活性,可以维持中枢神经系统神经元存活及保护神经元免受神经毒损伤作用[3-5]。我们先前的研究已经证实激活素A 可以促进鸡胚背根神经节(Dorsal root ganglion,DRG)神经突起生长和维持神经元存活,而神经生长因子(Nerve growth factor,NGF)也可以促进DRG 神经突起生长和维持神经元存活[6-8],但是二者对DRG 神经突起生长是否具有协同作用仍不清楚。本研究采用8 日龄的鸡胚背根神经节体外原代培养法,探讨Activin A 对NGF 促进DRG 神经突起生长及维持神经元存活的影响。
1 材料与方法
1.1 实验材料 8 日龄鸡胚(购自长春市种鸡厂),3 次独立试验共用鸡胚48 只。DMEM 培养基为GIBCO 公司产品,鼠神经生长因子(NGF)购自武汉海特生物制药股份有限公司,Activin A 来自R&D公司。甲醇(HPLC 级)、乙腈(色谱纯)、丙酮。
1.2 实验方法
1.2.1 鸡胚神经节的制备与培养 1 mg/ml 多聚赖氨酸,37℃包被培养2 h,0.01 mol/L 磷酸盐缓冲溶液(PBS)冲洗3~4 次备用。取8 日龄的鸡胚,按本室常规方法获取鸡胚背根神经节[9,10]。在各椎孔处分别夹起神经节,放于预先置有0.5%小牛血清(FCS)DMEM 培养液200 μl 的培养孔内,在37℃、5%CO2培养箱培养。阴性对照组每孔加入0.5%小牛血清DMEM 培养液200 μl;NGF 组每孔加入终浓度4 ng/ml 的NGF;联合实验组,同时加入Activin A(5ng/ml)和NGF(4 ng/ml)。37℃、5%CO2培养箱培养72 h,在显微镜下观察DRG 神经突起的生长状态。
1.2.2 鸡胚神经节神经突起的生长判定 用倒置显微镜观察,通过统计学分析,比较不同组别的神经突起数量和长度,因为第3 天的神经突起生长明显,所以我们在第3 天时对神经突起的数量与长度进行判定。在各实验组我们分别对每个神经节选择5 个最长的神经突起计算平均值,以DRG 边缘作为测量的起点,以神经突起的最末端为测量的终点[11]。
1.2.3 鸡胚神经节细胞的制备与培养 按本室常规方法获取鸡胚背根神经节细胞[9,10]。用0.5%小牛血清DMEM 培养液调整细胞浓度至6.5 ×104个/孔加入48 孔培养板。阴性对照组每孔加入0.5%小牛血清DMEM 培养液200 μl;NGF 组每孔加入终浓度4 ng/ml 的NGF;联合实验组,同时加入Activin A(5 ng/ml)和NGF(4 ng/ml)。在37℃、5%CO2培养箱培养。每3 d 换一次培养液。在第5 天时用倒置相差光学显微镜观察神经元生长情况。
1.2.4 鸡胚DRG 细胞的活力测定 采用台酚蓝染色法,用血球计数板在高倍放大镜下计数DRG 细胞中活细胞数量。尼氏小体是神经元的特异标志,为了计算活细胞中神经元的数量,用甲苯胺蓝染尼氏小体。培养的DRG 细胞小片用PBS 洗3 次,每次5分钟,加一滴1%甲苯胺蓝染液,37℃孵育30 min,用蒸馏水洗一遍,最后中性树脂封片。数200 个细胞中有尼氏小体阳性细胞数,神经元数按以下公式计算。。
1.2.5 半定量PCR 48 孔板培养,每孔放40 个DRG,1 ml 预冷的PBS 洗1 次,加入TRIZOL 试剂1 ml 提取DRG 总RNA,紫外分光光度计测RNA 含量。CGRP 的正向引物5'-ctgcagcctggatagaccta-3',反向引物5'-caggcacaaaaagagtctacg-3'。GAPDH 的正向引物5'-gtccaagtggtggccatcaa-3',反向引物5'-gctgagggagctgagatgat-3'。二步法RT-PCR 扩增的特异cDNA片段,半定量PCR 反应总体积25 μl,cDNA 3 μl,10 ×PCR 缓冲液2.5 μl,dNTP Mix 1.5 μl,Taq DNA聚合酶0.3 μl,上游引物1 μl,下游引物1 μl,加无菌双蒸水至总体积25 μl。反应条件为预变性95℃,90 s,变性94℃,30 s,退火54℃,30 s,延伸72℃,1 min,共35 个循环,最后延伸72℃,10 min。以GAPDH 作为内参照半定量,各样本表达强度=样本灰度值/GAPDH 灰度值。1.5%琼脂糖凝胶电泳,Pharmacia VDS 成像系统分析目的片段,采用GAPDH 作为内参照。
2 结果
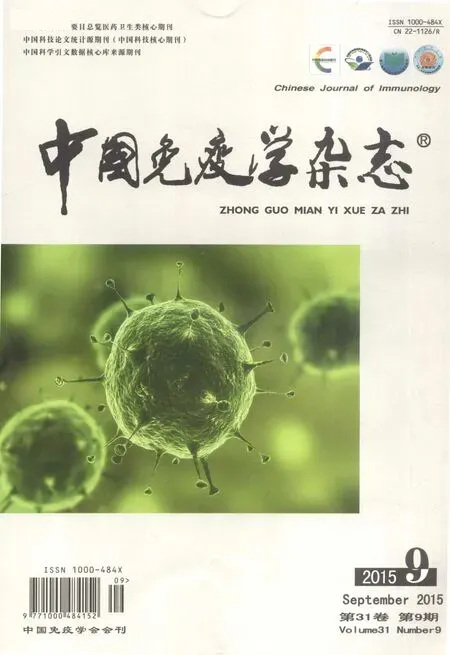
2.1 Activin A 增强NGF 促进DRG 神经突起生长 NGF 具有刺激DRG 神经突起生长的作用,本研究联合Activin A 与NGF 共同作用DRG 的结果显示,0.5% FCS-DMEM 培养液培养3 天的阴性对照组未见明显DRG 神经突起生长(图1A),NGF 4ng/ml 组突起生长较多(图1B),突起长度(123 ± 5.1)μm,联合实验组(Activin A 5 ng/ml +NGF 4 ng/ml)突起生长密且长(图1C),突起长度(151 ± 20.5)μm,与NGF 组比较差异显著(图2),P<0.05。上述资料提示Activin A 能够增强NGF 促进DRG 神经突起生长。
2.2 Activin A 增加NGF 维持的DRG 神经细胞生存数量 DRG 神经元在体外培养5 天,阴性对照组神经元存活已极少(图3A),存活细胞数量为200 ±80 个细胞/孔,10 天时已无神经元存活,但在培养10 天时,NGF 组(NGF 4ng/ml)仍有部分神经元存活,形态良好,细胞数量(21 000 ±1 600)个细胞/孔(图3B),Activin A 5 ng/ml+NGF 4 ng/ml 联合组在培养第10 天仍有大量神经元存活,且有较长的神经突起延伸(图3C),存活细胞数量为(32 000 ± 1 300)个细胞/孔(图4)。上述资料提示Activin A 能明显增加NGF 维持的DRG 神经元存活数量。
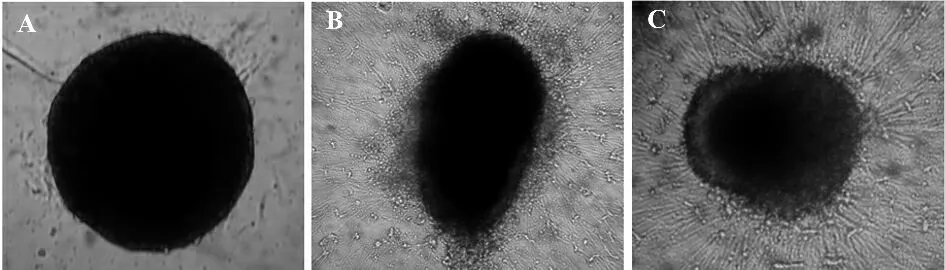
图1 激活素A 与NGF 联合促进神经突起生长(×200)Fig.1 DRG neurite outgrowth induced by activin A and NGF(×200)
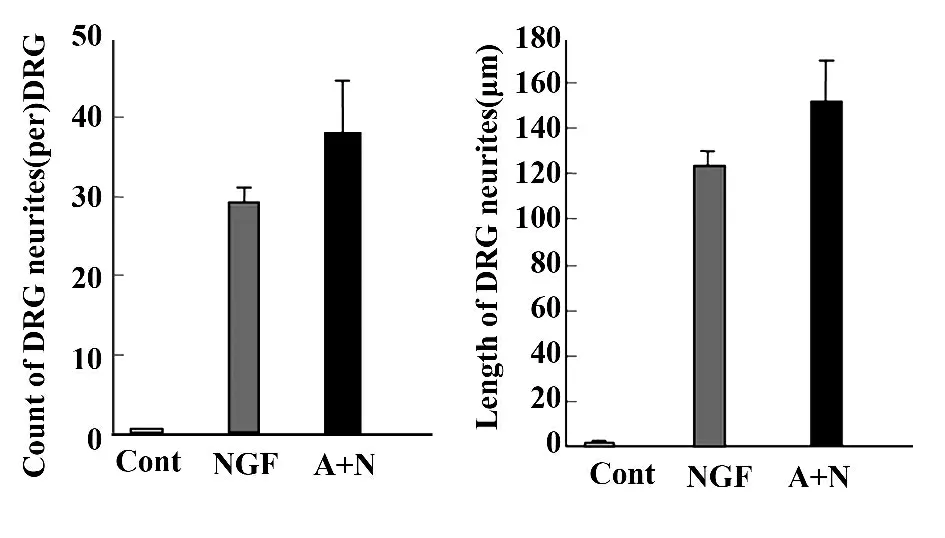
图2 每个神经节突起数量、长度的比较Fig.2 Neurite count and neurite length of cultured DRG of chicken embryos were statistically analyzed
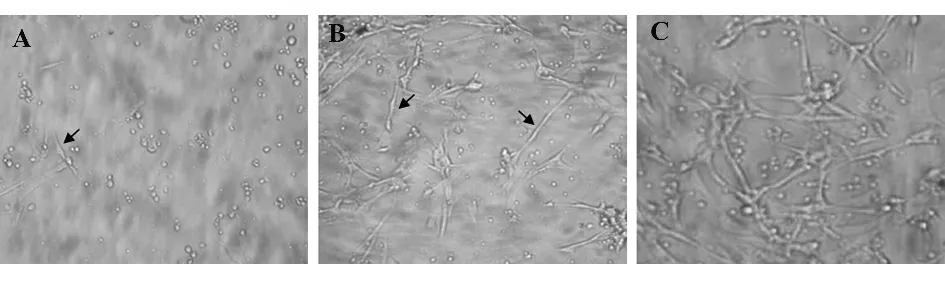
图3 激活素A 与NGF 联合维持神经元生长(×100)Fig.3 Survival of embryonic DRG neurons cultured with activin A and NGF(×100)
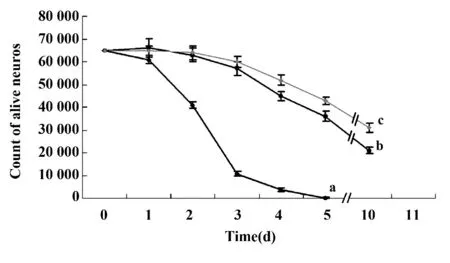
图4 DRG 神经元生存时程活力曲线Fig.4 Time course of cell viability assay of cultured DRG neurons
2.3 Activin A 与NGF 联合促进CGRP 表达 在探讨ActivinA与NGF联合作用时,我们通过计算各样本表达强度,发现Activin A 与NGF 联合诱导组比单纯NGF 组更加显著促进CGRP mRNA 的表达(图5)。这些数据表明提示Activin A 与NGF 共同作用可能通过调控CGRP 表达,促进DRG 神经元神经突起生长和维持DRG 神经元存活。
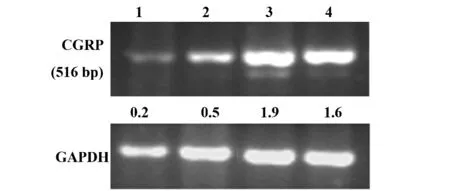
图5 CGRP mRNA 表达Fig.5 CGRP mRNA expression
3 讨论
我们前期研究发现Activin A 在体外可以促进鸡胚DRG 神经突起的生长和长时间维持DRG 神经元存活[9,12]。但是,Activin A 是否能与NGF 共同促进DRG 神经元生长仍不清楚。为了分析Activin A对NGF 促进DRG 神经元神经突起生长的影响作用,本研究采用8 天的鸡胚分离背根神经节,原代培养法,观察鸡胚背根神经节神经元神经突起的体外生长情况。我们发现Activin A 与NGF 联合作用比单一NGF 作用更加明显刺激神经节突起的生长,进一步采用原代培养法,发现Activin A 与NGF 联合培养的DRG 神经元存活也比单纯NGF 组多。这些结果提示Activin A 与NGF 联合作用比单纯NGF 作用在维持神经元功能上更有利。
许多研究证实CGRP 具有神经保护功能[13],并有助于轴突再生[14,15]。我们已经知道外源性NGF也可以增加感觉神经元CGRP 的表达[16-18],Activin A 能够增加NGF 在感觉神经元上CGRP 的表达[19]。在探讨Activin A 与NGF 的共同作用时,我们发现Activin A 与NGF 联合诱导组比单纯NGF 组更加显著促进了DRG 的CGRP 表达。上述资料提示,Activin A 与NGF 可能共同上调CGRP 表达,进而促进DRG 神经突起生长、维持DRG 神经元存活。因此,二者的联合应用可能为治疗神经元损伤及变性疾病的应用提供了新的数据和实验依据。
[1]Liu ZH,Tsuchida K,Matsuzaki T,et al.Characterization of isoforms of activin receptor-interacting protein 2 that augment activin signaling[J].Endocrinol,2006,189(2):409-421.
[2]Kingsley DM.The TGF-beta superfamily:new members,new receptors,and new genetic tests of function in different organisms[J].Genes Dev,1994,8(2):133-146.
[3]Schubert D,Kimura H,LaCorbiere M,et al.Activin is a nerve cell survival molecule[J].Nature,1990,344(6269):868-870.
[4]Iwahori Y,Saito H,Torii K,et al.Activin exerts a neurotrophic effect on cultured hippocampal neurons[J].Brain Res,1997,760(1-2):52-58.
[5]Wu DD,Lai M,Hughes PE,et al.Expression of the activin axis and neuronal rescue effects of recombinant activin A following hypoxic-ischemic brain injury in the infant rat[J].Brain Res,1999,835(2):369-378.
[6]Kashiba H,Hyon B,Senba E.Glial cell line-derived neurotrophic factor and nerve growth factor receptor mRNAs are expressed in distinct subgroups of dorsal root ganglion neurons and are differentially regulated by peripheral axotomy in the rat [J].Neurosci Lett,1998,252(2):107-110.
[7]Ma Q,Fode C,Guillemot F.Neurogenin1 and neurogenin2 control two distinct waves of neurogenesis in developing dorsal root ganglia[J].Genes Dev,1999,13(13):1717-1728.
[8]Rifkin JT,Todd VJ,Anderson LW.Dynamic expression of neurotrophin receptors during sensory neuron genesis and differentiation[J].Dev Biol,2000,227(2):465-480.
[9]方 琳,柳忠辉,刘永茂,等.激活素促进鸡胚神经节神经突起生长作用[J].动物学杂志,2006,41(6):23-28.
[10]方 琳,刘永茂,葛敬岩,等.激活素结合蛋白阻断激活素诱导鸡胚神经节神经突起生长作用及其机制研究[J].中风与神经疾病杂志,2007,24(4):395-397.
[11]Hou S,Tian W,Xu Q,et al.The enhancement of cell adherence and inducement of neurite outgrowth of dorsal root ganglia co-cultured with hyaluronic acid hydrogels modified with Nogo-66 receptor antagonist in vitro [J].Neuroscience,2006,137(2):519-529.
[12]Fang L,Wang YN,Cui XL,et al.The role and mechanism of activin A in neurite outgrowth of embryonic dorsal root ganglia of chicken[J].J Cell Sci,2012,125(6):1500-1507.
[13]Wang FZ.Protective effect of calcitonin gene-related peptide on synaptic function in hippocampal slice during hypoxia[J].Sheng Li Xue Bao,1994,46(6):529-538.
[14]Li XQ,Verge VM,Johnston JM,et al.CGRP peptide and regenerating sensory axons[J].Neuropathol Exp Neurol,2004,63(10):1092-1103.
[15]Piehl F,Hammarberg H,Tabar G,et al.Changes in the mRNA expression pattern,with special reference to calcitonin gene-related peptide,after axonal injuries in rat motoneurons depends on age and type of injury [J].Exp Brain Res,1998,119(2):191-204.
[16]Lindsay RM,Harmar AJ.Nerve growth factor regulates expression of neuropeptide genes in adult sensory neurons[J].Nature,1989,337(6205):362-364.
[17]Amann R,Sirinathsinghji DJ,Donnerer J,et al.Stimulation by nerve growth factor of neuropeptide synthesis in the adult rat in vivo:bilateral response to unilateral intraplantar injections[J].Neurosci Lett,1996,203(3):171-174.
[18]Winston J,Toma H,Shenoy M,et al.Nerve growth factor regulates VR-1 mRNA levels in cultures of adult dorsal root ganglion neurons[J].Pain,2001,89(2-3):181-186.
[19]Xu P,Hall AK.Activin acts with nerve growth factor to regulate calcitonin gene-related peptide mRNA in sensory neurons[J].Neuroscience,2007,150(3):665-674.