当归四逆汤含药血清对高糖培养SD大鼠背根神经元线粒体分裂及RhoA/ROCK通路的影响
向庆伟, 刘进进, 彭 朗, 刘 煜
(湖北省中医院/湖北省中医药研究院/湖北中医药大学附属医院,湖北 武汉,430061)
糖尿病周围神经病变(DPN)常可引发糖尿病患者神经性溃疡、肢端疼痛,严重时可导致截肢[1-2]。高糖可诱导炎症的发生,造成脊髓背根神经节细胞凋亡,是DPN发生的主要病理机制[3-4]。线粒体功能障碍与认知障碍、DPN等多种神经疾病密切相关,抑制线粒体分裂,可缓解糖尿病大鼠坐骨神经轴突损伤[5-6]。Ras同源基因家族成员A(RhoA)/Rho相关卷曲螺旋形成蛋白激酶(ROCK)调控炎症及线粒体分裂过程,下调通路蛋白表达,可抑制炎症,减弱线粒体断裂,促使神经细胞存活,改善顺铂诱导的周围神经病变[7-8], 因而RhoA/ROCK可作为减轻背根神经元线粒体分裂的潜在作用靶点。当归四逆汤能降低促炎因子表达,抑制炎症[9-10], 联合甲钴胺应用,可减轻糖尿病引发的神经功能受损,对DPN具有明显疗效,但其药理机制如今尚不清楚。本研究通过体外高糖培养斯泼累格·多雷(SD)大鼠背根神经元,探讨当归四逆汤含药血清对线粒体分裂及RhoA/ROCK通路的影响。
1 材料与方法
1.1 动物、试剂与仪器
SD大鼠购自武汉云克隆动物有限公司 [生产许可证号SCXK(鄂)2018-0021], 当归四逆汤(当归9 g、桂枝9 g、芍药9 g、细辛3 g、甘草6 g、通草6 g、大枣5枚)购自北京同仁堂,葡萄糖、杜氏改良Eagle培养基(DMEM)、Neurobasal培养基、B27细胞培养添加剂购自Gibco公司(货号15023021、C11995500BT、21103049、17504-044), 胰蛋白酶、100×青霉素-链霉素溶液、特级胎牛血清、100×L-谷氨酰胺溶液购自上海生工生物工程股份有限公司(货号A600626-0005、E607011、E600001-0500、E607004100X), 线粒体膜电位检测试剂盒(JC-1法)购自北京雷根生物技术有限公司(货号CT0045), CCK-8细胞活力检测试剂盒、活性氧(ROS)测定试剂盒、乳酸脱氢酶(LDH)试剂盒、白细胞介素-6(IL-6)测试盒、白细胞介素-18(IL-18)测试盒、RIPA裂解液(高强度)、总蛋白定量测定试剂盒(BCA法)购自南京建成生物工程研究所(货号G021-1-1、E004-1-1、A020-2-2、H007、H015、W062-1-1、A045-4-2); 兔源β-actin抗体、兔源ROCK抗体、兔源RhoA抗体、兔源动力相关蛋白1(Drp1)抗体、兔源分裂蛋白1(Fis1)抗体、兔源丝裂原融合蛋白1(MFN1)抗体、兔源丝裂原融合蛋白2(MFN2)抗体购自Abcam公司(货号ab227387、ab45171、ab187027、ab184247、ab229969、ab221661、ab124773等)。酶标仪购自美国Thermo Fisher Science公司(型号MultiskanTMFC), 发光成像仪购自德国Healthcare公司(型号LAS 4000), 全能蛋白转印系统购自美国Bio-Rad公司(型号Trans-Blot Turbo等)。
1.2 方法
1.2.1 含药血清制备及大鼠背根神经元体外培养: 当归四逆汤煎制后过滤,获得生药含量2.2 g/mL的药液,取6只大鼠以12 mL/kg的剂量灌胃给药[11], 另取6只大鼠灌胃等剂量生理盐水(模型组)[12]。7 d后取大鼠颈动脉血, 4 000转/min离心10 min, 分离得到含药血清和正常血清, 56 ℃水浴灭活0.5 h, 0.22 μm过滤灭菌后,分装保存于-80 ℃环境中。取正常SD大鼠1只,麻醉后处死,剥离脊髓,取出两侧背根神经节,剪碎后以胰酶消化20 min, 吹打后200目过筛,得到单细胞悬液, 12 000转/min离心5 min, 以培养液(DMEM培养基+10%胎牛血清+1%青霉素-链霉素溶液)重悬细胞沉淀后计数,密度调为1×106个/mL, 接种培养6 h, 更换为神经元专用培养基(Neurobasal培养基+1%谷氨酰胺+2% B27细胞培养添加剂+1%青霉素-链霉素溶液),每3 d半量换新的神经元专用培养基,细胞长至80%后,传代培养。
1.2.2 细胞分组处理及材料收集: 取传代培养的背根神经元,将其随机分为对照组、高糖组、当归四逆汤组,高糖组与当归四逆汤组细胞以45 mmol/L的高糖处理24 h, 然后当归四逆汤组细胞以10%的含药血清处理[12], 对照组与高糖组血清正常处理, 24 h后收集各组细胞和培养液。
1.2.3 检测各组细胞活力: 取传代培养的背根神经元,以1×105个/mL的密度接种在96孔板,按照1.2.2中方法分组处理细胞,每组设6个复孔,另取6个孔(不接种细胞)作空白组,加入CCK-8处理,采用酶标仪测量450 nm波长下各孔吸光度(A), 计算细胞活力,细胞活力=[(模型组和当归四逆汤组A-空白组A)/(对照组A-空白组A)]×100%。
1.2.4 测定各组细胞ROS水平及其释放的LDH、IL-6、IL-18水平: 取出分组处理后收集的背根神经元细胞,冰水浴下经RIPA裂解液裂解,离心收集上清液,取0.15 mL, 采用试剂盒测出各组细胞ROS水平,剩余细胞蛋白样品液进行蛋白检测。取出分组处理后收集的背根神经元细胞的培养液,离心后以试剂盒测出上清液中LDH、IL-6、IL-18的水平。
1.2.5 测定各组细胞线粒体膜电位: 取传代培养的背根神经元,接种在12孔板,按照1.2.2中方法分组处理细胞,使用线粒体膜电位检测试剂盒检测各组细胞线粒体膜电位,具体操作参照说明书进行,以酶标仪测定的红色荧光/绿色荧光的比值表示线粒体膜电位水平。
1.2.6 检测各组细胞线粒体分裂蛋白、融合蛋白及RhoA/ROCK通路蛋白表达水平: 取出测定ROS水平后剩余的各组细胞蛋白样品液,总蛋白浓度经BCA法测量后,将其煮沸变性,每组分别取含20 μg总蛋白的样品液加入上样孔中,电泳后湿转(110 V, 1.5 h), 以3%牛血清白蛋白溶液封闭硝酸纤维膜上蛋白,剪取蛋白Drp1、Fis1、MFN1、MFN2、RhoA、ROCK、β-actin条带,经对应一抗孵育后洗膜,经二抗孵育后洗膜,通过化学发光剂显色,以发光成像仪拍照,条带灰度值以Image J软件定量分析,最终得出各蛋白相对表达。
1.3 统计学分析
实验所得计量数据以平均数±标准差表示,并采用SPSS 24.0软件进行统计分析,多组间比较采用单因素方差分析,两两之间进一步比较行LSD-t检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 当归四逆汤含药血清对高糖培养大鼠背根神经元细胞活力的影响
与对照组(100.00%)比较,高糖组[(42.75±7.46)%]大鼠背根神经元细胞活力降低,差异有统计学意义(P<0.05); 与高糖组比较,当归四逆汤组[(86.83±12.05)%]背根神经元细胞活力升高,差异有统计学意义(P<0.05)。
2.2 当归四逆汤含药血清对高糖培养大鼠背根神经元ROS水平及释放LDH水平的影响
与对照组比较,高糖组背根神经元ROS水平及其释放的LDH水平升高,差异有统计学意义(P<0.05); 与高糖组比较,当归四逆汤组背根神经元ROS水平及其释放的LDH水平降低,差异有统计学意义(P<0.05),见表1。
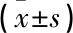
表1 各组大鼠背根神经元ROS水平及释放的LDH水平比较
2.3 当归四逆汤含药血清对高糖培养大鼠背根神经元释放IL-6、IL-18水平的影响
与对照组比较,高糖组背根神经元释放的IL-6、IL-18水平升高,差异有统计学意义(P<0.05); 与高糖组比较,当归四逆汤组背根神经元释放的IL-6、IL-18水平降低,差异有统计学意义(P<0.05)。见表2。
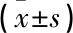
表2 各组大鼠背根神经元释放IL-6、IL-18水平
2.4 当归四逆汤含药血清对高糖培养大鼠背根神经元线粒体膜电位的影响
对照组大鼠背根神经元线粒体膜电位为(3.23±0.51), 高糖组为(2.14±0.37), 当归四逆汤组为(3.25±0.34)。与对照组比较,高糖组大鼠背根神经元线粒体膜电位降低,差异有统计学意义(P<0.05); 与高糖组比较,当归四逆汤组大鼠背根神经元线粒体膜电位升高,差异有统计学意义(P<0.05)。
2.5 当归四逆汤含药血清对高糖培养大鼠背根神经元线粒体分裂蛋白及融合蛋白表达的影响
与对照组比较,高糖组大鼠背根神经元线粒体分裂蛋白Drp1、Fis1表达升高,融合蛋白MFN1、MFN2表达降低,差异有统计学意义(P<0.05); 与高糖组比较,当归四逆汤组大鼠背根神经元线粒体分裂蛋白Drp1、Fis1表达水平降低,融合蛋白MFN1、MFN2表达水平升高,差异有统计学意义(P<0.05),见图1、表3。
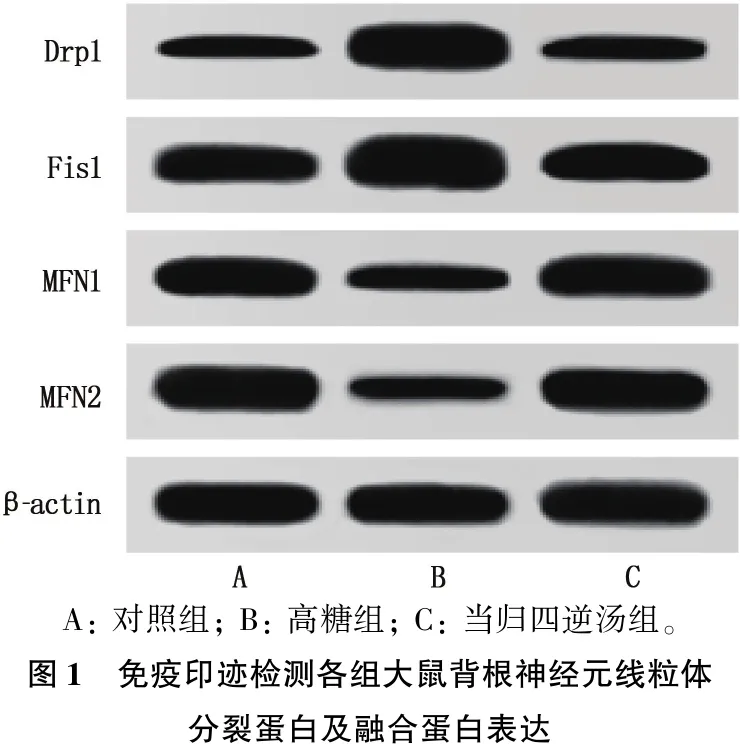
A: 对照组; B: 高糖组; C: 当归四逆汤组。图1 免疫印迹检测各组大鼠背根神经元线粒体分裂蛋白及融合蛋白表达
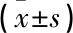
表3 各组大鼠背根神经元线粒体分裂蛋白及融合蛋白相对表达水平
2.6 当归四逆汤含药血清对高糖培养大鼠背根神经元RhoA/ROCK通路蛋白表达的影响
与对照组比较,高糖组背根神经元RhoA/ROCK通路蛋白RhoA、ROCK表达升高,差异有统计学意义(P<0.05); 与高糖组比较,当归四逆汤组背根神经元RhoA/ROCK通路蛋白RhoA、ROCK表达降低,差异有统计学意义(P<0.05),见图2、表4。

A: 对照组; B: 高糖组; C: 当归四逆汤组。图2 免疫印迹检测各组大鼠背根神经元RhoA/ROCK通路蛋白表达
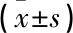
表4 各组大鼠背根神经元RhoA/ROCK通路蛋白相对表达
3 讨 论
线粒体动力学损伤及功能障碍与DPN的发病密切相关,高糖环境可增强背根神经元产生并积累ROS, 促使线粒体分裂蛋白Drp1、Fis1的表达,抑制线粒体融合蛋白MFN的表达,破坏线粒体分裂与融合的动力学平衡,引起线粒体分裂过强,导致神经元损伤,进而造成视觉功能障碍、DPN等神经疾病[13-15]。本研究以高糖培养SD大鼠背根神经元,模拟DPN的致病过程,结果显示,高糖培养能显著升高大鼠背根神经元ROS水平,促进大鼠背根神经元释放LDH、IL-6及IL-18, 促进Drp1及Fis1蛋白的表达,显著降低细胞活力、线粒体膜电位、细胞MFN1及MFN2蛋白表达,表明高糖可诱导ROS及促炎因子大量产生释放,促使线粒体分裂,引发线粒体功能损伤,导致神经元活力降低,基本符合DPN在细胞水平上的致病过程。
DPN的治疗以控制血糖、补充神经营养为主,疗效并不理想,且随着社会发展,居民摄入营养过剩, DPN发病率越来越高,因此有效预防其发生和发展是迫切需要解决的临床难点[1-2, 16]。中医学将DPN归属于“血痹”“痿证”等范畴,脉络瘀滞痹阻、气血亏虚不畅是其主要病机。当归四逆汤是《伤寒论》中的温经散寒代表方剂,可补血散瘀、温经通脉、振阳祛寒,广泛应用于坐骨神经痛、DPN、类风湿性关节炎等疾病的临床治疗。现代药理研究[9-10, 17-18]表明,当归四逆汤可降低促炎因子水平,抑制炎症反应,显著改善DPN患者的临床症状,但目前还没有关于其药理机制的准确阐述。研究[7-8, 19]发现,小G蛋白RhoA及其下游激酶ROCK在DPN的发病过程中发挥着重要调控作用,高糖可促进RhoA、ROCK表达,引发炎症,进而上调Drpl的表达,增强线粒体分裂,导致背根神经元损伤凋亡,抑制RhoA/ROCK通路激活,减轻炎症,下调Drp1表达,缓解线粒体断裂,阻断线粒体凋亡途径,维持神经细胞正常生长及代谢,缓解神经病变症状,因而推测下调RhoA/ROCK通路可能是当归四逆汤治疗DPN的作用机制。本研究结果显示,当归四逆汤含药血清处理高糖培养的大鼠背根神经元,可显著降低背根神经元的ROS水平,增高LDH、IL-6及IL-18水平和细胞中Drp1、Fis1、RhoA及ROCK蛋白表达,显著提升细胞活力、线粒体膜电位,增高细胞中MFN1及MFN2蛋白的表达,表明当归四逆汤可抑制RhoA/ROCK信号的激活,减少ROS和炎性因子产生释放,阻止炎症反应的发生,减轻线粒体分裂,促使背根神经元存活,改善高糖诱导的神经细胞损伤。
综上所述,当归四逆汤可下调RhoA及ROCK蛋白的表达,抑制ROS和炎性因子合成释放,阻止炎症发生及进展,减弱线粒体分裂过程,提高高糖培养的背根神经元活力,减轻细胞损伤,在细胞水平上证实了对DPN的防治功效,值得临床推广使用。抑制RhoA/ROCK通路激活可能是当归四逆汤治疗DPN的药理机制,后续会进行回复实验对其进行深入探讨。

