集落刺激因子-1自背根节向脊髓转运在长春新碱诱导神经病理性疼痛中的作用
付宝军,姜静静,李恒
(广州医科大学附属第六医院·清远市人民医院麻醉科,广东 清远 511518)
长春新碱是一种常用化疗药物,在治疗恶性肿瘤的同时常常可诱发化疗所致神经病理性疼痛(chemotherapy-induced neuropathic pain,CINP),CINP会影响患者的生活质量,不能耐受疼痛的患者会被迫降低化疗药物的剂量,甚至完全停止治疗。目前,对于化疗引起的神经性疼痛的治疗策略仅限于使用三环抗抑郁药、抗惊厥药和阿片类药物治疗,但这些药物往往因为各种不良反应而限制了临床应用[1]。因此,发现新的CINP发生机制,对于开发新的治疗策略至关重要。随着对慢性痛机制研究的不断深入,细胞因子尤其是集落刺激因子-1(colony stimulating factor-1,CSF-1)在神经病理性疼痛中的作用越来越受到关注。近期研究证实[2-4]:在脊神经结扎、背部疼痛、关节炎疼痛模型中,CSF-1对慢性痛的疼痛信息调制过程发挥重要作用,但是其在CINP过程中的作用及机制尚未见报道。本研究采用长春新碱诱导神经病理性疼痛大鼠模型,探讨CSF-1在长春新碱诱导神经病理性疼痛中的作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 试剂和药品 注射用硫酸长春新碱(浙江海正药业股份有限公司),兔抗大鼠CSF-1单克隆抗体和兔抗大鼠离子钙结合适配器分子1(ionized calcium binding adapter molecule1,Iba1)单克隆抗体(Abcam公司,美国),聚合酶链式反应(polymerase chain reaction,PCR)试剂盒(武汉博士德生物科技有限公司,武汉),von Frey细丝(Stoelting公司,美国),Trizol RNA抽提试剂、BeyoR TTM cDNA逆转录试剂盒和焦碳酸二乙酯(diethyl dicarbonate,DEPC)(上海碧云天生物技术有限公司南通分公司,南通),PCR引物(北京天根生化科技有限公司合成,北京)。热痛刺激仪(Stoelting公司,美国)。
1.1.2 实验动物 健康雄性SD大鼠(200~230 g)由清远市人民医院实验动物中心提供[动物生产许可SYXK(粤)2019-0206]。所有实验操作程序均经清远市人民医院实验动物福利与应用委员会批准,遵守国际卫生学会《实验动物福利和应用指南》[5]。
1.2 方法
整个实验过程中动物自由摄食和饮水,室温(22±1)℃,光照周期12 h(7∶00~19∶00光照;19∶00~7∶00黑暗)。SD大鼠30只,按随机数表法分为3组:正常对照组、CINP组和背根切断(dorsal root rhizotomy,DRR)组,每组10只。CINP组:建立CINP模型,方法为隔日腹腔注射长春新碱,125 μg/kg,共计4次,第1次注射当天视为第1天。DRR组:切断腰4~6背根后,建立CINP模型。
1.3 检测指标
1.3.1 机械缩足反射阈值 用von Frey纤维丝以up-down法推算50%缩足阈值[6]:将一个有机玻璃箱(22 cm×12 cm×22 cm)置于金属筛网上,大鼠在其中适应15 min后,用von Frey纤维丝垂直刺激大鼠后肢足底中部,持续时间≤3 s,大鼠出现抬足或舔足行为视为阳性反应,否则为阴性反应。测定首先从0.008 g开始,当该力度的刺激不能引起阳性反应时,给予相邻大1级力度的刺激;如出现阳性反应则给予相邻小1级力度的刺激,如此连续进行,直至出现第1次阳性和阴性反应的骑跨,再连续测定4次。最大力度为15 g,大于此值时记为15 g,每次刺激间隔为30 s。在给药前、给药后第1、3、5、7天采用机械缩足反射阈值(mechanical withdrawal threshold,MWT)评价大鼠机械痛敏。
1.3.2 热缩足反射潜伏期 将有机玻璃箱置于3 mm厚的玻璃板上,采用热痛刺激仪照射大鼠足底[7]。照射开始至大鼠出现抬腿回避的时间为热缩足反射潜伏期(thermal withdrawal latency,TWL)。自动切断时间为20 s,以防止组织损伤。热刺激强度在整个实验过程中维持一致。每只动物测定5次,每次间隔3 min,取后3次平均值为大鼠TWL。在给药前、给药后第1、3、5、7天采用TWL评价大鼠热痛敏。
1.3.3 脊髓和背根节CSF-1蛋白 给药后第7天,各组取3只大鼠腹腔注射1%戊巴比妥钠40 mg/kg麻醉大鼠,断头处死,冰上取出脊髓腰膨大及背根节部位,加入裂解液进行匀浆,4℃下12 000转/min离心5 min,二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白定量。配置12%的分离胶和5%的浓缩胶,浓缩胶电泳条件为80 V恒压,分离胶电泳条件为100 V恒压,当溴酚蓝染料前端至分离胶末端时即停止电泳,转膜后5%脱脂奶粉封闭2 h,加入β-actin(兔抗小鼠,1∶2 000)和CSF-1(兔抗小鼠,1∶1 000),4℃孵育过夜后用含有吐温20的Tris缓冲盐水(tris buffered saline containing Tween 20,TBST)洗膜3次,10 min/次。加入辣根过氧化物酶(horseradish pero-xidase,HRP)标记的山羊抗兔IgG(1∶3 000)室温孵育2 h后TBST洗膜4次,10 min/次。电化学发光(electrochemiluminescence,ECL)显色、曝光和显影,采用Image J软件检测目的蛋白条带及β-actin蛋白条带的光密度值,目标蛋白表达量=目标蛋白条带光密度/β-actin蛋白条带光密度。
1.3.4 免疫荧光化学检测Iba1蛋白 给药后第7天,各组取3只大鼠腹腔注射1%戊巴比妥钠40 mg/kg麻醉后,用4%多聚甲醛灌注固定,取大鼠腰4~6背根节,4%多聚甲醛后固定2 h,再先后于20%、30%蔗糖溶液中脱水,冰冻切片机切片,厚度14 μm。免疫荧光染色:磷酸盐缓冲盐水(phosphate buffered saline,PBS)(0.01 mol/L,pH值7.4)洗片3次,20 min/次;加5%羊血清室温封闭2 h;加一抗(Iba1,1∶200),4℃过夜孵育;次日复温至室温后PBS洗3次,15 min/次;分别加入Cy3标记的荧光二抗(1∶1 000),室温孵育2 h,PSB洗3次,20 min/次,晾干,封片剂封片;置荧光显微镜下拍照观察。
1.3.5 脊髓和背根节CSF-1 mRNA 逆转录PCR测定给药后第7天,每组各取3只大鼠安乐死后进行检查。提取大鼠L4~6脊髓及背根节总RNA,反转录为cDNA。用ΔΔCT法测定CSF-1 mRNA含量。CSF-1上游引物:5′-TGCTAAGTGCTCTAGCCGAG-3′;下游引物:5′-CCCCCAACAGTCAGCAAGAC-3′。β-actin上游引物:5′-CGTTGACATCCGTAAAGACCTC-3′;下游引物:5′-TAGGAGCCAGGGCAGTAATCT-3′。扩增条件:94℃预变性5 min,94℃ 30 s,54℃ 30 s,72℃ 20 s,共45个循环,72℃延伸10 min。计算CSF-1与β-actin的比值为目的基因的相对表达量。
1.4 统计学处理
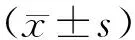
2 结 果
2.1 各组大鼠MWT和TWL变化情况
与对照组相比,腹腔注射长春新碱3、5、7 d后,CINP组大鼠的MWT[3 d:(11.6±0.5)g;5 d:(9.3±0.8)g;7 d:(7.9±0.5)g]和TWL[3 d:(17.3±0.7)s;5 d:(15.5±0.6)s;7 d:(13.3±1.2)s]均显著降低(P<0.05);与CINP组比较,DRR组大鼠在给药3、5、7 d后的MWT[3 d:(13.2±0.9)g;5 d:(11.9±0.6)g;7 d:(12.7±1.2)g]和TWL[3 d:(18.3±0.8)s;5 d:(18.0±0.7)s;7 d:(17.8±1.0)s]均显著升高(P<0.01;图1)。
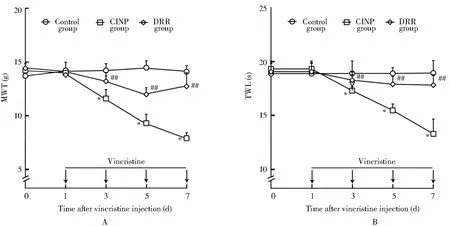
图1 各组大鼠MWT和TWL比较Figure 1 Comparison of MWT(A) and TWL(B) in each group (n=10)CINP: chemotherapy-induced neuropathic pain; DRR: dorsal root rhizotomy; MWT: mechanical withdrawal threshold; TWL: thermal withdrawal latency. Compared with control group, *P<0.05; compared with CINP group, ##P<0.01.
2.2 各组大鼠脊髓和背根节CSF-1蛋白表达情况比较
与对照组相比,CINP组大鼠背根节[(0.21±0.04)和(1.08±0.15)]和脊髓CSF-1蛋白[(0.22±0.05)和(1.17±0.14)]表达显著升高(P<0.01);与CINP组相比,DRR组大鼠背根节CSF-1蛋白表达差异无统计学意义,而脊髓CSF-1蛋白[(1.17±0.14)和(0.45±0.06)]表达显著降低(P<0.01;图2)。
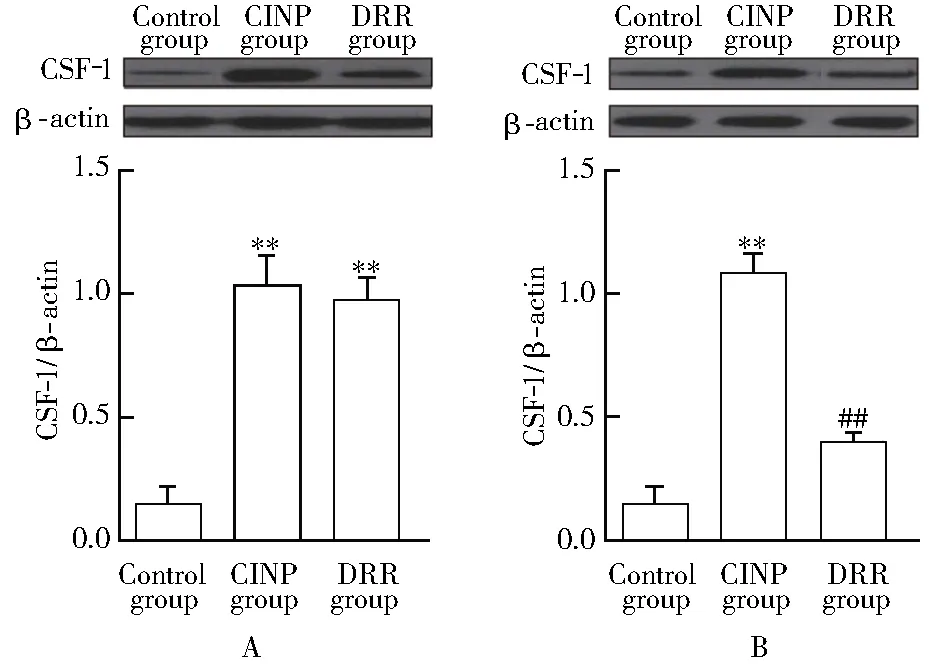
图2 各组大鼠背根节和脊髓CSF-1蛋白表达情况比较Figure 2 Comparison of CSF-1 proteins in dorsal root ganglia(A)and spinal cord(B) between each group (n=3)CINP: chemotherapy-induced neuropathic pain; CSF-1:colony stimulating factor-1; DRR: dorsal root rhizotomy. Compared with control group,**P<0.01; compared with CINP group, ##P<0.01.
2.3 各组大鼠脊髓Iba1蛋白表达情况比较
与对照组相比,CINP组大鼠脊髓Iba1蛋白表达[(100±0)% 和(250±19)%]显著升高(P<0.01),与CINP组相比,DRR组大鼠脊髓Iba1蛋白表达[(250±19)% 和(130±16)%]显著降低(P<0.05;图3)。

图3 各组大鼠脊髓Iba1表达情况比较Figure 3 Comparison of Iba1 in spinal cord in each group (n=3)A: immunofluorescence staining(×50); B: quantitative analysis. CINP: chemotherapy-induced neuropathic pain;CSF-1: colony stimulating factor-1; Iba1: ionized calcium binding adapter molecule 1; DRR: dorsal root rhizotomy.Compared with control group, **P<0.01; compared with CINP group, #P<0.05.
2.4 各组大鼠背根节和脊髓CSF-1 mRNA表达情况比较
与对照组相比,CINP组背根节CSF-1 mRNA表达[(0.20±0.05)和(1.02±0.10)]显著升高(P<0.01);与CINP组相比,DRR组背根节CSF-1 mRNA表达差异无统计学意义(P>0.05)。3组大鼠脊髓CSF-1 mRNA表达差异无统计学意义(P>0.05;图4)。
图4 各组大鼠背根节和脊髓CSF-1 mRNA表达情况比较Figure 4 Comparison of CSF-1 mRNA in dorsal root ganglia)(A)and spinal cord(B) in each group (n=3)CINP: chemotherapy-induced neuropathic pain; CSF-1: colony stimulating factor-1; DRR: dorsal root rhizotomy. Compared with control group,**P<0.01.
3 讨 论
CINP大鼠模型的可操作性强、重复性好,且与临床CINP特征有很多相似之处,已广泛应用于CINP的研究[8]。本研究结果表明,随着给药时间延长,大鼠MWT和TWL开始逐渐降低,表明CINP模型制备成功。
CINP的机制至今尚不完全清楚,因而缺乏有效的治疗方法。阐明CINP的发生机制,开发和寻找针对机制的新药及治疗手段具有重大意义。CSF-1是一种细胞因子,通过与Ⅲ型受体酪氨酸激酶偶联CSF-1受体结合来发挥作用,在调节单核细胞、巨噬细胞和小胶质细胞的存活、增殖和分化中发挥重要作用。研究表明[1],背根节初级感觉神经元中CSF-1的上调对脊神经结扎动物脊髓小胶质细胞激活以及促伤害性基因诱导起着重要作用。目前尚不清楚CSF-1是否在长春新碱致神经病理性疼痛中发挥作用。
本研究结果表明,CINP大鼠产生痛觉过敏的同时伴有背根节CSF-1蛋白、Csf-1mRNA表达明显上调,提示背根节CSF-1蛋白参与了CINP形成,这与Zhou等[9]报道结果一致。有趣的是,脊髓CSF-1蛋白上调,但是脊髓Csf-1 mRNA表达却与对照组差异无统计学意义,提示脊髓CSF-1蛋白上调可能是由于其他部位CSF-1蛋白向脊髓转运。为了验证该假设,我们将大鼠背根切断,结果发现,背根节CSF-1蛋白和mRNA表达明显上调,但脊髓CSF-1蛋白表达明显降低,因此提示在CINP发生的过程中,背根节原发产生的CSF-1蛋白经外周端向脊髓传递,增加CSF-1向脊髓传递痛觉信息。研究表明[2],周围神经损伤增加了初级感觉神经元产生和释放CSF-1,CSF-1向脊髓运输,从而调节背角小胶质细胞的增殖,促发外周神经损伤导致神经病理性疼痛。本研究结果表明,与CINP组比较,背根切断后脊髓小胶质细胞活化标志物Iba1的表达明显降低,进一步证实背根节原发产生的CSF-1蛋白经外周端向脊髓传递,引起脊髓背角小胶质细胞的活化增殖,从而诱发神经病理性疼痛,与上述研究结果一致。本研究结果显示,CSF-1蛋白源发于背根节,但Tang等[10]研究表明,CSF-1蛋白源发于脊髓背角,这种结果差异可能与研究中使用的动物模型不同、观测时间点不同、动物种属不同等因素有关。
总之,长春新碱诱导的神经病理性疼痛可能与CSF-1自背根节向脊髓转运活化小胶质细胞有关。

