禽2 型副黏病毒分离株Suiling/53 的致病性研究
檀群松,王靖飞
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150001)
禽副黏病毒(Avian paramyxovirus,APMV)为具有囊膜,不分节段的负义单链RNA 病毒[1]。根据血凝抑制(HI)和神经氨酸酶抑制(NI)试验,将其分为9个血清型(APMV-1~9)[2]。最近,从法国扇尾沙锥和从意大利赤颈鸭分离两株新型APMV,而且这两株病毒分别根据基因和抗原分析被认为是两个新的血清型并建议定为APMV-11 和APMV-12[3-4]。APMV-1也称为新城疫病毒(NDV),为副黏病毒属典型的代表病毒。APMV-2 可能引起火鸡和鸡产蛋量下降和轻微的疾病[5]。1994 年在以色列暴发鸡和火鸡呼吸道疾病的鸡群中分离到APMV-1 和APMV-2 两种不同血清型病毒,而推测APMVs 混合感染可能在家禽发病中有重要作用[6]。关于APMV-2 血清学监测结果表明APMV-2 在中国分布广泛[7]。APMV-2 从世界各地的各种家禽及野鸟类中均可以分离到,尤其是鸡和火鸡,此外,还包括鸥、企鹅、水鸟等[8-10]。在监测禽流感过程中,本实验室从黑龙江省绥棱市采集的野鸟样品中的暗胸朱雀中分离鉴定到一株APMV-2。到目前为止,在中国并未有从野鸟中分离到APMV-2 的报道,为评估这株APMV-2 的致病性因而对其进行致病指数测定,SPF 鸡和BALB/c小鼠感染试验,为APMV 致病性研究提供基础数据。
1 材料和方法
1.1 主要实验材料及主要试剂 病毒株Suiling/53由本实验室保存;1 %红细胞由本实验室制备;9~10 日龄SPF 鸡胚、1 日SPF 龄雏鸡及4 周龄SPF 鸡均由本研究所实验动物中心提供;4 周龄BALB/c 小鼠购自北京维通利华实验动物技术有限公司。
1.2 病毒的增殖 将病毒液进行适当倍比稀释接种鸡胚后,在37 ℃培养72 h 后,收集尿囊液并进行血凝试验(HA)测定其效价[2]以备后续使用。
1.3 鸡胚平均致死指数(MDT)的测定 将含有病毒的尿囊液(HA∶27)用生理盐水按10 倍倍比稀释至梯度10-6~10-12;将0.1 mL 各稀释梯度的尿囊液分别接种5 只9 日龄的SPF 鸡胚并于37 ℃培养;每天观察两次,连续观察7 d 并记录鸡胚死亡的时间及相应个数。鸡胚平均致死时间计算公式为:MDT=(各梯度死亡胚数×死亡时间的总和)/死亡总胚数。根据OIE 新城疫毒力判定标准:强毒毒力毒株的鸡胚平均致死时间小于60 h;中等毒力毒株的鸡胚平均致死时间介于60 h~90 h;而无毒力毒株的鸡胚平均致死时间大于90 h。
1.4 脑内致病指数(ICPI)的测定 将含有病毒的尿囊液(HA∶27)用无菌生理盐水进行10 倍倍比稀释。选取10 只日龄超过24 h 但小于40 h 的SPF 雏鸡每只脑内接种每个梯度0.05 mL,随后每24 h 观察一次并对每只雏鸡记录打分,连续观察记录8 d,若雏鸡正常则记为0;若雏鸡发病则记为1;若雏鸡死亡则记为2。ICPI 是每只雏鸡8 d 内所有观察次数的平均得分。根据OIE 新城疫判断标准方法,若得分为2.0 则为强毒毒株;若得分接近0 则为弱毒或无毒毒株[3]。
1.5 SPF 鸡感染性试验 将20 只4 周龄SPF 鸡随机分成两组,其中实验组为15 只,对照组为5 只。对实验组15 只鸡进行点眼滴鼻0.2 mL 病毒尿囊液(HA∶27),同时对照组5 只鸡进行点眼滴鼻接种同样体积的PBS。每天对接种后的鸡临床症状进行观察并记录结果,并分别在接种2 d、4 d、7 d、14 d 及28 d 后随机选取实验组中的3 只和对照组一只雏鸡进行采血并安乐死,采集咽喉拭子,肛拭子后剖杀并采集脑、肺、气管、心脏、肾脏和小肠等组织器官用于病毒分离检测及组织病理学检查。血清用于血凝抑制试验(HI)检测特异性抗体的水平变化。
1.6 BALB/c 小鼠感染性试验 将16 只小鼠随机分为实验组(12 只)和对照组(4 只)。对实验组每只小鼠滴鼻接种0.05 mL 含病毒尿囊液(HA∶27)和对照组鼻内接种同样体积的PBS。分别在接种2 d、4 d、7 d及14 d 后采集肺脏、脑、肾脏、脾脏和小肠等组织器官用于病毒分离检测。
1.7 组织和拭子中病毒分离检测 为从组织及拭子中分离病毒,将样品匀浆后上清液和拭子浸出液通过0.2 μm 的滤膜过滤除菌。各取0.2 mL 接种9 日龄SPF 鸡胚尿囊腔于37 ℃培养,72 h 后收集尿囊液并进行HA 试验,HA 试验按照OIE 标准步骤操作进行[2]。若HA 为阳性则认为从采集的相应组织或拭子中分离到病毒。
2 结果
2.1 致病指数测定结果 将病毒株Suiling/53 接种9 日龄SPF 鸡胚和1 日龄雏鸡,结果表明其MDT 和ICPI 分别为120 h 和0(表1)。致病指数测定结果表明病毒株Suiling/53 为弱毒或无毒力病毒株。
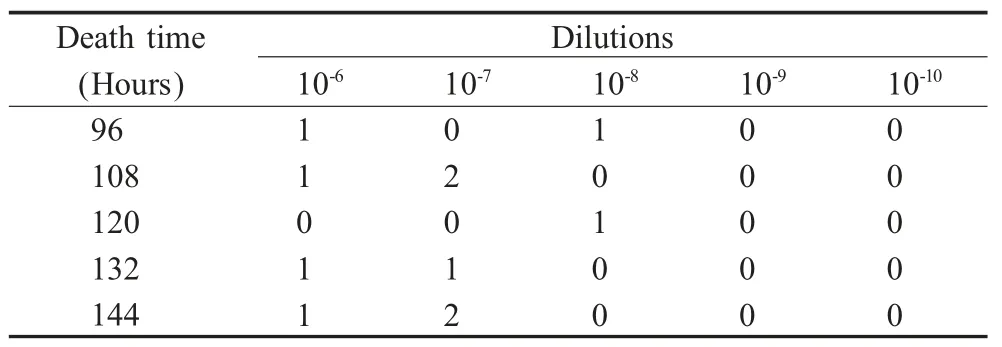
表1 SPF 鸡胚死亡时间Table 1 The death time of SPF eggs
2.2 SPF 鸡抗体水平变化 病毒株Suiling/53 接种4 周龄SPF 鸡后,感染7 d 后随机采集3 只SPF 鸡的血清的HI 效价为25或26而在感染14 d 时,随机采集3 只SPF 鸡的血清的HI 效价为27或28;在感染28 d 时,其中两只鸡的HI 效价为28而另一只是25(图1)。这表明病毒株Suiling/53 能够感染SPF 鸡并刺激其产生特异性抗体。
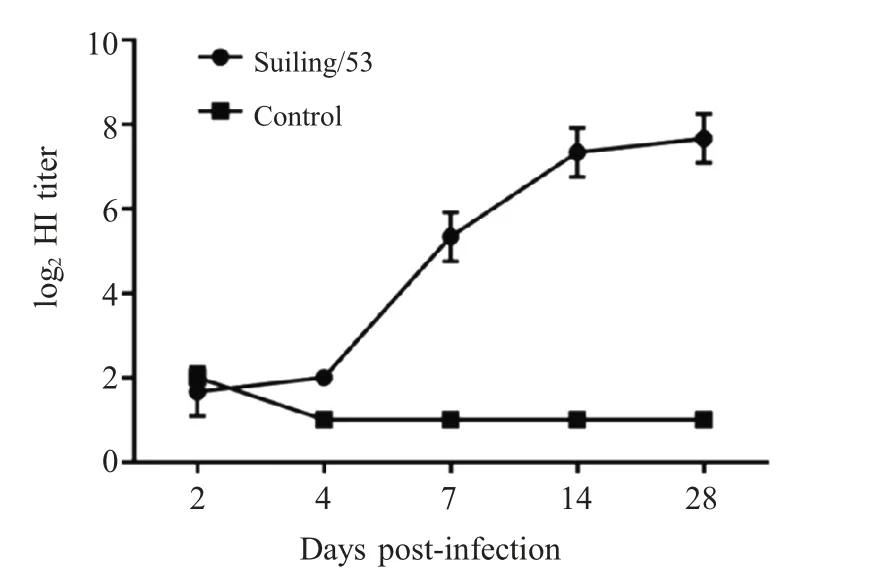
图1 SPF 鸡抗体水平Fig.1 The antibody levels of SPF chickens
2.3 SPF 鸡组织中病毒分离检测及其气管组织病理变化 病毒株Suiling/53 感染4 周龄SPF 鸡后,实验组及对照组均未观察到明显临床症状及死亡情况。从不同组织是否分离到病毒按照收集尿囊液HA 试验阳性结果进行判定。HA 试验结果表明分别从感染2 d 后的气管、小肠和脑,分别从感染4 d后采集的肺脏、心脏和气管中分离出病毒(表2)。这表明病毒株Suiling/53 感染SPF 鸡后主要存在于上呼吸道中。
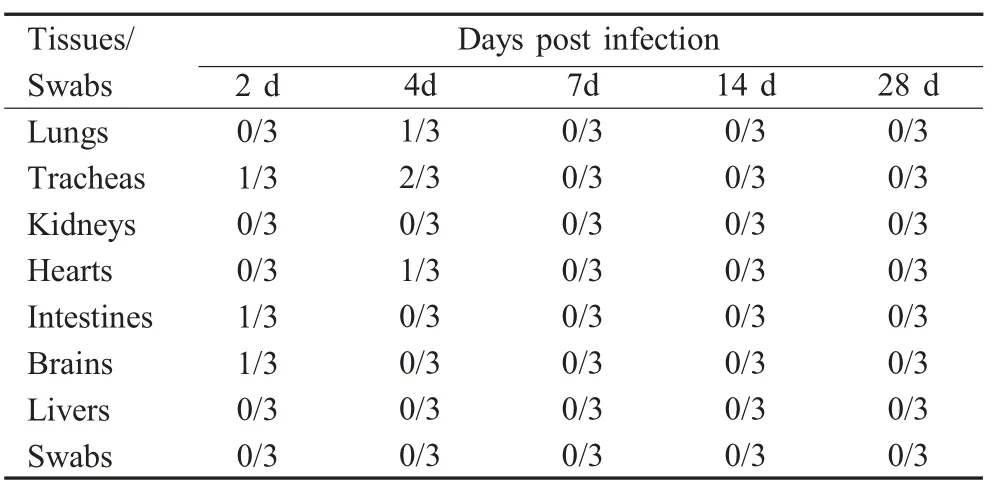
表2 感染Suiling/53 的SPF 鸡不同组织和拭子中病毒分离结果Table 2 The re-isolation of Suiling/53 from various tissues and swabs of artificially infected SPF chickens
取各SPF 鸡感染阶段采集的气管组织进行病理组织变化观察,在感染28 d 时采集气管显示有少量淋巴细胞存在于粘膜下层(图2)。这表明SPF 鸡及时对病毒株产生清除反应。
2.4 BALB/c 小鼠感染试验结果 病毒株Suiling/53感染BALB/c 小鼠后未观察到明显临床症状或死亡情况,并且从采集的组织中未分离出病毒,这表明病毒株Suiling/53 对小鼠无感染能力。
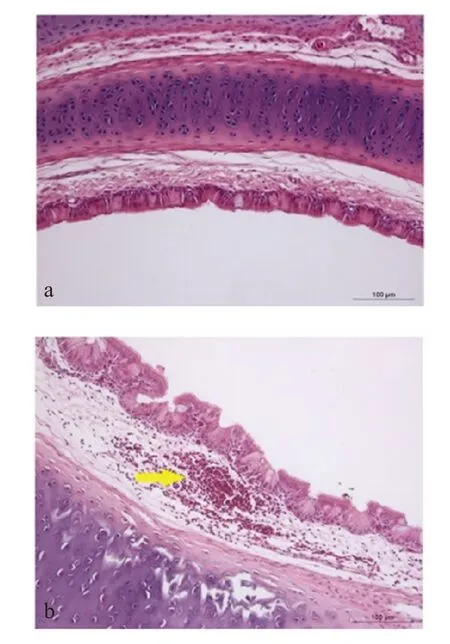
图2 气管组织的病理变化Fig.2 Histopathology of the tracheas
3 讨论
AMPVs 除了通常会造成轻微的疾病过程或隐性感染,也可能导致严重的神经系统和呼吸系统疾病[1]。本实验中,对分离病毒株Suiling/53 进行了两种致病性指数测定,分离病毒株Suiling/53 的MDT 和ICPI均表明病毒株Suiling/53 属于弱毒或无毒力的病毒株。根据血清中抗体水平检测结果,随机挑取的SPF 鸡分别在感染7 d、14 d 和28 d 时的HI 效价均高于27,这表明Suiling/53 具有良好的免疫原性,并能够刺激免疫鸡产生持续的高滴度抗体。对AMPV血清型2 型~9 型免疫鸡的NDV 攻毒保护实验表明,其中免疫APMV-2 的鸡的生存率为30 %[11],这表明APMV-2 对新城疫有一定的保护作用。此外,本实验中,病毒主要存在于呼吸道,并且主要在感染4 d 和7 d 后从呼吸道可分离出病毒,之后被机体及时清除而不能分离出病毒。而APMV-2(SCWDS ID AI02-1008)感染1 日龄雏鸡后,病毒可从被感染的鸡的气管、肺、肠和胰腺等组织中分离得到[12]。病毒株APMV-2/Yucaipa 可以在仓鼠和BALB/c 小鼠鼻甲和肺脏中可复制,但只有较低滴度[13-14]。病毒株Suiling/53 与病毒株Yucaipa 在BALB/c 小鼠感染试验中表现出不同的特性,可能是由于两者之间存在抗原性的不同而导致病毒株生物学特性的不同,这需要进一步的实验研究探索这两株病毒所存在的差异。
[1]Alexander D J.Newcastle disease and other avian paramyxoviruses[J].Rev Sci Tech,2000,19(2):443-462.
[2]OIE.Manual of diagnostic tests and vaccines for terrestrial animals[M].Office International des Epizooties,2012:555-573.
[3]Briand F X,Henry A,Massin P,et al.Complete genome sequence of a novel avian paramyxovirus[J].J Virol,2012,86(14):7710-7710.
[4]Terregino C,Aldous E,Heidari A,et al.Antigenic and genetic analyses of isolate APMV/wigeon/Italy/3920-1/2005 indicate that it represents a new avian paramyxovirus(APMV-12)[J].Arch Virol,2013,158(11):2233-2243.
[5]Bankowski R A,Almquist J,Dombrucki J.Effect of paramyxovirus Yucaipa on fertility,hatchability,and poultry yield of turkeys[J].Avian Dis,1981,25:517-520.
[6]Shihmanter E,Weisman Y,Manwell R,et al.Mixed paramyxovirus infection of wild and domestic birds in Israel[J].VetMicrobiol,1997,58(1):73-78.
[7]Zhang Guo-zhong,Zhao Ji-xun,Wang Ming.Serological survey on prevalence of antibodies to avian paramyxovirus serotype 2 in China[J].Avian Dis,2007,51(1):137-139.
[8]Maldonado A,Arenas A,Tarradas M C.Prevalence of antibodies to avian paramyxoviruses 1,2 and 3 in wild and domestic birds in southern Spain[J].Avian Pathol,1994,23:145-152.
[9]Maldonado A,Arenas A,Tarradas M C,et al.Serological survey for avian paramyxoviruses from wildfowl in aquatic habitats in Andalusia[J].J Wild Dis,1995,31(1):66-69.
[10]Goodman B B,Hanson R P.Isolation of avian paramyxovirus-2 from domestic and wild birds in Costa Rica[J].Avian Dis,1988,32(4):713-717.
[11]Nayak B,Dias F M,Kumar S,et al.Avian paramyxovirus serotypes 2-9 APMV-2-9 vary in the ability to induce protective immunity in chickens against challenge with virulent Newcastle disease virus APMV-1[J].Vaccine,2012,30(12):2220-2227.
[12]Warke A,Stallknecht D,Williams S M,et al.Comparative study on the pathogenicity and immunogenicity of wild bird isolates of avian paramyxovirus 2,4,and 6 in chickens[J].Avian Pathol,2008,37(4):429-434.
[13]Khattar S K,Kumar S,Xiao Sa,et al.Experimental infection of mice with avian paramyxovirus serotypes 1 to 9[J].PLoS One,2011,6(2):e16776.
[14]Samuel A S,Subbiah M,Shive H,et al.Experimental infection of hamsters with avian paramyxovirus serotypes 1 to 9[J].Vet Res,2011,42:38.

