2株鹌鹑H9N2亚型流感病毒的分离鉴定
范春艳,宋金祥,薛素琴,唐争魁,孙惠霞,乔 健,马兴树,王顺山
(1.中国农业大学动物医学院,北京 海淀 100193;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056002;3.河北省张北县动物卫生监督所,河北 张北 076450;4.河北省邯郸市肉鸡场,河北 邯郸 056000;5.河北省邯郸市邯山区农业农村局,河北 邯郸 056000;6.北京生泰尔科技股份有限公司,北京 大兴 102600)
禽流感(Avian influenza,AI)是由正黏病毒科A型流感病毒中有致病性的任何一型毒株引起各种家禽及野鸟的一种传染性疾病综合征,受感染的禽类可呈现临床症状,如轻度上呼吸道疾病,产蛋率、受精率及孵化率下降,甚至急性全身致死性疾病[1]。疾病的严重程度取决于病毒毒株的毒力、感染禽种、年龄、性别、有无并发症及环境条件等。迄今为止,已鉴定的A型流感病毒(Avian influenza virus,AIV)表面主要糖蛋白血凝素(HA)为18种(H1~H18)、神经氨酸酶(NA)为11种(N1~N11),其中H1~H16和N1~N9均可自禽类分得[2],H17N10和H18N11则发现于蝙蝠[3-4]。H9N2亚型属于低致病性AIV(LPAIV),但自1992年我国首次发现后[5],现已成为我国主要流行的亚型,分布广泛,具有跨宿主传播特点,且有可能产生遗传特性及抗原特性完全不同的新型流感病毒风险[6]。近年来,随着我国鹌鹑饲养数量的逐年增多,多种亚型AIV对鹌鹑养殖业的健康发展已构成严重威胁[7],有资料表明,鹌鹑在流感病毒生态系统中可作为一个重要的中间宿主[8-9]。因此,对鹌鹑流感病毒的监控具有重要公共卫生意义。2006-2014年,对河北省部分养殖场病死鹌鹑采集的气管拭子样品23份,通过病毒分离、血凝试验(HA)、血凝抑制(HI)试验及反转录聚合酶链反应(RT-PCR)鉴定出2株H9N2流感病毒。现将鉴定结果报告如下。
1 材料与方法
1.1 材料
1.1.1 病料与鸡胚 病料为采集于河北省部分养殖场病死鹌鹑的气管分泌物。9~12日龄SPF鸡胚,购自北京梅里亚维通实验动物技术有限公司。
1.1.2 阳性血清 鸡新城疫病毒血凝抑制试验阳性血清,购自中国兽医药品监察所;禽流感病毒H9亚型、H5亚型(Re-6、Re-7及Re-8)及H7亚型(H7N9株)阳性血清,均购自哈尔滨维科生物技术开发公司。
1.1.3 试剂盒 MiniBEST病毒RNA/DNA提取试剂盒 (MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、一步法RT-PCR试剂盒[PrimeScriptTMOne Step RT-PCR Kit Ver.2 (Dye Plus)],均购自TaKaRa公司。
1.2 方法
1.2.1 样品的采集与处理 2006-2014年,自有呼吸道症状、脸肿、下痢(黄绿色稀水样粪便)、鹌鹑产蛋率下降、死亡率较高的病死鹌鹑的气管中,用灭菌棉拭子蘸取适量硫酸庆大霉素注射液(8万IU/mL),无菌条件下擦拭病死鹌鹑的气管分泌物,制成气管拭子。将气管拭子置于备有2 mL采样液(硫酸庆大霉素注射液)的灭菌离心管中充分混匀,并将拭子头在灭菌的离心管壁上反复挤压数次,然后12 000 r/min离心2 min,取上清液经直径0.22 μm的微孔细菌滤器除菌,滤液备用[1]。
1.2.2 病毒分离培养 采用鸡胚接种法[1]。取上述处理备用的样品0.1~0.2 mL接种于10~12日龄SPF鸡胚尿囊腔,每一样品接种5枚鸡胚。于37 ℃、56%湿度条件下在孵育箱中孵育2~3 d。弃去24 h内死亡的鸡胚,收集24~72 h的鸡胚尿囊液。收获的尿囊液分别滴3~4滴于大孔塑料版的不同孔中,加等量的1%鸡红细胞,摇匀后静置于4 ℃ 30 min观察结果,如出现血凝,则可进一步测定血凝滴度并鉴定。如血凝阴性,按上述方法盲传3代,如仍为阴性,则弃之。
1.2.3 病毒初步鉴定 采用血凝(HA)与血凝抑制(HI)试验。对具有血凝性的病毒,分别与新城疫(Newcastle disease,ND)阳性血清及H9、H5(Re-6、Re-7、Re-8)及H7(H7N9株)禽流感阳性血清进行HI试验。
1.2.4 病毒的鸡胚传代 采用鸡胚接种法[1]传代,共传5代。第1代鸡胚尿囊液为气管拭子的处理样品接种SPF鸡胚收获的病毒尿囊液。第1~4代病毒尿囊液采用2种方法进行鸡胚传代培养。一种方法是直接用上一代病毒尿囊液原液接种SPF鸡胚尿囊腔;另一种方法是将上一代鸡胚尿囊液配制为4个凝集单位的病毒液,然后接种SPF鸡胚尿囊腔。接种培养后,均采用HA试验测定1~5代鸡胚尿囊液的血凝效价,对2种接种方法进行比较。
1.2.5 病毒RNA提取 按照MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂盒说明书进行。
1.2.6HA、NA基因的RT-PCR扩增及序列测定 根据文献报道的HA和NA引物序列[10],由宝生物工程(大连)有限公司合成。HA引物序列(F:5′-AGC AAA AGC AGG GGA ATT TCA C-3′;R:5′-AGT AGA AAC AAG GGT GTT TTT GC-3′)和NA引物序列(F:5′-AGC AAA AGC AGG AGT AAA AAT G-3′;R:5′-AGT AGA AAC AAG GAG TTT TTT-3′)。
参照PrimeScriptTMOne Step RT-PCR Kit Ver.2试剂盒说明书进行RT-PCR扩增:50 ℃ 30 min;94 ℃ 2 min;35个循环:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min;72 ℃ 10 min;4 ℃终止反应。反应产物1%琼脂糖凝胶电泳检验后,送北京华大基因科技服务有限公司测序。
1.2.7 基因序列同源性分析 采用NCBI在线HA和NA基因序列BLAST分析。
2 结果
2.1 采样鹌鹑群的发病情况调查 2006-2014年共从23个疑似发生流感的鹌鹑养殖场进行了样品采集。疑似发生流感的鹌鹑群发病情况基本类似,但临床表现及病理剖检变化轻重不一。不同日龄的鹌鹑均可发生,基本是在禽流感疫苗免疫3月以上或未免疫禽流感疫苗的鹌鹑群发生。临床症状综合表现为下列现象:鹌鹑发病率和死亡率约为20%~100%,其中某些鹌鹑群发病率约为20%左右,几乎无死亡。鹌鹑产蛋量下降到60%以下。患病鹌鹑精神沉郁、呆立一隅,食欲减少,羽毛蓬乱;严重者低头缩颈、闭眼、打盹,站立不稳,或头颈歪邪、头缩于翅下,或蹲卧于笼中,食欲废绝,排出黄绿色或白色水样、黏液样粪便;最严重者肢体无力,蹲卧不起。病死鹌鹑剖检可见,气管内有黏性分泌物或稀软奶酪样物质,有的气管出血,有的气管无出血;腺胃与食道交界处出血,腺胃肿胀,内膜覆盖厚厚一层黏稠分泌物,腺胃乳头出血;十二指肠等肠道肿胀,内有黏性分泌物,肠道黏膜斑块状出血;胰腺出血;心冠脂肪出血;输卵管内有黏稠分泌物,严重的卵泡变形、破裂,腹腔内有破裂的新鲜卵黄等。
2.2 病毒的初步鉴定 2006-2014年共采集不同日龄病死鹌鹑气管拭子23份,除1个样品经鸡胚尿囊腔接种盲传3代仍无血凝外,其他22份样品的鸡胚尿囊液的血凝滴度均在5Log2以上(表1)。经HI试验鉴定发现,其中2009年分离的Qa/LC04/09毒株、2011年分离的Qa/LC02/11毒株和Qa/LC04/11为ND阳性病毒,除2008年分离的Qa/LC02/08毒株和2011年分离的Qa/LC01/11毒株为H9N2阳性外,其余样品均为H5亚型阳性AIV(表1)。

表1 鸡胚尿囊液HA和HI试验结果Table 1 HA and HI titre of the allantoic fluid from chick embryos
2.3 鹌鹑H9N2流感病毒的鸡胚传代血凝性分析 Qa/LC02/08和Qa/LC01/11毒株的气管拭子样品经SPF鸡胚接种后,收获的第1代鸡胚尿囊液的HA滴度均为5Log2。鸡胚尿囊液原液传代的第2代鸡胚尿囊液的HA滴度升高,分别为8Log2和9Log2,第3代鸡胚尿囊液的HA滴度均下降为6Log2,第4代HA滴度下降为4Log2和5Log2。但传代时先将上一代病毒尿囊液稀释为4个血凝单位病毒尿囊液,然后再接种9~12日龄SPF鸡胚尿囊腔,则收获的下一代病毒尿囊液的HA滴度均能达到8Log2以上(表2)。结果表明,在流感病毒采用SPF鸡胚传代时,不应使用未经稀释的高浓度的病毒尿囊液进行鸡胚接种传代,而应将其稀释为4个血凝单位后,再接种SPF鸡胚才能使收获的病毒尿囊液的HA滴度升高。
表2 不同鸡胚传代次数的尿囊液HA试验结果(Log2)Table 2 HA titre of the different passages of the allantoic fluid from chick embryos (Log2)
2.4 RT-PCR产物的凝胶电泳鉴定 采用发表文献的HA和NA引物序列合成相应的引物,经RT-PCR扩增出H9和N2目的条带(图1)。2株H9N2 AIV分别命名为A/Quail/Hebei/LC02/2008(H9N2)(简称为Qa/LC02/08)和A/Quail/Hebei/LC01/2011(H9N2)(简称为Qa/LC01/11)。
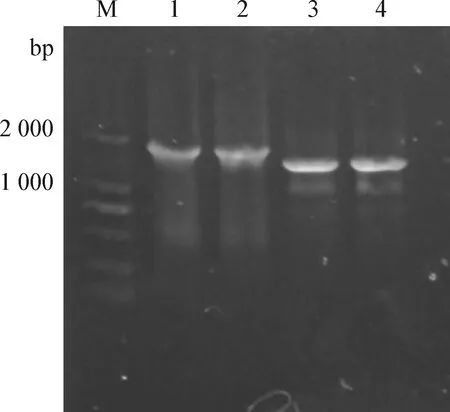
图1 RT-PCR产物电泳图Fig.1 The electrophoregram of the RT-PCR products of two H9N2 AIV from aquilsM:DNA标准DL-2 000;1:Qa/LC02/08的HA基因;2:Qa/LC01/11的HA基因;3:Qa/LC02/08的NA基因;4:Qa/LC01/11的NA基因M:DL-2 000 DNA Marker;1:HA(H9) gene fragment of Qa/LC02/08;2:HA(H9) gene fragment of Qa/LC01/11;3:NA(N2) gene fragment of Qa/LC02/08;4:NA(N2) gene fragment of Qa/LC01/11
2.5HA和NA基因同源性分析HA基因长度为1 742 bp,NA基因长度为1 413 bp。2株鹌鹑分离株Qa/LC02/08与Qa/LC01/11的HA和NA基因的核苷酸同源性分别为97.7%和93.6%。
分离毒株Qa/LC02/08HA基因核苷酸与A/Chicken/Shandong/JN/1999(H9N2)及A/Chicken/Zhejiang/ZC28/2007(H9N2)同源性最高,均为99.39%,而与A/Chicken/Shandong/N/2010(H9N2)、A/Chicken/Guangxi/G8/2009(H9N2)和鸭源A/Duck/Shanghai/C60/2007(H9N2)同源性分别为99.27%、99.08%和99.08%(表3)。NA基因核苷酸与A/Chicken/Shandong/N/2010(H9N2)、A/Chicken/Shandong/B2/2007(H9N2)和A/Chicken/Shandong/JL/2008(H9N2)的同源性分别为99.12%、98.46%和98.38%(表3)。表明鹌鹑分离株Qa/LC02/08确为H9N2亚型流感病毒。
分离株Qa/LC01/11HA基因核苷酸与A/Chicken/Hebei/FL/2011(H9N2)、A/Chicken/Jiangsu/120/2011(H9N2)和A/Chicken/Shandong/H30/2011(H9N2)的同源性分别为99.63%、99.51%和99.45%(表3)。NA基因核苷酸与A/Chicken/Hebei/FL/2011(H9N2)、A/Chicken/Hebei/ZR/2010(H9N2)和A/Chicken/Shandong/WG18/2011(H9N2) 同源性均为99.7%,与A/Chicken/Jiangsu/SQ79/2011(H9N2)同源性为99.63%(表3)。表明鹌鹑分离株Qa/LC01/11确为H9N2亚型流感病毒。

表3 2株鹌鹑H9N2流感病毒的HA和NA基因序列在线BLAST的主要结果Table 3 Main results of online BLAST of HA and NA gene sequences of two strains of quail H9N2 influenza virus
3 讨论
近年来,鹌鹑流感病毒受到研究者的广泛关注,特别是1997年香港禽流感感染者及家禽分离到的H5N1/97样病毒,其内部基因在进化关系上与鹌鹑来源的病毒株A/Quail/G1/97 (H9N2)高度同源[11]。1999年香港感染人的H9N2流感病毒HA基因与鹌鹑分离株A/Quail/G1/97 (H9N2)亲缘关系相近,而其内部基因与Hong Kong/97(H5N1)关系密切[12]。2007年之前,A/Quail/Gl /97株病毒是我国H9N2 AIV的主要流行亚系,持续在鹌鹑和其他陆禽间传播[13]。张增峰等[9]对鹌鹑流感病毒SA受体分布特点的研究结果显示,鹌鹑同时表达SAα-2,3半乳糖苷受体和SAα-2,6半乳糖苷受体,SAα-2,3半乳糖苷受体在气管、支气管呈弱阳性分布,副支气管呈阳性分布,而SAα-2,6半乳糖苷受体在气管、支气管呈强阳性分布,表明鹌鹑呼吸道易与其他禽流感病毒和人流感病毒结合,并在其体内发生流感病毒基因重配而形成新亚型病毒感染人的迹象,即鹌鹑也可充当产生人类流感大流行的中间宿主。因此,对鹌鹑流感病毒的监测尤为重要。
2006-2014年,我们自病死鹌鹑气管中采集的23份样品,经接种鸡胚分离后,通过HA试验初步鉴定出19株流感病毒,其中2株H9阳性,17株H5阳性。事实上,我们试图自鹌鹑不同器官中分离病毒,但未成功。2株H9阳性病毒HA与NA均通过RT-PCR扩增出特异目的条带,进一步确定为H9N2流感病毒。
同源性分析表明,Qa/LC02/08HA基因与山东1999年鸡源H9N2毒株及浙江2007年鸡源H9N2毒株同源性最高,达到99.39%,与2007-2009年浙江、上海、广西、四川、江西、山东、湖北等地的鸡源H9N2HA基因同源性均达到98.7%之上,其NA基因除与山东2010年鸡源H9N2 AIV同源性达99%以上外,与2007-2009年山东、河南、江苏、浙江、福建等地的鸡源H9N2HA基因同源性均达到98%之上,表明H9N2 AIV跨地区传播迅速,并且可在鸡和鹌鹑间进行传播。Qa/LC02/08HA基因与2007年上海鸭源分离株的同源性也达到了99.08%,其NA基因与2008年台州猪源H9N2流感病毒的NA基因同源性达到97.87%,这也表明H9N2流感病毒有跨种传播的能力,也间接地说明鹌鹑可以充当中间宿主的角色,既能感染禽源流感病毒又能感染哺乳动物源流感病毒,并将它们在其体内发生重配,起到流感病毒混合器的作用,有可能引起哺乳动物及人类的流感大流行。
Qa/LC01/11的HA基因与同年在河北、江苏、山东、河南、山西等地鸡源H9N2 AIV的同源性非常高,达到99.3%,其NA与2010-2013年河北、山东、天津、北京等地的鸡源H9N2 AIVNA基因同源性达到98.67%之上,但其HA和NA基因均与河北本地的鸡源分离株A/Chicken/Hebei/FL/2011(H9N2)的同源性最高,分别为99.6%和99.7%,进一步说明鸡与鹌鹑可以相互传播流感病毒,而且能够在流行地区形成本地流行毒株在家禽中稳定流行,因此,及时对家禽进行流感病毒监测是防控禽流感的重要环节。另外,Qa/LC01/11的NA基因又与2008年猪源分离株A/Swine/Hebei/012/2008(H9N2)、鸡源分离株A/Chicken/Hebei/7/2008(H9N2)及A/Chicken/Hebei/4/2008(H9N2)的同源性均为96.97%,同样也说明鹌鹑可以同时感染禽源及哺乳动物源流感病毒,甚至引起基因重组而产生新的流感病毒。对鹌鹑流感病毒具有重要公共卫生意义。
此外,我们在鸡胚传代过程中发现,用未经稀释的高滴度病毒尿囊液原液接种SPF鸡胚所收获的下一代鸡胚尿囊液的HA滴度降低,这可能与病毒传代过程中产生大量的缺陷型干扰(Defective interfering,DI)病毒有关。这与Von Magnus用未稀释的流感病毒通过鸡胚连续传代时发现了不完整的或没有感染力的DI病毒相一致[14]。在传代过程中将上一代病毒尿囊液稀释为4单位病毒再接种鸡胚尿囊腔,收获的下一代病毒尿囊液的HA滴度则明显升高。故应避免使用未加稀释的高滴度病毒尿囊液接种鸡胚,否则因产生大量DI病毒而导致流感病毒HA滴度大幅下降[1,14-15]。

