断奶仔猪源小肠结肠炎耶尔森氏菌的分离鉴定及其致病性研究
关乃瑜,夏 爽,赵丽丽,罗继龙,谷珊珊,崔 文,葛俊伟*,陈洪岩*
(1.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所实验动物与比较医学创新团队,黑龙江哈尔滨 150001)
小肠结肠炎耶尔森菌(Yersinia enterocolitica)为一种常见的食源性致病菌,属于少数几种能够在低温下生长的肠道病原菌之一[1],通常认为猪为Y.enterocolitica 的贮存宿主,为该菌感染人类最主要的传染源[2-4]。该菌感染多发于秋冬季,人感染病例多见于婴幼儿腹泻,也可以感染多种家畜、家禽和啮齿类动物,对幼龄动物具有较高的感染率和致病性。鉴于病原菌源性腹泻尤其是断奶仔猪腹泻等频发于幼龄仔猪的肠道疾病是影响养猪业健康发展的主要因素,而目前已知的该类疾病的细菌性病原主要为大肠杆菌、C 型魏氏梭菌和沙门氏菌等,耶尔森氏菌等其他肠道病原菌的感染是否在断奶仔猪腹泻中发挥作用尚不明确。我们推测Y.enterocolitica 可能在断奶仔猪腹泻发病中起一定的作用。因此,本研究于2012 年9 月~2013 年2 月,采集黑龙江省哈尔滨和七台河的4 个规模化养猪场的断奶仔猪腹泻的粪便样品进行Y.enterocolitica 细菌分离鉴定,并通过检测分离菌株毒力基因以及人工感染实验鼠和断奶仔猪后对其致病性进行研究,为评价Y.enterocolitica 在断奶仔猪腹泻发病中可能发挥的作用提供实验依据。
1 材料和方法
1.1 病料样品、主要试剂及实验动物 在秋冬两季于黑龙江省哈尔滨和七台河地区4 个规模化养猪场采集58 份断奶仔猪腹泻粪便样品,对粪便样品进行记录编号。实验中相关培养基均购自青岛海博生物技术有限公司;生化鉴定试剂购自温州康泰生物科技有限公司;基因组DNA 提取试剂盒、Ex Taq DNA 聚合酶购自TaKaRa 公司。6 周龄~8 周龄BALB/c 小鼠70 只购自北京维通利华实验动物技术有限公司;28 日龄经检测无耶尔森氏菌病原的断奶仔猪8 头购自哈尔滨威尔士牧业科技发展有限公司。
1.2 病原分离 将粪便样品与改良耶尔森氏菌SB增菌液混合,于4 ℃冷增菌14 d。增菌后样品经碱处理液(含0.5 % NaCl 和0.5 % KOH)处理后,先后划线接种于麦康凯琼脂培养基和CIN 琼脂培养基,挑取形态依次为无色半透明、不粘稠、针尖状大小和扁平、边缘明显中心为深红色、成“公牛眼”状的菌落接种于普通肉汤培养基进行纯培养。
1.3 病原形态学观察及生化鉴定 取上述接种于普通肉汤培养基的纯培养物进行革兰氏染色镜检后,按照文献[5]方法进行生化鉴定。
1.4 病原分子鉴定 参照基因组DNA 提取试剂盒说明书提取生化试验筛选的耶尔森氏菌阳性分离菌株的基因组,对Y.enterocolitica 保守基因foxA(铁草胺菌素受体基因)PCR 检测阳性的分离株进行16S rRNA 基因的扩增(引物27F:5'-AGAGTTTGA TCATGGCTCAG-3'/1492R:5'-GGTTACCTTGTTACG ACTT-3'),回收PCR 产物由上海生工生物工程技术服务有限公司测序。
1.5 毒力基因的检测 按照文献[6]PCR 方法对分离菌株的6 种Y.enterocolitica 毒力基因ail、ystA、ystB、virF、yadA 和rbfc 进行检测。
1.6 实验动物致病性试验 参考文献[7-11]对分离菌株的致病性作出评估,将70 只6 周龄~8 周龄BALB/c 小鼠分为6 个实验组和1 个对照组,10 只/组,其中5 只口服接种5 只腹腔接种,人工感染不同分离株进行致病性试验。将菌液浓度调整至1×109cfu/mL,采用口服和腹腔接种两种途径感染小鼠,接种量为2×108cfu,对照组小鼠灌喂等体积培养基,正常饲养观察。
1.7 本动物致病性试验 如上述方法对若干实验组的分离菌株进行28 日龄断奶仔猪的致病性试验,并设置培养基对照组,每组2 头猪。感染前12 h 仔猪禁水、食,灌喂62 mL 1.6 % NaHCO330 min 后,对各实验组仔猪灌喂菌液(含菌量1×1011cfu),对照组灌喂等体积培养基,灌喂后正常饲养,每日观察记录各组仔猪的状态。
1.8 细菌分布的检测 灌喂菌液后逐日采集各组仔猪的粪便样品。在实验组仔猪腹泻症状消失后,迫杀仔猪,采集新鲜肝、肺、心血、肠系膜淋巴结、后肢关节液和小肠内容物,采用PCR 方法对所采集的样品进行Y.enterocolitica 检测。
2 结果
2.1 细菌分离及生化鉴定结果 58 份粪便样品经过冷增菌和碱处理后,先后接种于麦康凯琼脂培养基和CIN 琼脂培养基。结果显示,CIN 琼脂培养基生长的可疑菌落的镜检结果为革兰氏阴性的杆菌或球杆菌,与Y.enterocolitica 相似,生化试验鉴定结果显示有20 株分离菌株对甘露醇、山梨醇、蔗糖、葡萄糖、D-麦芽糖、鸟氨酸脱羧酶、尿素酶、硝酸盐还原、过氧化氢酶、VP 试验及26 ℃时的动力试验的反应均为阳性;对棉籽糖、鼠李糖、D-木糖、水杨苷及硫化氢生成试验和26 ℃时的动力试验反应均为阴性且生长过程中产气,符合Y.enterocolitica 生化特征。
2.2 分子鉴定结果 采用PCR 方法对20 株分离菌株保守基因foxA 进行扩增,结果显示,其中18 株foxA 分子鉴定阳性,初步确定为Y.enterocolitica。随后对18 株分离菌株的16S rRNA 基因进行扩增并测序,将测序结果在GenBank 中进行BLAST 比对分析后确定18 株分离菌株均为Y.enterocolitica。哈尔滨地区和七台河地区断奶仔猪粪变样品该菌的携带率分别为30.3 %和32 %。秋季分离率为28.6 %,冬季分离率为33.3 %(表1)。

表1 Y.enterocolitica 分离情况Table 1 Isolation of Y.enterocolitica
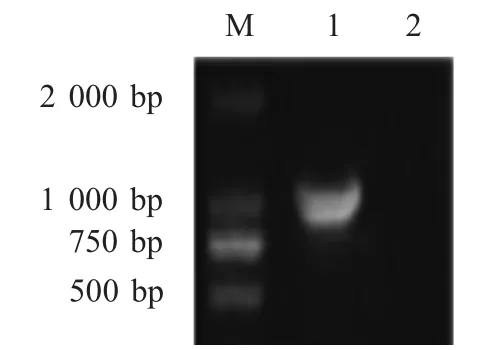
图1 分离菌株foxA 基因扩增结果Fig.1 The amplification of foxA gene from the isolate by PCR
2.3 毒力基因的检测结果 对18 株分离菌ail、ystA、ystB、virF、yadA 和rbfc 6 种毒力基因进行PCR 检测,结果显示,18 株分离菌株分为3 株携带ail 基因的菌株(ail+)、10 株携带ystB 基因的菌株(ystB+)和5 株无毒力基因菌株。3 种类型所占比例分别为17 %、55 %和28 %。部分分离株毒力基因检测结果见图2。
2.4 致病性试验 分别在3 种类型的分离株中各取2 株,Y7 和Y17(ail+)、Y11 和Y18(ystB+)及Y9 和Y16(无毒力基因)采用不同途径人工感染实验组小鼠,评价各菌株致病性。结果显示,口服感染Y7、Y9 和Y16 的小鼠全部产生腹泻(5/5),而腹腔接种Y7、Y11 和Y16 菌液则可致死小鼠,死亡比例分别为5/5、4/5 和5/5。而以Y11 口服感染小鼠、Y9 腹腔接种小鼠及将Y17 和Y18 通过上述两种途径感染小鼠,均不产生明显临床症状,对照组小鼠无异常变化(表2)。
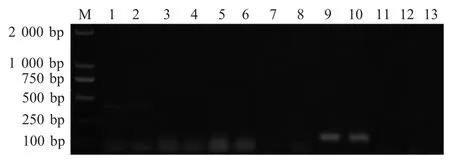
图2 部分分离株的ail 和ystB 基因分布情况Fig.2 The distribution of ail and ystB gene from 6 isolates
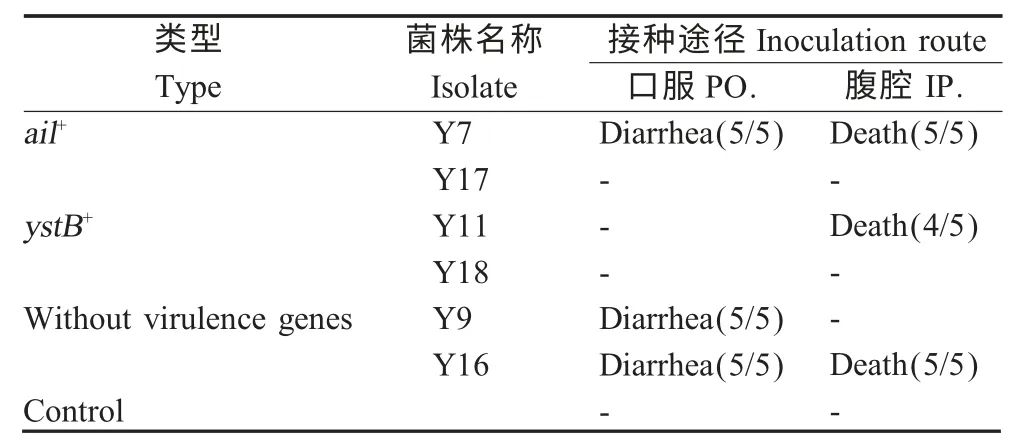
表2 分离株的致病性试验结果Table 2 Pathogenicity test of isolates
2.5 断奶仔猪致病性试验 从3 种类型分离菌株中分别选取Y7(ail+)、Y11(ystB+)和Y16(无毒力基因)3 株菌株,对断奶仔猪进行口服感染。结果显示,Y7 和Y16 两组仔猪均在口服菌液2 d 后开始出现腹泻现象,6 d 和8 d 腹泻现象有所缓解,分别在9 d和10 d 恢复正常。口服Y11 菌液组和培养基对照组仔猪并未见明显临床症状,饮食正常。
2.6 断奶仔猪体内细菌分布的PCR 检测 实验组仔猪腹泻症状消失后,迫杀仔猪,采集新鲜肝、肺、心血、肠系膜淋巴结、后肢关节液和小肠内容物。并采用PCR 方法对所采集的样品进行Y.enterocolitica 检测,结果显示各组仔猪的肝和心血中均未检出该菌。Y7 组仔猪灌喂后7 d 的粪便样品以及肺中检出该菌;Y16 组仔猪后肢关节液、肠系膜淋巴结、肺、小肠内容物及灌喂后8 d 粪便中均分离出该菌;Y11 组仔猪未出现腹泻症状,但该仔猪的关节出现明显肿胀,并且从仔猪的肠系膜淋巴结、后肢关节液及灌喂后8 d 粪便中能够分离到该菌;对照组仔猪的各种样本中均未检出该菌。
3 讨论
本研究对采集自黑龙江哈尔滨和七台河地区的58 头断奶仔猪的腹泻粪便样品进行Y.enterocolitica的细菌分离鉴定,通过生化试验和分子鉴定筛选到18 株Y.enterocolitica 分离菌株,两地区腹泻断奶仔猪粪便带菌率分别为30.3 %和32 %,冬季分离率33.3 %稍高于秋季28.6 %,其原因可能与Y.enterocolitica 的嗜冷性有关。以往的研究常通过检测该菌黏附侵袭位点基因ail、耐热肠毒素基因ystA 和ystB、粘附素基因yadA 及yops 蛋白相关的virF 基因和O∶3 血清型特异性基因rfbC 5 种基因的有无来判断菌株是否具有致病性,典型的致病性菌株携带ail、ystA、yadA 和virF 基因,而携带ystB 基因的ail 阴性菌株和不携带毒力基因的菌株则无致病性[7-9]。Y.enterocolitica 致病性试验多见于小鼠,以口服途径感染幼龄断奶仔猪并发生腹泻的病例鲜有报道[10-11]。本研究筛选到的18 株分离菌株可以分为3 株ail+菌株、10 株ystB+菌株和5 株无毒力基因菌株。Y7(ail+)引起小鼠腹泻和死亡的同时,Y17(ail+)并未引起小鼠发病,并且分离株Y11(ystB+)及无毒力基因的Y9 和Y16 也可以引起小鼠的腹泻和死亡,这与以往研究结果存在差异[7-9]。在断奶仔猪本动物致病性试验中,分离株Y7(ail+)和分离株Y16(无毒力基因)均能够引起仔猪腹泻,并且从两组仔猪后肢关节液、肠系膜淋巴结、肺和小肠内容物中均可检出Y.enterocolitica。Y11(ystB+)组仔猪虽未出现腹泻症状,但该仔猪的关节肿胀症状在以往猪感染病例中并未有报道,并且仔猪粪便、肠系膜淋巴结和后肢关节液均可检出该菌,提示Y.enterocolitica 感染断奶仔猪后产生了新的临床症状并存在隐性感染的现象。
本研究结果表明利用检测Y.enterocolitica 毒力基因的方法来判断其致病性具有局限性,在本实验中小鼠和断奶仔猪感染Y.enterocolitica 后的临床症状及脏器带菌情况与以往的报道存在差异,其原因可能是该菌存在除外膜蛋白YadA、分泌蛋白YopS和耐热肠毒素等致病因子以外更加复杂的致病机制。本研究初步证实Y.enterocolitica 在断奶仔猪腹泻发生过程中起到了一定的作用,深入研究该菌在断奶仔猪腹泻中的作用、角色以及对人类可能产生的影响具有很高的研究价值。断奶仔猪经口服感染Y.enterocolitica 后的关节病变提示断奶仔猪可以作为研究该菌引起人类关节炎的感染模型。本研究为开展流行病学调查和更大规模临床病例的分析以及建立猪感染模型的研究奠定基础。
[1]杨晋川,刘金芳,徐静静,等.32 株小肠结肠炎耶尔森菌病原学特征[J].中华传染病杂志,2007,25(10):607-610.
[2]Horisaka T,Fujita K,Iwata T,et al.Sensitive and specific detection of Yersinia psedotuberculosis by loop-mediated isolatermal amplification[J].J Clin Microbiol,2004,42:5349-5352.
[3]Jones T F.From pig to pacifier:chitterling-associated Yersiniosis outbreak among black infants[J].Emerg Infect Dis,2003,9:1007-1009.
[4]Nesbakken T.Pig herds free from human pathogenic Yersinia enterocolitca[J].Emerg Infect Dis,2007,13:1860-1864.
[5]郑薛斌,谢春.用体外法测定致病性小肠结肠炎耶尔森氏菌[J].中国预防兽医学报,1999,21(5):390-393.
[6]Toerner P,Bin kingombe C I,BogliStuber K,et al.PCR detection of virulence genes in Yersinia enterocolitica and Yersinia pseudotuberculosis and investigation of virlence gene distribution[J].Appl Environ Microbiol,2003,69(3):1810-1816.
[7]Drummond N,Murphy B P.Ringwood T,et al.Yersinia enterocolitica:a bref review of the issues relating to the zoonotic pathogen,public health challenges,and the pork production chain[J].Foodborne Pathog Dis,2012,9(3):179-189.
[8]Schutz M,Weiss E M,Schindler M,et al.Trimer stability of yadA is critical for virulence of Yersinia enterocolitica[J].Infect Immun,2010,78(6):2677-2690.
[9]Bliska J B,Falkow S.Bacterial resistance to complement killing mediated by the Ail protein of Yersinia enterocolitica[J].Proc Natl Acad Sci U S A,1992,89(8):3561-3565.
[10]张红见,韩志辉,潘慧霞.仔猪粪便中小肠结肠炎耶尔森菌的检测[J].动物医学进展,2010,31(7):114-116.
[11]Schaake J,Drees A.Essential role of invasin for colonization and persistence of Yersinia enterocolitica in its natural reservoir host,the pig[J].Infect Immun,2014,82(3):960-969.

