猪传染性胃肠炎病毒NSP5蛋白单克隆抗体的制备及抗原表位鉴定
董 慧,张 鑫,陈建飞,时洪艳,石 达,常铁城,谷凤丽,4,徐 天,王智琴,冯 力*
(1.沈阳农业大学 畜牧兽医学院,辽宁 沈阳 110161;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/猪传染病研究室,黑龙江 哈尔滨 150001;3.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;4.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030;5.首都医科大学 基础医学院,北京 100069)
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)属于套式病毒目,冠状病毒科,α-冠状病毒属,为引起仔猪病毒性腹泻的病原之一[1],由其引起的猪传染性胃肠炎(TGE)以呕吐、严重腹泻和对2 周龄以内仔猪的高度致死为特征。冠状病毒的非结构蛋白具有多种功能,其中包括参与RNA 转录、翻译和蛋白合成、加工和修饰以及病毒复制、感染宿主等功能。TGEV NSP5 蛋白为蛋白水解酶,大小为27 ku~34 ku,因其与微小RNA病毒3C 蛋白酶具有相似的识别位点而被称为3C 样蛋白酶(3C-like proteinase,3CLpro)。3CLpro 可以结合ORF1ab 上的11 个保守的Q-S 二肽位点从而水解产生12 个成熟的非结构蛋白(NSP5~NSP16)。研究表明,不同亚群病毒的3CLpro 底物结合部位具有很高的保守性,如SARS-CoV 的3CLpro 可以裂解TGEV 的底物[2]。
本实验通过制备TGEV NSP5 蛋白单克隆抗体(MAb)并对其抗原表位进行鉴定,为TGEV NSP5 蛋白结构及其相关功能的研究奠定了基础。
1 材料和方法
1.1 病毒核酸、细胞及实验动物 TGEV cDNA、SP2/0 骨髓瘤细胞和ST 细胞由本实验室保存;大肠杆菌Trans5α 和BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;6 周龄~8 周龄BALB/c 小鼠购自中国农业科学院哈尔滨兽医研究所实验动物中心。
1.2 主要试剂 pGEX-6P-1 和pEGFP-C2 载体由本实验室保存;质粒DNA 小量试剂盒购自Axyprep 公司;EndoFree Plasmid Maxi Kit 和Attractene Transfection Reagent 购自QIAGEN 公司;Anti-GFP antibody购自Abcam 公司;弗式完全佐剂、弗式不完全佐剂、PEG1450、HAT 和HT 购自SIGMA 公司;HRP标记山羊抗鼠IgG(IgG-HRP)购自北京中杉金桥生物技术有限公司;TMB 购自AMRESCO 公司;MAb亚类鉴定试剂盒SBA ClonotypingTMSystem/HRP 购自Southern Biotech 公司;IRDye700DX®兔抗猪IgG、IRDye700DX®绵羊抗兔IgG 和IRDye700DX®山羊抗鼠IgG 购自本研究所;蛋白质Marker 购自Thermo公司。
1.3 TGEV NSP5蛋白的表达及纯化 根据Gen-Bank 中EU074218.2 序列设计并合成2 对扩增TGEV nsp5 基因的引物,引物序列分别为:上游引物1:5'-GTGGATCCTCAGGTTTACGGAAAATGGC-3'(Bam HⅠ);下游引物1:5'-GACTCGAGCTGAAG ATTTACACCATAC-3'(XhoⅠ)。上游引物2:5'-GT CTCGAGTCAGGTTTACGGAAAATGGC-3'(Xho Ⅰ);下游引物2:5'-GAGGATCCCTGAAGATTTACACCA TAC-3'(Bam HⅠ),引物由哈尔滨博仕生物技术有限公司合成。以TGEV cDNA 为模板,PCR 扩增nsp5基因,将扩增的TGEV nsp5 基因、pGEX-6P-1 和pEGFP-C2 分别用Bam HⅠ和XhoⅠ双酶切,用T4 DNA 连接酶16 ℃过夜连接,构建重组质粒pGEXNSP5 和pEGFP-NSP5。
将构建的重组质粒pGEX-NSP5 转化BL21(DE3)感受态细胞,经IPTG 诱导表达,离心,超声破碎,分离上清液和沉淀。通过SDS-PAGE 分析重组蛋白(rNSP5-GST)的表达。利用谷胱甘肽树脂对rNSP5-GST 进行纯化,通过SDS-PAGE 分析其纯度,超微量分光光度计测定蛋白浓度。
将构建的重组质粒pEGFP-NSP5 转化Trans5α 感受态细胞,用EndoFree Plasmid Maxi Kit 提取重组质粒pEGFP-NSP5,按照Attractene Transfection Reagent说明书方法将重组质粒pEGFP-NSP5 转染ST 细胞以表达rNSP5-GFP 蛋白。
1.4 重组蛋白的western blot鉴定 以纯化的rNSP5-GST 为抗原,抗TGEV 猪阳性血清为一抗,IRDye700DX®兔抗猪IgG(1∶5 000)为二抗,进行western blot 鉴定rNSP5-GST 的抗原性。收集并裂解转染后24 h 的ST 细胞作为抗原,以抗GFP 标签的多抗为一抗,IRDye700DX®绵羊抗兔IgG(1∶5 000)为二抗,进行western blot 鉴定检测rNSP5-GFP 的表达。
1.5 动物免疫 将纯化的rNSP5-GST 蛋白与等体积的弗式不完全佐剂乳化后,按50 μg/只的剂量腹部皮下注射免疫6 周龄~8 周龄BALB/c 小鼠。间隔2 周免疫一次,共免疫3 次,第2 次和第3 次免疫时用rNSP5-GST 蛋白与等体积的弗式完全佐剂进行乳化,50 μg/只。第3 次免疫一周后,断尾采血,间接ELISA 方法检测小鼠抗体水平,选择抗体水平最高的小鼠腹腔注射rNSP5-GST 蛋白50 μg/只加强免疫[3],3 d 后取脾脏进行细胞融合。
1.6 细胞融合、MAb的制备以及MAb亚类鉴定按照常规方法进行融合[4],以纯化的rNSP5-GST 蛋白为包被抗原,建立间接ELISA 方法[5-6],并用GST标签蛋白为包被抗原筛选掉针对GST 标签的杂交瘤细胞株[7]。取杂交瘤细胞培养上清液进行检测,抗TGEV NSP5 阳性血清作为阳性对照,未免疫小鼠的血清作为阴性对照。通过有限稀释法对阳性杂交瘤细胞进行3 次克隆纯化,直至筛选结果100 %为阳性[8]。按照MAb 亚类鉴定试剂盒说明书进行MAb亚类鉴定。
1.7 MAb结合活性鉴定 以纯化的rNSP5-GST 蛋白和GST 标签蛋白为抗原,MAb 为一抗,IRDye 700DX®山羊抗鼠IgG(1∶5 000)为二抗,进行western blot 鉴定;以rNSP5-GFP 蛋白、GFP 标签蛋白及ST 细胞裂解物为抗原,MAb 为一抗,山羊抗鼠IgG-HRP(1∶3 000)为二抗,TMB 显色后进行western blot 鉴定。
1.8 抗原表位的鉴定 根据TGEV 的nsp5 基因序列设计相互部分重叠覆盖全长基因的5 对引物,每对引物上下游引入Bam HⅠ和XhoⅠ酶切位点。以pGEX-NSP5 为模板,经PCR 扩增后将目的片段克隆于表达载体pGEX-6P-1 中构建重组质粒,分别命名为pGEX-NSP5-(1-5)。将重组质粒转化BL21(DE3)感受态细胞,经IPTG 诱导表达,得到表达的各段多肽大小分别为34 ku(aa1~aa70)、34 ku(aa61~aa130)、34 ku(aa121~aa190)、35 ku(aa181~aa255)、33 ku(aa246~aa302)。以表达的各段多肽为抗原,MAb 为一抗,IRDye700DX®山羊抗鼠IgG(1∶5 000)为二抗,进行western blot 鉴定。对与MAb 反应的多肽氨基酸序列继续截短表达,设计相互部分重叠覆盖该段多肽全长基因的4 对引物,同上述方法表达各段多肽并进行western blot 试验,初步确定MAb 与NSP5 蛋白的反应区域。
按照初步确定的与MAb 反应区域的多肽氨基酸序列合成4 段多肽,以合成的4 条多肽为包被抗原,MAb 为一抗,山羊抗鼠IgG-HRP(1∶5 000)为二抗,利用间接ELISA 方法精确定位抗原表位序列。
2 结果
2.1 NSP5蛋白的表达及纯化 重组质粒pGEXNSP5 经Bam HⅠ和XhoⅠ双酶切鉴定得到两个片段,与预期大小4 900 bp 和906 bp 相符(图略);pEGFP-NSP5 经Bam HⅠ和XhoⅠ双酶切鉴定得到两个片段,与预期大小4 700 bp 和906 bp 相符(图略),测序结果正确。将pGEX-NSP5 转化BL21(DE3)中,经IPTG 诱导表达,SDS-PAGE 分析结果显示,表达的重组蛋白约为60 ku,大小与预期相符(图略)。
2.2 重组蛋白的western blot鉴定 western blot 结果显示rNSP5-GST 可以与抗TGEV 猪阳性血清产生反应,表明其具有良好的抗原性,并且正确表达rNSP5-GFP 和GFP-tag(图1)。
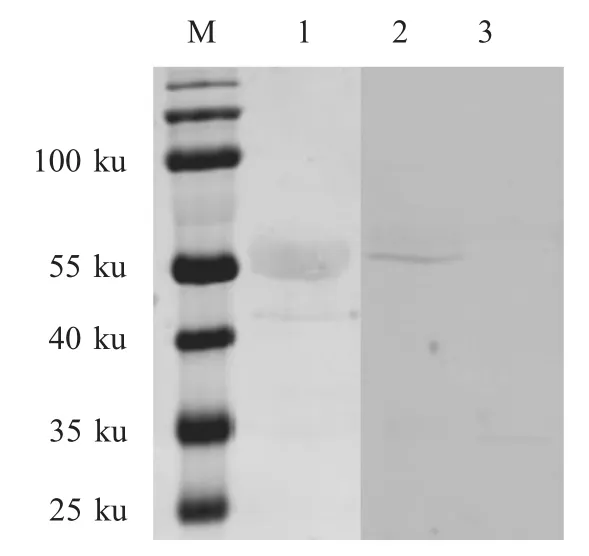
图1 原核rNSP5-GST 和真核rNSP5-GFP 细胞表达的重组蛋白western blot 鉴定Fig.1 Identification of the rNSP5-GST and rNSP5-GFP by western blot
2.3 阳性杂交瘤细胞株的制备、亚类鉴定及效价测定 融合后的细胞经3 次克隆纯化得到一株稳定分泌抗TGEV NSP5 蛋白的杂交瘤细胞株,命名为5C3。经MAb 亚类鉴定该细胞株分泌抗体类型为IgG1/κ。经间接ELISA 方法测定这株阳性杂交瘤细胞上清液和其诱导小鼠产生的腹水效价分别为1∶6 400 和1∶105。
2.4 MAb结合活性鉴定 利用western blot 鉴定MAb 5C3,结果显示其与原核表达的rNSP5-GST 蛋白和真核表达的rNSP5-GFP 蛋白呈阳性反应,在60 ku 处出现特异性条带,而与GST 标签蛋白、GFP 标签蛋白和ST 细胞呈阴性反应(图2),证明MAb 5C3 与原核和真核表达的NSP5 蛋白均具有结合活性。
2.5 抗原表位的鉴定 将NSP5 蛋白截短为5 段蛋白分别表达,以截短表达蛋白为抗原,MAb 5C3 为一抗,进行western blot 试验,结果表明MAb 5C3与第5 段(aa246~aa302)反应;将第5 段蛋白继续截短为4 段蛋白分别表达,以表达蛋白为抗原,MAb 5C3 为一抗,进行western blot 试验,结果表明MAb 5C3 与第4 段(aa276~aa302)反应,初步确定MAb 5C3 识别的表位区为:276TILSYGSLCDEFTPTEVIRQ MYGVNLQ302(图3)。将第4 段蛋白截为aa276-aa295和aa281~aa302 两段合成多肽,以合成的多肽为包被抗原,MAb 5C3 为一抗进行间接ELISA 反应,结果显示MAb 5C3 与aa281~aa302 段多肽反应;将aa281~aa302 段多肽继续截为aa286~aa300 和aa288~aa302 两段合成多肽,以合成的多肽为包被抗原,MAb 5C3 为一抗进行间接ELISA 反应,结果显示MAb 5C3 与aa286~aa300 段多肽反应,即MAb 5C3 的表位氨基酸序列为286EFTPTEVIRQMYGVN300(图4)。

图2 MAb 结合活性鉴定Fig.2 Identification of the MAb

图3 两次截短表达后抗原表位鉴定western blot 分析Fig.3 Epitope mapping of the TGEV NSP5 with MAb 5C3 by western blot
3 讨论

图4 合成短肽的间接ELISA 分析Fig.4 Analysis of synthetic short peptides by indirect ELISA
TGE 是一种急性、高接触性肠道传染病,不同年龄和品种的猪均可感染,在寒冷季节常呈地方性暴发流行,给养猪业造成严重的经济损失。随着3CLpro 蛋白活性位点和结构研究的深入,NSP5 被认为是抗SARS 和其他冠状病毒药物研究的重要靶点[9-10]。MAb 作为一种免疫学工具,在病原的生物学特性、免疫机制以及病原的预防治疗等方面起着重要的作用。
本实验中由于rNSP5-GST 蛋白以可溶性的方式表达,因此选择过柱的方法对融合蛋白进行纯化。以纯化后的rNSP5-GST 蛋白作为抗原,抗TGEV 猪阳性血清为一抗,western blot 分析表明,rNSP5-GST 蛋白具有良好的抗原性,因而可以用于免疫小鼠及MAb 的筛选。与切胶纯化法相比,过柱纯化法为非变性纯化,避免了对蛋白二级结构的破坏,因而能够筛选出与真核表达的rNSP5-GFP 蛋白反应的MAb。本实验中先对NSP5 蛋白截短表达,以截短表达的NSP5 蛋白为抗原,MAb 5C3 为一抗进行western blot 试验,初步确定MAb 5C3 识别的表位区域,结果表明MAb 5C3 识别的表位区为:276TILS YGSLCDEFTPTEVIRQMYGVNLQ302。根据初步鉴定的表位区设计合成多肽,以合成多肽为包被抗原,MAb 5C3 为一抗进行间接ELISA 反应,鉴定出TGEV NSP5 蛋白的一个线性表位为:286EFTPTEVIR QMYGVN300。
本研究通过TGEV NSP5 蛋白MAb 的制备及其抗原表位的鉴定,为TGEV NSP5 蛋白结构和生物学功能的进一步研究奠定了基础。
[1]Leman A D,Straw B,Glock R D,et al.Disease of swine[M].7thed.Ames:Iowa State University Press,1992,362-386.
[2]边葶苈,周继勇,廖敏.冠状病毒非结构蛋白的研究进展[J].中国动物传染病学报,2013,21(4):67-74.
[3]王芳,刘晓丽,赵飞,等.禽传染性支气管炎病毒单克隆抗体的制备及其B 细胞抗原表位的鉴定[J].中国预防兽医学报,2012,34(4):309-312.
[4]Heddy Zola.单克隆抗体技术手册[M].周宗安,等.南京:南京大学出版社,1991.
[5]王凌风,杨涛,孙恩成,等.蓝舌病病毒17 型VP2 蛋白单抗隆抗体的制备及其抗原表位鉴定[J].中国预防兽医学报,2011,33(6):465-470.
[6]姬希文,闫丽萍,颜丕熙,等.鸭坦布苏病毒抗体间接ELISA 检测方法的建立[J].中国预防兽医学报,2011,33(8):630-634.
[7]迟延彬,陈建飞,时洪艳,等.A 群猪轮状病毒VP7 蛋白单克隆抗体的制备及鉴定[J].中国畜牧兽医,2014,41(2):70-74.
[8]张志榜,陈建飞,时洪艳,等.猪流行性腹泻病毒M 蛋白单抗隆抗体的制备及鉴定[J].中国预防兽医学报,2011,33(7):568-570.
[9]Anand K,Ziebuhr J,Wadhwani P,et al.Coronavirus main proteinase(3CLpro)structure:basis for design of anti-SARS drugs[J].Science,2003,300(5626):1763-1767.
[10]Ramajayam R,Tan K P,Liang P H.Recent development of 3C and 3CL ptotease inhibitors for anti-coronavirus and anti-picoronavirus drug discovery[J].Biochem Soc Trans,2011,39(5):1371-1375.

