QX基因型鸡传染性支气管炎病毒致弱研究
霍亚飞,许传田,崔言顺,杨少华,黄庆华,张 琳,黄艳艳,李建亮,胡北侠*,张秀美*
(1.山东省农业科学院畜牧兽医研究所 山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;2.山东农业大学 动物科技学院,山东 泰安 271018)
鸡传染性支气管炎(Infectious bronchitis,IB)是由禽传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一类急性、高度接触性传染病。IBV 基因组为单股正链RNA,长约27.6 kb,基因组5' 端约2.0 kb 为复制酶基因,包含两个开放性阅读框(Opening reading frame,ORF)ORF 1a 和1b,分别编码440 ku 和300 ku 的多聚蛋白,并可以通过核糖体移码作用产生700 ku 的多聚蛋白1ab。1a 和1ab 多聚蛋白可以水解生成15 种非结构蛋白(Nonstructural proteins,nsps),在IBV 转录与复制中发挥重要作用[1-2]。基因组3' 端编码4 种结构蛋白-纤突蛋白(Spike,S)、膜蛋白(Membrane,M)、核蛋白(Nucleocapsid,N)和囊膜蛋白(Envelope,E),此外还编码4 种非结构蛋白[1]。
目前,进行弱毒活疫苗免疫是防控该病的主要措施之一。由于不断出现IBV 变异株,对该病的有效防控造成严峻挑战。研究显示,我国近年来鸡群中分离的IBV 株50 %以上为QX 基因型,而目前广泛应用的Mass 基因型弱毒疫苗株H120 对该类流行株的免疫效果并不理想[3-6]。本实验室筛选了1 株具有广泛抗原谱的QX 基因型IBV 株SDZB0808[7],并通过鸡胚连续传100 代进行毒力致弱(命名为P100),初步免疫效力试验结果显示P100 对同源和异源QX基因型IBV 流行株具有良好的免疫保护效果(另文报道)。本研究对P100 进行了致病性试验和全基因组测序,并与其亲本强毒株SDZB0808 进行了序列比较,以研究IBV 致弱的主要分子机制。
1 材料和方法
1.1 病毒株、SPF鸡胚及实验动物 SDZB0808(KF853202)山东IBV 分离株由本实验室分离并保存;P100 为SDZB0808 株在9~11 日龄SPF 鸡胚连续传100 代获得的子代病毒;SPF 鸡胚和SPF 鸡购自山东省农业科学院家禽研究所SPF 鸡研究中心。
1.2 主要试剂 TRIzol Reagent RNA 抽提试剂、One-Step RT-PCR 试剂盒和DNA Marker DL 2000 均购自山东赛恩斯科技有限公司。
1.3 引物设计与合成 参考GenBank 中登录的IBV全基因组序列,设计25 对引物用于扩增P100 全基因组(表略),引物由上海生工生物工程技术服务有限公司合成。
1.4 P100致病性试验
1.4.1 实验鸡分组 3 日龄SPF 鸡60 只,随机分成3 组,分别编号为A、B 和C 组,每组20 只。A、B 组分别采用P100 和SDZB0808 进行滴鼻点眼病毒接种,剂量均为105.0EID50/只。C 组用0.01 mL 无菌0.01 M(pH7.2)PBS 缓冲液滴鼻点眼。各组实验鸡分别于不同隔离器中饲养。每天观察实验鸡精神、食欲情况(14 d),统计发病死亡情况,病死鸡进行剖检。
1.4.2 实验鸡病毒接种后排毒检测 于病毒接种后第4 d、7 d、10 d 及14 d 迫杀各组实验鸡各3 只,观察病理变化,将气管和肾脏置于10 %福尔马林中,以备制作组织切片,同时取气管、肺脏、肾脏、法氏囊、腺胃、脾脏、肝脏、心脏、喉头和泄殖腔棉拭进行病毒RT-PCR 检测,每次3 只。
1.5 P100全基因组序列测定与分析 按TRIzol 试剂盒说明方法提取病毒基因组RNA,反转录制备cDNA。利用通用引物PCR 扩增后经1.2 %琼脂糖凝胶电泳鉴定。将鉴定正确的cDNA 由上海生工生物工程技术服务有限公司进行测序。采用分子生物学软件DNAStar 将P100 各基因片段序列进行拼接,获得其全基因序列,并与SDZB0808 基因组进行比对分析。
2 结果
2.1 P100致病性试验结果
2.1.1 实验鸡临床症状和病理变化 B 组经SDZB0808 攻毒后2 d 个别鸡只出现食欲下降,精神沉郁、缩颈、羽毛松乱和气管啰音等临床症状,于3 d~10 d 病死8 只,第14 d 存活实验鸡精神、食欲基本恢复正常。剖检显示病死鸡主要表现气管环出血、肾脏肿大(花斑肾)。A 组实验鸡经P100 攻毒后在14 d 观察期内精神、食欲均正常,与对照组(C组)相比无明显临床症状和病理变化。
2.1.2 实验鸡病毒接种后排毒检测 于病毒接种后不同时间点对实验鸡喉头和泄殖腔样品进行检测,结果显示,A、B 组实验鸡喉头和泄殖腔样品在攻毒后4 d~14 d 均可以检测到病毒,正常对照组检测结果均为阴性(表1)。
内脏组织病毒检测结果显示:A 组实验鸡经P100 攻毒后4 d~14 d 气管和法氏囊组织均可以检测到病毒,肺脏(4 d 和14 d)、腺胃(4 d)和脾脏(7 d和10 d)仅在个别时间点检测到病毒,肾脏、肝脏和心脏在4 d~14 d 病毒检测均为阴性。B 组实验鸡经SDZB0808 攻毒后,气管、肺脏和肾脏等组织在第4 d~14 d 均可以检测到病毒(表1),病毒检出率和存在时间均明显高于A 组。对照组(C 组)实验鸡组织排毒检测均为阴性。
病理组织观察结果显示:A 组实验鸡气管和肾脏无明显的组织病变,B 组实验鸡气管纤毛脱落,出血;肾脏肿大,间质内炎性细胞浸润(图1)。

表1 实验鸡攻毒后喉头、泄殖腔棉拭和内脏组织病毒检测结果Table 1 Virus detection from swabs and tissues of chickens inoculated with P100 and SDZB0808
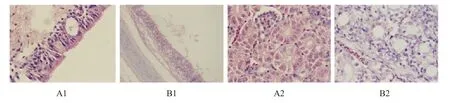
图1 实验鸡接种后7 d 气管和肾脏组织病理组织学变化(苏木精-伊红染色,1 000×)Fig.1 Gross lesions and histopathologic analysis(hematoxylin and eosin staining,1,000×)of tissues from chickens infected with P100 or SDZB0808
2.2 P100全基因组测序结果 将P100 各基因片段测序结果进行拼接,获得了其除5' 端Cap 和3' 端Poly(A)之外的基因组序列(27 647 bp),并登录至GenBank,序列号为KM586818。
与亲本株SDZB0808 进行全基因组序列比对分析显示,P100 共有3 个位点发生有义碱基突变(A9664C、A20596T 和C24300A),导致ORF 1a(I3047L)、S蛋白(N76Y)和E 蛋白(L29I)氨基酸发生了替换(表2)。

表2 致弱前后不同位点的变化Table 2 Changes of different bases in SDZB0808 and P100
P100 基因组在3 244~3 277 缺失了30 个核苷酸,导致ORF 1a 缺失了10 个氨基酸(906VKESV EKPTG915)。对不同代次进行ORF 1a 序列比对:55代之前序列未发生变化,之后出现个别位点的变化,在第62 代开始出现30 bp 碱基全部缺失(图2)。

图2 不同代次ORF 1a 序列变化情况Fig.1 Gene sequence of ORF 1a in different passage
3 讨论
IB 弱毒苗是由IBV 分离株在鸡胚连续传代获得的,H120、MA5 和2886 等多种IB 弱毒活疫苗用于该病的免疫预防,但这种由强毒变为弱毒的致弱机理目前尚未明确。本研究中致病性试验结果表明:P100 主要在SPF 鸡气管和法氏囊组织内复制,在肺脏、腺胃和脾脏内增殖时间较短,在肾脏、肝脏和心脏组织内不能够增殖。与SDZB0808 株相比,P100 在SPF 鸡体内的组织分布较少,特别是其失去了在鸡肾脏组织内的复制能力,这可能是导致IBV毒力下降的主要因素之一。
Phillips 等对多株IBV 与其致弱后病毒基因组进行序列比对分析,结果显示37.08 %~43.66 %的氨基酸替换发生在病毒基因组5' 端非结构蛋白nsp3上,并且这一区域还有8~10 个氨基酸缺失,因此认为IBV 非结构蛋白nsp3 的氨基酸变化与病毒致弱有关[8]。在本研究中,P100 与其亲本强毒株SDZB 0808 相比在基因组3 244~3 273 位缺失30 个核苷酸,导致其ORF 1a 缺失10 个氨基酸(906VKESVEK PTG915),缺失位点也位于nsp3 蛋白上。此外,P100在第9 664 位的碱基突变导致ORF 1a I3047L 氨基酸替换。由于ORF 1a 编码的多聚蛋白可以水解成多个功能性蛋白,参与IBV 的复制,其氨基酸的突变或缺失可能影响IBV 在宿主细胞内的复制。
在3'端结构蛋白和非结构蛋白基因中,P100 与SDZB0808 在S 蛋白(N76Y)和E 蛋白(L29I)发生了氨基酸替换。S 蛋白与IBV 的组织嗜性密切相关[9],E蛋白与M 蛋白协同作用,在病毒装配和出芽中发挥重要作用[10-11],因此这两个蛋白的氨基酸序列变化也可能与病毒的致弱有关。Wang 等对某病毒株及其致弱株的3' 端7.3 kb 基因进行测序显示:S1 蛋白、S2 蛋白和M 蛋白的氨基酸序列出现变化,而N 蛋白部分未发生变化[12];Geerligs 对某病毒株及其致弱株的S1 蛋白高变区进行测序,结果显示,1 424 个核苷酸中有4 个位点发生变化,2 个氨基酸发生突变[13]。本研究发生的氨基酸残基变异位点与之前研究均不一致,推测病毒株致弱可能是多途径的,不同病毒株的致弱过程并不一样。
本研究结果表明QX 基因型IBV 分离株SDZB0808 毒力致弱与其基因组多个位点的基因突变和缺失有关,对这些关键位点进行功能验证对于阐明IBV 的致病机制和疫苗研发均具有重要的理论指导意义。
[1]陈玲凤,韩宗玺,邵昱昊,等.鸡传染性支气管炎株的基因组特性研究[J].中国预防兽医学报,2014,36(11):838-841.
[2]Masters P S.The molecular biology of coronaviruses[J].Adv Virus Res,2006,66:193-292.
[3]Han Zong-xi,Sun Chu-yang,Yan Bao-long,et al.A 15-year analysis of molecular epidemiology of avian infectious bronchitis virus coronavirus in China[J].Infect Genet Evol,2011,11(1):190-200.
[4]胡北侠,杨少华,许传田,等.2008~2012 山东省鸡传染性支气管炎病毒遗传演化分析和致病性研究[J].畜牧兽医学报,2014,45(5):795-801.
[5]Sun Chu-yang,Han Zong-xi,Ma Hui-jie,et al.Phylogenetic analysis of infectious bronchitis coronaviruses newly isolated in China,and pathogenicity and evalution of protection induced by Massachusetts serotype H120 vaccine against QX-like strains[J].Avian Pathol,2011,40(1):45-54.
[6]Lim T H,Kim M S,Jang J H,et al.Live attenuated nephropathogenic infectious bronchitis virus vaccine provides broad cross protection against new variant strains[J].Poult Sci,2012,91(1):89-94.
[7]胡北侠.山东地区鸡传染性支气管炎病毒遗传进化、致病性和抗原变异性分析[D].成都:四川农业大学,2014.
[8]Phillips J E,Jackwood M W,McKinley E T,et al.Changes in nonstructural protein 3 are associated with attenuation in avian coronavirus infectious bronchitis virus[J].Virus Genes,2012,44(1):63-74.
[9]Casais R,Dove B,Cavanagh D,et al.Recombinant avian infectious bronchitis virus expressing heterologous spike gene demonstrate that the spike protein is a determinant of cell tropism[J].J Virol,2003,16(77):9084-9089.
[10]Corse E,Machamer C E.The cytoplasmic tails of infectious bronchitis virus E and M proteins mediate their interaction[J].Virology,2003,312(1):25-34.
[11]Corse E,Machamer C E.Infectious bronchitis virus E protein is targeted to the Golgi complex and derects release of virus-like particles[J].J Virol,2000,74(9):19-26.
[12]Wang Yu-dong,Wang Yong-ling,Zhang Zi-chun,et al.Isolation and identification of glandular stomach type IBV(QX-IBV)in chickens[J].Chinese J Anim Quarantine,1998,15:419-422.
[13]Geerligs H J.Efficacy and safety of an attenuated live QX-like infectious bronchitis virus strain as a vaccine for chickens[J].Avian Pathol,2011,40(1):93-102

