结核分枝杆菌rv0394c基因在耻垢分枝杆菌中的表达及其粘附特性的鉴定
李华芳,曹 俊,刘松艳,陈利苹,刘思国
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物细菌病研究室,黑龙江 哈尔滨 150001)
结核病是由结核分枝杆菌复合群引起的各种疾病的总称。结核分枝杆菌复合群包括人结核分枝杆菌(Mycobacterium tuberculosis,MT)、牛分枝杆菌(Mycobacterium bovis,MB)、非洲分枝杆菌(Mycobacterium african,MA)和其他的分枝杆菌[1]。结核病为一种慢性消耗性人畜共患病,对人类和动物的健康造成严重的威胁。
rv0394c 基因为致病性分枝杆菌核心基因之一,通过生物学信息分析发现该基因存在于MT、MB 和MA 等致病性分枝杆菌中,而在其他非致病性分枝杆菌如耻垢分枝杆菌(Mycobacterium smegmatis,MS)中并不存在。因此提示rv0394c 基因可能与分枝杆菌的致病性相关。通过生物学信息软件分析发现该蛋白含有跨膜区,预测RV0394c 蛋白可能为一种分泌型蛋白。同时相关报道显示该蛋白具有透明质酸酶的活性[2],在细胞间质和肺泡上皮细胞表面存在大量透明质酸,推测透明质酸酶的功能可能与分枝杆菌对上皮细胞的粘附具有一定的关系[3]。为制备具有生物活性和天然状态的RV0394c 蛋白,本研究将rv0394c 基因在同属的MS 中进行表达。并鉴定蛋白以及重组菌对肺泡上皮细胞的粘附特性,证明了RV0394c 蛋白为一种粘附蛋白,为进一步研究RV0394c 蛋白在致病性中的作用提供了实验依据。
1 材料和方法
1.1 菌株、载体及蛋白 结核分枝杆菌H37Rv 菌株购自中国生物制品监察所;人的肺泡上皮细胞(A549)购自ATCC;大肠杆菌-分枝杆菌穿梭表达质粒pMV262 及MS 菌株MC2155 由北京结核研究所黄海荣教授馈赠;大肠杆菌DH5α 感受态菌购自天根生化科技有限公司;大肠杆菌中表达纯化的RV0394c 重组蛋白(rRV0394c)由本实验室制备。
1.2 主要试剂 限制性内切酶及Pfu DNA 聚合酶均购自Fermentas 公司;PCR 产物纯化试剂盒、质粒小提试剂盒、胶回收试剂盒均购自OMEGA 公司;羊抗鼠IgG-FITC 和山羊抗鼠IgG-DyLightTM均购自Sigma 公司;抗His 标签单克隆抗体(MAb)购自Novagen 公司。
1.3 RV0394c蛋白对A549细胞的粘附试验 A549细胞在6 孔板培养12 h 后,弃培养液,PBS 洗3次,加入100 μL rRV0394c(1 μg/μL),37 ℃作用1 h,PBS 洗3 次,洗去未粘附的重组蛋白。以80 %预冷的丙酮固定10 min,PBS 洗3 次,以抗RV0394c MAb(1∶100)为一抗,羊抗鼠IgG-FITC(1∶100)为二抗,同时以来源于分枝杆菌的其他无关蛋白(RV3295)和对应的MAb 作为对照组。在共聚焦显微镜下观察结果。
1.4 重组质粒p262-sec的构建 根据GenBank 中登录的rv0394c 基因序列(NC_000962.3),利用Primer5.0软件设计扩增rv0394c 基因的上下游引物(5'-CTAGG ATCCGACTGAGCCCAGACCTGTCTTC-3'/5'-GCAGA ATTCCTCGACGTGGACGGGTGCG-3'),预扩增片段为680 bp,由哈尔滨博仕生物技术有限公司合成。以H37Rv 基因组DNA 为模板,采用Pfu DNA 聚合酶经PCR 扩增rv0394c 基因。反应体系为50 μL;反应程序为:95 ℃3 min;95 ℃30 s、64 ℃30 s、72 ℃1.0 min,30 个循环;72 ℃10 min。扩增产物经1 %琼脂糖凝胶电泳检测。将扩增的rv0394c 基因经Bam HⅠ和Eco RⅠ双酶切后,克隆于pMV262 质粒中,构建大肠杆菌-分枝杆菌穿梭重组表达质粒p262-sec,并由华大基因科技公司测序鉴定。
1.5 p262-sec/MS重组菌的构建 将鉴定正确的重组质粒电转化入MS 感受态细胞,通过25 μg/mL卡那霉素平板筛选阳性克隆,接种于含终浓度25 μg/mL 卡那霉素的7H9 培养基中培养,然后提取重组质粒,MS 为革兰氏阳性菌,细胞壁较厚,在提取质粒时利用电动研磨器研磨,溶菌酶处理,以便菌体的裂解,其他提取质粒步骤同质粒小提试剂盒。重组质粒用Bam HⅠ和Eco RⅠ进行双酶切鉴定。
1.6 重组蛋白的表达和检测 将鉴定正确的重组菌在含有25 μg/mL 卡那霉素的7H9 培养基37 ℃培养48 h 后,45 ℃热激30 min。集菌超声破碎。离心后分别取上清液和沉淀进行SDS-PAGE 电泳分离,以抗His MAb(1∶2 000)为一抗,IgG-DyLightTM(1∶10 000)为二抗,进行western blot 检测。
1.7 重组菌对A549细胞的粘附和粘附阻断试验按常规方法培养重组菌p262/MS 和p262-sec/MS,培养至OD600nm值为0.6。经稀释后分别以感染复数为10 的接种剂量加入到A549 细胞单层中(在粘附阻断实验中细胞与rRV0394c 蛋白在37 ℃预作用20 min)。于37 ℃,5 % CO2,作用6 h 后,洗涤3 次,洗去未粘附的菌体,利用细胞刮刀收集细胞,反复吹打充分分散细胞,稀释后涂板,进行菌落计数。
2 结果
2.1 rRV0394c蛋白对A549细胞的粘附特性鉴定rRV0394c 蛋白与A549 细胞在37 ℃作用1 h 后,以抗RV0394c MAb 为一抗,羊抗鼠IgG-FITC 为二抗,实验组在激光共聚焦显微镜下显示明显的绿色荧光,而对照组无绿色荧光(图1),表明rRV0394c 蛋白可以与A549 细胞发生特异性粘附。

图1 rRV0394c 蛋白对A549 细胞的粘附Fig.1 Adhesion of rRV0394c to A549 cells
2.2 重组质粒p262-sec的构建及鉴定 利用PCR技术,以结核分枝杆菌强毒株H37Rv 基因组DNA为模板扩增rv0394c 基因,结果显示目的基因大约为700 bp,与预期相符(图2)。rv0394c 基因通过酶切处理后克隆至pMV262 载体,构建重组质粒p262-sec,经由华大基因测序鉴定插入片段为680 bp,与预期结果一致。

图2 rv0394c 基因的PCR 结果Fig.2 Amplification of rv0394c gene by PCR
2.3 p262-sec/MS重组菌的检测 将鉴定正确的重组质粒p262-sec 电转化入MS,在MS 中提取重组质粒,双酶切鉴定,结果可获得约680 bp 的目的片段,与预期结果一致。挑取鉴定正确的单克隆重组菌,利用抗His 标签的MAb 检测重组菌中蛋白的表达情况,结果如图3 所示,重组菌的裂解上清液可检测到目的蛋白,大小约25 ku,目的蛋白呈可溶性表达。

图3 重组菌蛋白表达的western blot 检测Fig.3 Detection of the protein expression by western blot
2.4 重组菌对A549细胞的特异性粘附和粘附阻断试验结果 将重组菌p262/MS 和p262-sec/MS 分别与A549 细胞感作后,收集细胞涂板后计数。结果显示含有外源目的基的重组菌(p262-sec/MS)粘附特性与空载体(p262/MS)相比具有显著性差异,并且这种粘附特性可被rRV0394c 蛋白阻断(图4),表明重组菌p262-sec/MS 可以特异性粘附于A549 细胞表面。
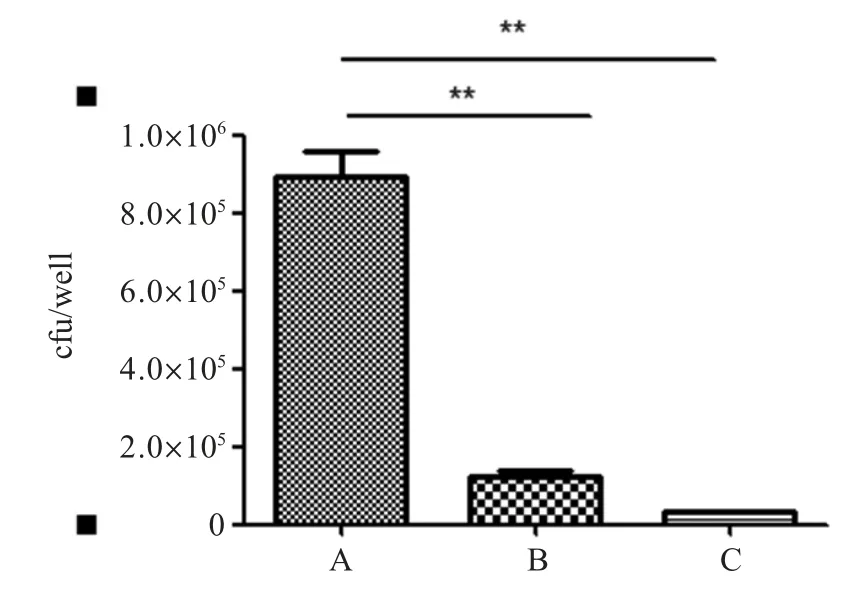
图4 重组菌的粘附和粘附阻断Fig.4 Adhesion and adhesion inhibition of recombinant bacteria
3 讨论
目前结核病仍是危害人类和动物的重大传染病之一,尤其是近年来随着多重耐药分枝杆菌的出现以及与病毒的混合感染,使得对结核病的治疗变得困难[4-6]。因此,研究结核病的致病机理,研发新型高效的结核病疫苗就显得尤为重要。
本实验应用分枝杆菌表达系统—MS,它属于快生长型分枝杆菌,生长周期相对较短,培养简单,并且与结核分枝杆菌在进化上有相近亲缘关系,采用该系统表达结核分枝杆菌的蛋白更容易获得具有天然构象的、有生物功能活性的目的蛋白。因此这一表达系统的成功构建为后续研究其他相关基因蛋白的表达奠定了基础。
目前为止,本实验室前期研究证明RV0394c 蛋白为一种具有透明质酸酶活性的蛋白[2],通过生物学信息分析发现表达该蛋白的基因仅存在于致病性的分枝杆菌中,推测该基因可能与分枝杆菌的致病性相关[7-10],因此本实验利用大肠杆菌表达的RV0394c重组蛋白,以A549 细胞为细胞模型进行了粘附试验,结果显示该蛋白可能参与了结核分枝杆菌对A549 细胞的粘附过程。为进一步验证这一试验结果,将该基因转入非致病性的MS 中,构建可以表达天然构像的RV0394c 蛋白的重组菌。将重组菌与A549 细胞进行粘附和粘附阻断,实验结果表明引入rv0394c 基因的重组菌与对照组相比,对A549 细胞粘附作用显著提高。这一结果证明该蛋白参与了结核分枝杆菌对肺泡上皮细胞的粘附过程,是结核分枝杆菌新发现的粘附蛋白,为进一步研究RV0394c蛋白在结核分枝杆菌致病性中的作用提供了依据。
[1]张秀华,刘思国,沈国顺,等.畜牧与兽医[J].2005,37(2):57-60.
[2]Yuan Xiang-lian,Chen Li-ping,Deng Xiao-xia,et al.Characterization of rv0394c gene encoding hyaluronidase and chondrosul-fatase from Mycobacterium tuberculosis[J].Tuberculosis,2013,93(3):296-300.
[3]Aoki K,Matsumoto S,Hirayama Y,et al.Extracellular mycobacterial DNA-binding protein 1 participates in mycobacterium-lung epithelial cell interaction through hyaluronic acid[J].Biol Chem,2004,279:39798-39806.
[4]Green K D,Garneau-Tsodikova S.Resistance in tuberculosis:What do we know and where can we go?[J].Frontiers Microbiol,2013,4:208.
[5]Gobin J,Horwitz M A.Exochelins of Mycobacterium tuberculosis remove iron from human iron-binding proteins and donate iron to mycobactins in the M.tuberculosis cell wall[J].Exp Med,1996,183:1527-1532.
[6]Pethe K,Alonso S,Biet F,et al.The heparin-binding haemagglutinin of M.tuberculosis is required for extrapulmonary dissemination[J].Nature,2001,412:190-194.
[7]Kreil G.Hyaluronidases e a group of neglected enzymes[J].Protein Sci,1995,4:1666-1669.
[8]Berry A M,Lock R A,Thomas S M,et al.Cloning and nucleotide sequence of the Streptococcus pneumoniae hyaluronidase gene and purification of the enzyme from recombinant Escherichia coli[J].Infect Immun,1994,62:1101-1108.
[9]Seddon S V,Hemingway I,Borriello S P.Hydrolytic enzyme production by Clostridium difficile and its relationship to toxin production and virulence in the hamster model[J].Med Microbiol,1990,31:169-174.
[10]Polissi A,Pontiggia A,Feger G,et al.Large-scale identification of virulence genes from Streptococcus pneumoniae[J].Infect Immune,1998,66:5620-5629.

