复发性外阴阴道念珠菌病的阴道微生态特征分析
范娟沈健蒋建华刘延(.上海浦东新区公利医院皮肤科,上海0035;.上海交通大学附属瑞金医院妇产科,上海0005)
复发性外阴阴道念珠菌病的阴道微生态特征分析
范娟1沈健2蒋建华1刘延2
(1.上海浦东新区公利医院皮肤科,上海200135;2.上海交通大学附属瑞金医院妇产科,上海200025)
【摘要】目的 拟从阴道菌群的微生态特征入手,旨在探讨阴道微生物群落结构与外阴阴道念珠菌病(Vulvovaginal Can⁃didiasis,VVC)发病的潜在联系。方法 2013年1月~2014年12月,126名处于VVC急性发作且以往有RVVC史的非孕育龄妇女作为研究对象,另有120名正常育龄期体检女性作为对照组。测定阴道pH值,并采集阴道分泌物行革兰染色镜检,行Nugent评分。同时,通过阴道菌群密集度、菌群多样性、优势菌等指标对阴道微生态进行评价。结果 患者组的阴道pH值(4.51±0.3 Vs 4.11±0.2,P<0.05)和Nugent评分(4.21±0.81 Vs 1.31±1.19,P<0.05)显著高于对照组。患者组乳酸杆菌密集度显著低于对照组,而阴道加特纳菌/普雷沃菌、革兰阳性球菌和其他细菌的密集度显著高于对照组(P<0.05)。同时,患者组菌群多样性显著高于正常组;且患者组乳酸杆菌优势比例显著低于对照组(55.56%Vs 95.00%,P<0.05),而阴道加特纳菌/普雷沃菌(23.02%Vs 1.67%,P<0.05)和革兰阳性球菌优势比例显著高于对照组(17.46%Vs 1.67%,P<0.05)。结论RVVC患者阴道微生态特征与正常育龄妇女存在显著差异,生物屏障的削弱可能是VVC反复发作的风险因素。新型阴道乳酸菌制剂的研发和应用可能在重建阴道微生态,预防VVC复发方面获得突破。
【关键词】复发性外阴阴道念珠菌病(RVVC);阴道微生态;乳酸杆菌;阴道加特纳菌/普雷沃菌
[Chin J Mycol,2015,10(4):210⁃215]
外阴阴道念珠菌病(Vulvovaginal Candidiasis,VVC)是妇科常见病多发病,其中将近50%患者在治疗后会经历复发[1],另有将近8%妇女会一年以内复发4次或更多被称为复发性外阴阴道念珠菌病(Recurrent Vulvovaginal Candidiasis,RVVC)[2]。RVVC很难根除,严重影响患者生活质量,成为临床工作中的难点。近年,随着阴道微生态的研究逐年深入,阴道菌群在女性生殖道感染性疾病发生发展中所起的作用也日益得到关注。目前阴道菌群关于VVC的相关研究仍存在一定争议,本研究拟从阴道菌群的微生态特征入手,旨在探讨阴道微生物群落结构与RVVC发病的潜在联系。
1 资料与方法
1.1研究对象
对于2013年1月~2014年12月间作者所在医院进行治疗的126例患者作为研究对象,入选患者均为正处于VVC急性发作且以往有RVVC史的非孕育龄妇女,且符合如下诊断标准:①外阴瘙痒,部分有灼痛感、尿频、尿痛,白带为白色稠厚豆渣样。②妇科检查可见小阴唇内侧及阴道黏膜上有白色膜状物,擦除后露出红肿的黏膜面,急性期可见糜烂面及浅表溃疡。③白带涂片找到假菌丝或酵母菌。④1 a以内发病4次或以上。⑤曾接受过抗真菌治疗,就诊前仍查菌阳性。⑥就诊前半个月未使用过其他抗真菌药[1]。排除标准:①伴滴虫性阴道炎或细菌性阴道病的混合感染者。②同时使用大量糖皮质激素和抗生素者。③未继续治疗、未定期复诊者。④糖尿病、HIV感染及其他免疫系统疾病患者。另有120名正常育龄期体检女性作为对照组。
本临床观察经医院伦理委员会批准,所有对象均自愿参加,并签署知情同意书,并保证观察期间膳食结构与生活方式不变。按统一标准问卷,每位入选者均填写年龄、月经周期、症状、发作天数及阴道炎史等情况。
1.2检查方法
阴道pH值测定 将精密pH试纸(pH3.8~5.4)直接浸入阴道分泌物中0.5 s,依据标准色板读取pH值。
阴道分泌物采集及Nugent革兰染色评分 于阴道侧壁中上1/3处,采用无菌棉拭子提取阴道分泌物,取阴道分泌物在洁净载玻片上制成涂片,固定后革兰染色,干燥后在10×100倍油镜下检查,区分以下形态的细菌:革兰阳性大杆菌(乳酸杆菌)、革兰染色不定小杆菌(阴道加特纳菌)、革兰阴性小杆菌(拟杆菌)、革兰染色不定弯曲杆菌(动弯杆菌)和革兰阳性球菌、梭状杆菌及革兰阴性杆菌。根据每个油镜视野细菌数量,分别用0~4分表示(0分:未见细菌;1分:<1/×1 000;2分:1~4/×1 000;3分:5~30/×1 000;4分:>30/×1 000)。根据Nugent革兰染色评分系统把所得结果换算成积分,再按公式(总积分=乳杆菌+阴道加特纳菌和拟杆菌+染色不定弯曲小杆菌)计算总积分[3],见表1。

表1 油镜下细菌数量与Nugent革兰染色评分对照表[3]Tab.1 The Nugent Gram stain scoring system
阴道微生态评价 本研究主要通过阴道菌群密集度、菌群多样性、优势菌等指标对阴道微生态进行评价[4]。
菌群密集度评价 主要根据10×100倍油镜下,标本中细菌分布排列的密集程度,反映该微生态区域中菌群生物总量的多少,评分标准如下:Ⅰ级(记为“+”):1~9个/×1 000;Ⅱ级(记为“++”):10~99个/×1 000;Ⅲ级(记为“+++”):100个以上(细菌满视野)/×1 000;Ⅳ级(记为“++++”):细菌聚集成团、或密集覆盖黏膜上皮细胞/× 1 000。
菌群多样性及优势菌判定 主要根据10×100倍油镜下,标本中可辨认的细菌形态种类计算菌群多样性,反映菌群中细菌种类的多少,并判断优势菌。评分标准如下:Ⅰ级(记为“+”):能辨别1~3种细菌;Ⅱ级(记为“++”):能辨别4~6种细菌;Ⅲ级(记为“+++”):能辨别7~10种细菌;Ⅳ级(记为“++++”):能辨别11种以上细菌。
统计学方法 本研究资料采用SPSS 17.0版统计分析软件包进行分析。计量资料以()表示,2组数据之间比较采用单因素方差分析,方差齐时采用LSD法,方差不齐采用Games⁃Howell法进行比较,计数资料比较采用x2检验,等级资料比较采用Ridit分析,P<0.05有统计学意义。
2 结 果
2.1一般情况
最终进入研究者共246例,年龄19~47岁,平均34.2±6.1岁;孕次0~6次,平均2.9±0.8次;产次0~3次,平均1.7±0.3次;体重49.1~82.1 kg,平均57.61±8.7 kg,体重指数(BMI)17.9~33.3 kg/m2,平均23.2±2.9 kg/m2,二组间一般资料差异无统计学意义(见表1,P>0.05),具有可比性(见表2)。

表2 患者组与对照组一般情况比较Tab.2 Baseline characteristics of two groups
2.2患者组和对照组患者阴道pH值和Nugent革兰染色评分比较
由表3所示,患者组的阴道pH值为4.51±0.3,而对照组为4.11±0.2,患者组的阴道pH值高于对照组,两组间差异具有统计学意义(P<0.05)。患者组Nugent革兰染色评分为4.21±0.81,而对照组为1.31±1.19,患者组Nugent革兰染色评分高于对照组,两组间差异具有统计学意义(P<0.05)。
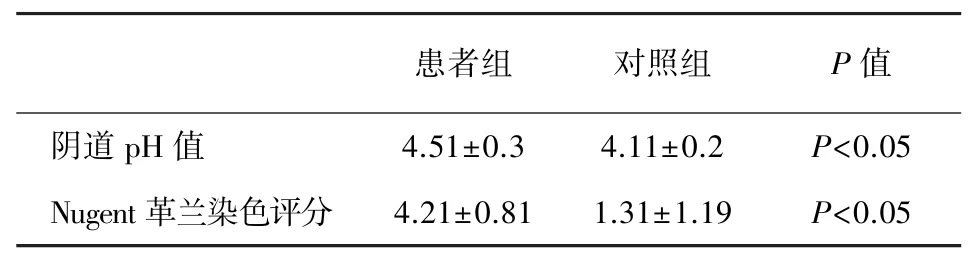
表3 患者组和对照组患者阴道pH值和Nugent革兰染色评分比较Tab.3 Comparison of vaginal pH and Gram stain score between two groups
2.3RVV患者的阴道微生态特征
菌群密集度(见表4) 乳酸杆菌密集度 患者组偶见或缺失乳酸杆菌,集中于Ⅰ~Ⅱ级,正常组Ⅱ~Ⅲ级者占94.17%(113/120)。患者组乳酸杆菌密集度0级的比率高于正常组,Ⅱ级、Ⅲ级的比率与正常组比较,差异均有统计学意义(P<0. 05)。二组间乳酸杆菌密集度进行Ridit分析,差异有统计学意义(P<0.05)。二组间乳酸杆菌总阳性率无显著性差异。

表4 患者组和正常组阴道菌群密集度比较,n(%)Tab.4 Comparison of vaginal flora density between two groups,n(%)
阴道加特纳菌/普雷沃菌密集度 患者组Ⅲ级者占84.92%(107/126),正常组以0~Ⅰ级为主,占86.67%(104/120)。二组间阴道加德纳菌/普雷沃菌密集度进行Ridit分析,差异有统计学意义(P<0.05)。患者组间阴道加特纳菌/普雷沃菌总阳性率显著高于对照组(P<0.05)。
动弯杆菌密集度 二组间阴道动弯杆菌密集度进行Ridit分析,差异无统计学意义(P>0.05)。
革兰阳性球菌密集度 二组间革兰阳性球菌密集度进行Ridit分析,差异有统计学意义(P<0.05),其中患者组Ⅰ级、Ⅱ级比率与正常组比较,差异均有统计学意义(P<0.05)。患者组间革兰阳性球菌总阳性率显著高于对照组(P<0.05)。
其他细菌密集度 二组间其他细菌密集度进行Ridit分析,差异有统计学意义(P<0.05),其中患者组Ⅰ级、Ⅱ级比率与正常组比较,差异均有统计学意义(P<0.05)。患者组间其他细菌总阳性率显著高于对照组(P<0.05)。
菌群多样性 如表5所见,患者组菌群多样性以Ⅰ~Ⅱ级为主,偶见Ⅲ~Ⅳ级;而正常组菌群多样性主要集中于Ⅰ级,偶见Ⅱ级。患者组菌群多样性Ⅱ级的比率高于正常组,差异有统计学意义(P<0.05)。二组间菌群多样性进行Ridit分析,差异有统计学意义(P<0.05)。
优势菌 如表6所见,对照组组以乳酸杆菌占优势者为95.00%(114/120),与患者组55.56%(70/126)比较,差异有统计学意义(P<0.05)。患者组阴道加特纳菌/普雷沃菌占优势者为23.02%(29/120),革兰阳性球菌占优势者为17.46%(22/120),与正常组比较,差异有统计学意义(P<0.05)。
3 讨 论
3.1 阴道微生态特性与RVVC
本研究发现,RVVC患者阴道微生态特性与正常育龄女性存在显著差异,且Nugent革兰染色评分显著高于对照组。在正常育龄女性,阴道微生物群落呈现出显著特征:即乳酸杆菌占绝对优势,并形成阴道pH<4.5的环境。而在RVVC患者中,阴道群落特性无法形成集中的共性,既有乳酸杆菌优势的群落(55.56%);又有23.02%类似细菌性阴道病的群落(即乳酸杆菌失去优势,阴道加特纳菌/普雷沃菌居优势)存在,还有17.46%的群落为革兰阳性球菌占优势,另3.97%为其他细菌占据群落优势。阴道加德纳菌最早为Gardner在细菌性阴道病研究中所报道,在95%的细菌性阴道病患者阴道中可发现其定植[5⁃6]。加德纳菌能够合成释放阴道溶解素造成阴道上皮细胞的裂解和死亡,还分泌合成唾液酸酶(sialidase)和脯氨酰氨基酸二肽酶(prolidase),造成阴道上皮的剥落与脱离[7⁃9]。同时,加德纳菌在阴道表面可形成致密生物膜样结构,大量微生物包埋于细胞外基质中,对抗生素和宿主免疫防御机制的抵抗性也明显提高[10]。由于无法有效消除生物膜内的病原微生物,感染由此趋向于反复发作,难以治愈。此外,我们的研究发现相当部分阴道微生物群落优势菌为革兰阳性球菌,后者是需氧菌性阴道炎(Aero⁃bic Vaginitis,AV)的主要致病菌[11]。当阴道内革兰阳性球菌过度生长,替代乳酸杆菌形成优势群落后,阴道pH升高,极易造成白念珠菌在内的其他病原微生物混合感染[12⁃13]。
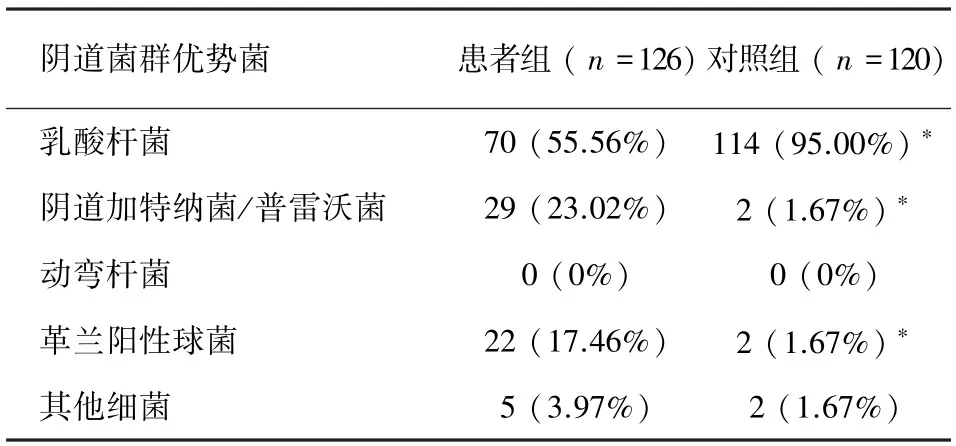
表5 患者组和正常组阴道菌群菌群多样性比较,n(%)Tab.5 Comparison of vaginal flora diverse between two groups
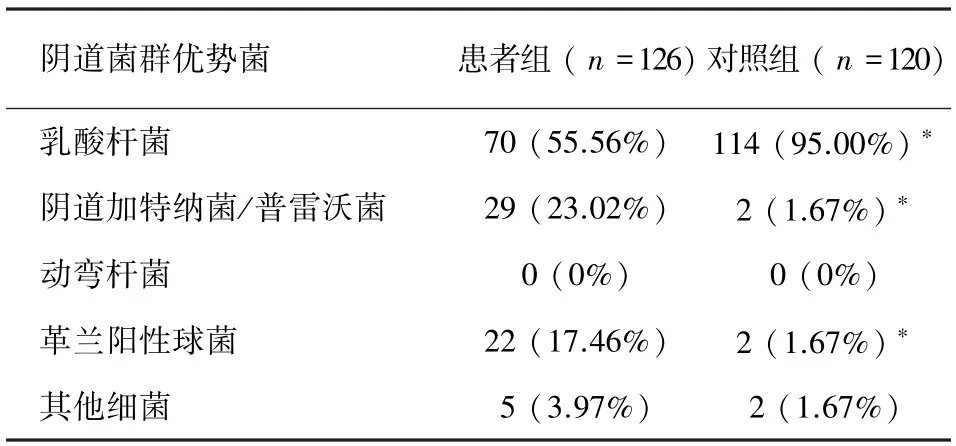
表6 患者组和正常组阴道菌群菌群优势菌比较,n(%)Tab.6 Comparison of vaginal predominant population between two groups
生态学研究提示,群落组成结构(各个物种的种群数量)在阴道微生物群落稳定方面起到至关重要的作用[14⁃15]。Walker等[16]研究提出,正常育龄女性阴道群落结构和功能类似于一种“司机⁃乘客模式”,一个正常阴道群落类似一辆满载乘客的公交车,其中占生物优势地位的乳酸杆菌决定着群落的整体结构和功能,把握着阴道微生态系统的状态与走向,承担“司机”的作用;而密集度相对较少但种类多样的其他物种则处于相对被动地位,随着主导物种的动态变化,从属物种的密集度和多样性也相应转化,这类似上下车的“乘客”。稳定而健康阴道菌群能够抵御各种外来的干扰事件或物种入侵,成为维持宿主健康的一种保护性机制。在本研究中,RVVC患者阴道微生物的物种多样性显著高于正常育龄妇女,在相当部分的群落中,乳酸杆菌优势消失,“司机⁃乘客模式”被打破,或者由非乳酸杆菌承担“司机”的作用,阴道微生态系统的状态处于非生理状态。在特定条件下,阴道微生物群落极易出现崩溃,失去了生物屏障的机体将直接面临外来病原微生物或各种条件致病菌的定植,产生感染[17]。
3.2乳酸杆菌对妇女阴道健康的微生态保护作用
1892年Albert Döderlein首次通过培养方法在阴道内分离出乳酸杆菌,生理条件下定植于正常女性阴道内的乳酸杆菌主要有4种:Lactobacillus in⁃ers、Lactobacillus crispatus、Lactobacillus gasseri和Lactobacillus jensenii[18]。经过多年的研究发现这种棒状革兰阳性杆菌通过多种不同的机制对维持女性生殖道健康起到重要作用。阴道内占优势数量的乳酸杆菌通过化学效应(分泌乳酸、H2O2)、生物拮抗效应和免疫调节所作用起到生物屏障的保护作用[19]。
首先,乳酸杆菌利用阴道上皮脱落后释放的糖原进行糖酵解功能,酵解过程中产生的大量乳酸积聚,使阴道处于pH<4.5的酸性微环境,抑制外来病原微生物的定植。而乳酸分子本身也可作为一种抗微生物成分,对宿主起到直接的保护作用[17]。除了乳酸以外,研究表明乳酸杆菌还能分泌其他另一些抗菌成分,诸如特异性细菌素和H2O2等。但是,有研究者认为阴道内氧含量很低,H2O2很难合成积累至杀菌的有效浓度,因此作用非常有限[20]。其次,近期的研究发现,阴道内乳酸的积聚可以选择性地促进外周IL⁃23合成,进而刺激Th17淋巴细胞激活通路,抑制革兰阴性细菌入侵[21]。Fi⁃chorova等[22]报道弯曲乳酸杆菌(Lactobacillus crispatus)细菌本身能够参与调节阴道上皮细胞的先天性免疫功能,抑制炎症反应的发生,减少对细胞的损伤。除了合成、分泌具有抗菌作用的活性分子、调节免疫之外,乳酸杆菌还能在局部大量地富集,形成物种优势群落,形成生物膜样的集落,构成了一道生物屏障[23]。微生态学研究表明,微生物只有形成富集生长的集落,才可能最大限度地发挥生物拮抗效应,通过整体的生物拮抗作用抵御外源性微生物的入侵,维持阴道局部微环境的相对稳定[24⁃25]。本研究显示,乳酸杆菌广泛且大量存在于对照组妇女阴道内,形成优势种群,局部乳酸杆菌的大量聚集且彼此功能相近,形成一种功能性冗余(functional redundancy),这对于维持整个群落的稳定性起到至关重要的作用,同时也对宿主念珠菌入侵和过度生长起到有益的生物缓冲作用[26]。而在本研究RVVC患者的阴道群落中,有将近50%失去了乳酸菌的优势生物地位,阴道pH为4.51±0.3,显著高于对照组,生物屏障和拮抗作用受到抑制,从而导致了VVC的反复发作。
目前治疗复发性外阴阴道念珠菌病一般采用巩固性抗真菌治疗,但无论是局部或全身用药,复发率一直较高。因此人们一直在寻找一种有效而副作用少的药物。自20世纪90年代以来就有很多学者研究乳酸杆菌制剂治疗VVC的疗效,但是相关的临床研究结果一直以来存在着种种争议。但就目前取得的临床结局,可以获得共识的是,乳酸杆菌无法直接治疗VVC,但可恢复乳酸杆菌优势的阴道菌群,防止VVC的复发。目前已用于Ⅰ期临床的乳杆菌制剂品种较多,但专用于女性生殖道的种类较少。阴道专用的乳酸杆菌应该符合以下条件:能够很好地黏附于阴道上皮细胞;能够在阴道定居并繁殖,使阴道内形成正常、平衡的菌群;各种制剂中要含有足量的活菌,以保证每日的最低摄入量[27⁃28]。目前国内、外用于临床的,Lac⁃tobacillus rhamnosus GR⁃1、Lactobacillus fermentum RC⁃14和定君生阴道用乳杆菌活性胶囊(德氏乳杆菌),值得关注的是上述3种益生菌株均不属于阴道定植的4种主要乳酸杆菌,因此能否长期定植仍有争议。对于乳杆菌制剂治疗RVVC的疗效方面还存在较多疑问,尚需要更多基础和临床研究来证明。
参考文献
[1] Sobel JD,Faro S,Force RW,et al.Vulvovaginal candidiasis:epi⁃demiologic,diagnostic,and therapeutic considerations[J].Am J Obstet Gynecol,1998,178(2):203⁃211.
[2] Spinillo A,Pizzoli G,Colonna L,et al.Epidemiologic characteris⁃tics of women with idiopathic recurrent vulvovaginal candidiasis [J].Obstet Gynecol,1993,81(5(Pt 1)):721⁃727.
[3] Nugent RP,Krohn MA,Hillier SL.Reliability of diagnosing bac⁃terial vaginosis is improved by a standardized method of gram stain interpretation[J].J Clin Microbiol,1991,29(2):297⁃301.
[4] 曾忠铭,潘令嘉,周殿元,等.临床微生态学及其理论基础[J].中国微生态学杂志,1999,11(6):321⁃331.
[5] Patterson JL,Stull⁃Lane A,Girerd PH,et al.Analysis of adher⁃ence,biofilm formation and cytotoxicity suggests a greater viru⁃lence potential of Gardnerella vaginalis relative to other bacterial⁃vaginosis⁃associated anaerobes[J].Microbiology,2010,156(Pt 2):392⁃399.
[6] Muzny CA,Schwebke JR.Gardnerella vaginalis:Still a Prime Suspect in the Pathogenesis of Bacterial Vaginosis[J].Curr In⁃fect Disease Reports,2013,15(2):130⁃135.
[7] Gelber SE,Aguilar JL,Lewis KL,et al.Functional and phyloge⁃netic characterization of Vaginolysin,the human⁃specific cytoly⁃sin from Gardnerella vaginalis[J].J Bacteriol,2008,190(11):3896⁃3903.
[8] Rottini G,Dobrina A,Forgiarini O,et al.Identification and partial characterization of a cytolytic toxin produced by Gardnerella vag⁃inalis[J].Infect Immun,1990,58(11):3751⁃3758.
[9] Cauci S,Driussi S,Guaschino S,et al.Correlation of local inter⁃leukin⁃1beta levels with specific IgA response against Gardnerel⁃la vaginalis cytolysin in women with bacterial vaginosis[J].Am J Reprod Immunol,2002,47(5):257⁃264.
[10] Swidsinski A,Mendling W,Loening⁃Baucke V.Adherent bio⁃films in bacterial vaginosis[J].Obstet Gynecol,2005,106(5 Pt 1):1013⁃1023.
[11] Donder GG,Vereecken A,Bosmans E,et al.Definition of a type of abnormal vaginal flora that is distinctfrom bacterial vaginosis:aerobic vaginitis[J].BJOG,2002,109(1):34⁃43.
[12] Fan A,Xue F.Clinical characteristics of aerobic vaginitis and its mixed infections[J].Zhonghua fu chan ke za zhi,2010,45 (12):904⁃908.
[13] Mahira J,Mirsada M,Jasmina N,et al.Clinical Characteristics of Aerobic Vaginitis and Its Association to Vaginal Candidiasis,Trichomonas Vaginitis and Bacterial Vaginosis[J].Med Arh,2013,67(6):428⁃430.
[14] White PS,Jentsch A.The search for generality in studies of dis⁃ turbance and ecosystem dynamics[J].Prog Botany,2001,62:399⁃450.
[15] Hobbs RJ,Huenneke LF.Disturbance,diversity,and invasion:implications for conservation[J].Conservation Biol,1992,6:324⁃337.
[16] Walker B.Conserving biological diversity through ecosystem re⁃silience[J].Conservation Biol,1995,9:747⁃752.
[17] Hickey RJ,Zhou X,Pierson JD,et al.Understanding vaginal mi⁃crobiome complexity from an ecological perspective[J].Transl Res,2012,160(4):267⁃282.
[18] Ravel J,Gajer P,Abdo Z,et al.Vaginal microbiome of reproduc⁃tive⁃age women[J].PNAS,2011,108(Suppl 1):4680⁃4687.
[19] Zhou X,Brown CJ,Abdo Z,et al.Differences in the composition of vaginal microbial communities found in healthy Caucasian and black women[J].ISME J,2007,1(2):121⁃133.
[20] Linhares IM,Summers PR,Larsen B,et al.Contemporary per⁃spectives on vaginal pH and lactobacilli[J].Am J Obstet Gyne⁃col,2011,204(2):120.e1⁃5.
[21] Witkin SS,Alvi S,Bongiovanni AM,et al.Lactic acid stimulates interleukin⁃23 production by peripheral blood mononuclear cells exposed to bacterial lipopolysaccharide[J].FEMS Immunol Med Microbiol,2011,61(2):153⁃158.
[22] Fichorova RN,Onderdonk AB,Yamamoto H,et al.Maternal mi⁃crobe⁃specific modulation of inflammatory response in extremely low⁃gestational⁃age newborns[J].MBio,2011,2(1):e00280⁃10.
[23] Huggins GR,Preti G.Volatile constituents of human vaginal se⁃cretions[J].Am J Obstet Gynecol,1976,126:129⁃136.
[24] Cordero OX,Wildschutte H,Kirkup B,et al.Ecological popula⁃tions of bacteria act as socially cohesive units of antibiotic pro⁃duction and resistance[J].Science,2012,337(6099):1228⁃1231.
[25] Morlon H.Microbiology.Microbial cooperative warfare[J].Sci⁃ence,2012,337(6099):1184⁃1185.
[26] McCann KS.The diversity⁃stability debate[J].Nature,2000,405 (6783):228⁃233.
[27] Reid G,Beuerman D,Hdnemann C.Probiotic Lactobacillus dose required to restore and maintain a normal vaginal flora[J].FEMS lmmunol Med Microbioly,2001,(32):37⁃41.
[28] Reid G,Bruce AW.Selection of lactobacillus strains for urogeni⁃tal probiotic applications[J].Infect Dis,2001,183(Supp1 1):s77⁃80.
[本文编辑] 卫凤莲
·论著·
The vaginal bacteria and micro⁃ecology features in women with recurrent vulvovaginal candidiasis
FAN Juan1,SHEN Jian2,JIANG Jian⁃hua1,LIU Yan2
(1.Department of Dermatology,Gongli hospital,Second Military Medical University,Shanghai 200135;2.Department of Gynaecology and Obstetrics,Shanghai Ruijin Hosipital affiliated Shanghai Jiaotong University School of Medicine,Shanghai 200025)
【Abstract】Objective To investigate the vaginal microecology features in women with recurrent vulvovaginal candidiasis(RV⁃VC)and its etiological role.Methods From January 2013 to December 2014,126 cases suffering with RVVC were studied,whereas 120 healthy reproductive⁃age women were enrolled as control.The secretions were examined by Gram stain grouped and Nugent sco⁃ring system,as well as the vaginal pH was determined simultaneously.In addition,vaginal bacteria and micro⁃ecology features(such as vaginal flora density,diverse and predominant population)were measured.Results The vaginal pH(4.51±0.3 Vs 4.11±0.2,P<0.05)and Nugent score(4.21±0.81 Vs 1.31±1.19,P<0.05)in RVVC group were significantly increased when compared with those in control group.The density of Lactobacillus was significantly decreased(P<0.05),whereas the density of Gardnerella/Prevotella and gram⁃positive cocci were significantly decreased in RVVC group(P<0.05).Additionally,the flora diverse in RVVC group was signifi⁃cantly raised with lower proportion of Lactobacillus⁃dominating community and high proportion of Gardnerella/Prevotella as well as gram⁃positive cocci⁃dominating community.Conclusion The significant alternations of vaginal bacterial community composition and structure were observed in RVVC women.Such compromising in vaginal biological barrier might relate to the risk to the recurrence of VVC,and future breakthrough might benefit from establishing new therapeutic targets and providing protective strategies for rebuilding vaginal bacterial community by developing novel probiotic Lactobacillus.
【Key words】recurrent vulvovaginal candidiasis(RVVC);vaginal micro⁃ecology;Lactobacillus;Gardnerella/Prevotella
[收稿日期]2015⁃06⁃12
通讯作者:刘延,E⁃mail:ly10309@rjh.com.cn
作者简介:范娟,女(汉族),硕士,主治医师.E⁃mail:fjpitang@126.com
【中图分类号】R 519.3
【文献标识码】A
【文章编号】1673⁃3827(2015)10⁃0210⁃06

