比格犬体内FGFC1药物代谢动力学特征及组织分布的研究
王 格,吴文惠,王小雨,张朝燕,包 斌(上海海洋大学.食品学院、.海洋药物与健康食品研究所,上海 0306)
比格犬体内FGFC1药物代谢动力学特征及组织分布的研究
王格1,吴文惠2,王小雨2,张朝燕1,包斌1
(上海海洋大学1.食品学院、2.海洋药物与健康食品研究所,上海201306)
中国图书分类号: R-332; R916.4; R969.1; R931.77
摘要:目的用高效液相色谱法(HPLC)对海洋新型纤溶化合物FGFC1(fungi fibrinolytic compound 1)的药物代谢动力学和组织分布进行成药性的初步评价。方法分析柱HPC18柱(4. 6 mm×250 mm,5 μm);柱温为40℃;流动相为乙腈-水(0. 1%三氟乙酸)45∶55(V/V)和85∶15(V/V),流速1 mL·min-1;检测波长265 nm。前肢静脉给予比格犬3种剂量(7. 5、5. 0、2. 5 mg·kg-1)的FGFC1,于不同的时间点取血,用HPLC测定血浆和组织中FGFC1的浓度并计算其药物代谢动力学参数和组织分布情况。结果FGFC1的消除半衰期(T1/2β)分别为(49. 035±2. 171)、(48. 422± 2. 113)及(48. 811±2. 372)min;达峰浓度Cmax分别为(56. 48±6. 23)、(48. 63±5. 53)、(13. 64±2. 76)mg·L-1;机体总消除率(CL)分别为(0. 006 2±0. 000 4)、(0. 007 1± 0. 000 8)、(0. 009 2±0. 000 6)L·min-1·kg-1;平均保留时间(MRT)分别为(28. 17±1. 16)、(26. 23±0. 35)、(28. 66± 0. 84)min。组织分布研究结果表明FGFC1在静脉给药后迅速分布到全身各处,最高药物浓度水平在肝脏中检出。结论 FGFC1在比格犬体内呈现良好的药代动力学特性和组织分布特点,表现出较高的成药性特征,值得进一步研究。
关键词:FGFC1;药代动力学特征;组织分布;高效液相色谱;比格犬;血药浓度
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.026.html
包斌(1967-),女,博士,副教授,研究方向:天然药物化学,通讯作者,Tel: 021-61900388,E-mail: whwu@ shou.edu.cn
纤溶活性化合物FGFC1是一种具有纤溶活性的吡喃并异吲哚酮类衍生物,由菌株长孢葡萄穗霉FG216(Stachybotrys longispora FG216,CCTCC M 2012272)[1]的次级代谢产物。FGFC1的分子式为C51H68N2O10,分子质量为869,实验证明[2],FGFC1具有纤溶活性作用,其作用机制是通过提高血液内纤溶因子——纤溶酶原活性来促进血栓溶解,这种独特的血栓溶解机制能克服因使用单链尿激酶型纤溶酶原激活剂和组织型纤溶酶原激活剂及其变异体等大分子外源激酶所带来的出血危险性和热源性等副作用。
本试验通过高效液相色谱法[3-4]对比格犬血浆和组织器官中FGFC1的量变规律及组织分布特征进行研究,对FGFC1的成药性进行初步评价。
1 材料与方法
1.1试剂与仪器FGFC1(纯度>98%)由本实验室提取与纯化得到,其化学结构如Fig 1所示;乙腈购自百灵威化学试剂有限公司;其他试剂均购自国药集团化学试剂有限公司;水为超纯水。

Fig 1 Chemical structural formula of FGFC1
CT14RD台式高速冷冻离心机(上海天美生化仪器有限公司),组织匀浆机(德国IKA公司),高效液相色谱(日本Hitachi公司)配备L-2130泵、L-2200自动采样器、L-2400紫外检测器和D-2000色谱工作站。
1.2 HPLC检测条件分析柱HP-C18柱(4. 6 mm ×250 mm,5 μm);柱温为40℃;流动相为乙腈-水(0. 1%三氟乙酸)45∶55(V/V)和85∶15(V/V),流速1 mL·min-1;检测波长265 nm。
1.3动物比格犬12只,购于上海市新冈动物实验厂,生产许可号: SCXK(沪)2012-0009,使用许可号: SYXK(沪)2011-0130,♂,体质量10. 15~10. 75 kg。
1.4体外试验
1.4.1标准样品的配制精密称取FGFC1适量,加入蒸馏水溶解并以碳酸氢钠作为溶媒(FGFC1/NaHCO3,m/m,1∶1)配制成原液,连续稀释至0. 5、1. 0、10、50、100、200、500 mg·L-1。所有样品用甲醇[5]提取,用0. 22 μm滤膜过滤后用HPLC对其进行检测。,以FGFC1的峰面积(Y)对FGFC1的浓度(X)进行线性回归。
1.4.2特异性特异性的评价通过评价空白血浆的样品,空白血浆样品加入标准的FGFC1,FGFC1静脉给药后比格犬血浆样品。所有样品用甲醇提取,用0. 22 μm滤膜过滤后用HPLC对其进行检测。
1.4.3准确度与精密度制备1. 0、100、400 mg· L-1低、中、高3个浓度的质控样品进行检测,检测值与真实值(平均值)的接近程度定义为准确度,并用相对偏差表示(RE)。日内与日间精密度分别对高、中、低3个浓度的质控样品检测值进行分析,并用相对标准偏差(RSD)表示。所有样品检测前用甲醇提取,并在5 000×g条件下离心15 min后取上清液,经0. 22 μm针头过滤器过滤。
1.4.4回收率低、中、高3个浓度的质控样品(1. 0、100、400 mg·L-1),取定量质控样品加入到定量的甲醇中,混匀后经5 000×g离心15 min,取上清液过滤进HPLC检测。经甲醇提取得到的FGFC1浓度与质控样品检测到的FGFC1浓度比值定义为回收率。
1.4.5稳定性低、中、高3个浓度的质控样品(1. 0、100、400 mg·L-1)置于37℃水浴中24 h,分别检测水浴处理前的生物样品中FGFC1的浓度及24 h水浴处理后生物样品中FGFC1的浓度。
1.5体内试验
1.5.1给药及取样FGFC1注射液配制:首先称取一定质量的FGFC1及等质量溶媒的NaHCO3,两者按照相应的比例,溶解于蒸馏水中,搅拌溶解稀释至不同浓度,并经0. 22 μm针头过滤器过滤,低温避光备用。
药代动力学研究:9只♂成年比格犬随机分组,实验前禁食24 h,自由饮用水,注射剂量分别为7. 5、5. 0、2. 5 mg·kg-1的FGFC1,并通过前肢静脉注射的方式注射药物(注射体积相同)。注射药物之后,分别在0、1、5、15、30、40、60、120、240 min采血样,准确量取200 μL,立即加如到1 800 μL的甲醇溶液(甲醇∶血浆=9∶1),混匀后5 000×g离心15 min,取上清液过滤并进行HPLC检测。
组织分布研究:3只♂成年比格犬,实验前禁食24 h,自由饮用水,注射剂量为7. 5 mg·kg-1的FGFC1溶液,并通过前肢静脉注射的方式注射药物,注射药物之后,在60 min处死比格犬,迅速取脑、心、肝、脾、肺、肾、胃(去内容物)、睾丸、大肠(去内容物)、小肠(去内容物)、肌肉、尿液、粪便、胆汁,用生理盐水冲洗干净,擦干称重,并加入适量的甲醇溶液(甲醇∶样品= 5∶1)中匀浆。匀浆液经5 000×g离心15 min后,取上清液过滤并进HPLC检测。
1.5.2数据处理试验数据利用微软Excel 2013 及SPSS V17.0进行收集处理,药代动力学参数及模型分析利用PKsolver V2.0[6],图片用Origin9.0处理。
2 结果与讨论
2.1方法可行性
2.1.1方法特异性方法特异用来排除内源性干扰因素,分别对空白血浆、FGFC1溶液、添加FGFC1的体外生物样品进行HPLC检测。通过Fig 2可以看到处理后生物样品中的FGFC1可以被很好地分离,保留时间约为29. 0 min,且在11 min左右出现了FGFC1的代谢产物的峰。空白样品在29. 0 min左右时并没有干扰峰出现。本方法具有特异性,满足对FGFC1的检测要求。
2.1.2标准曲线与线性关系实验结果显示,FGFG1在0. 50~500 mg·L-1浓度范围内,线性回归方程为= 0. 956 1X + 0. 126 4(mg·L-1),R2= 0. 999 7。结果显示,FGFC1在0. 50~500 mg·L-1的浓度范围内具有良好的线性关系。
2.1.3准确度与精密度FGFC1的日内和日间精密度RSD均小于5%。结果表明该方法准确、可靠。满足未知血浆样品中药物浓度分析的要求(Tab 1)。准确度平均值也均小于8%,符合实验要求(Tab 1)。

Tab 1 Accuracy and inter-/intra-precision for FGFC1 in dog plasma(n =5)
2.1.4回收率与稳定性实验结果表明,FGFC1在低、中、高3个浓度(1. 0、100、400 mg·L-1)血浆样品提取回收率的RSD均在7%以内。
实验结果表明,FGFC1的血浆样品的稳定性RSD值均在7%以内,表明样品在保存和处理过程中均稳定,未发生明显的降解(Tab 2)。

Fig 2 Detection map of FGFC1A: Blank samples; B: FGFC1 standard solution; C: After intravenous injection of biological samples
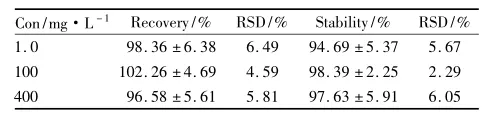
Tab 2 Recovery and stability of FGFC1 in dog plasma(n =5)
2.2 FGFC1的药代动力学特性静脉注射7. 5、5. 0、2. 5 mg·kg-1的FGFC1后,于不同时间点前肢静脉取血,用上述的HPLC方法测定其血药浓度。比格犬血浆中的药物浓度-时间关系如Fig 3所示。
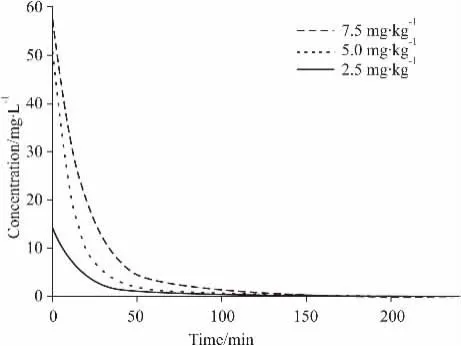
Fig 3 Plasma concentration-time curves of FGFC1 after intravenous injection of FGFC1
FGFC1的药动学参数:达峰浓度分别为(56. 48 ±6. 23)、(48. 63±5. 53)、(13. 64±2. 76)min,半衰期T1/2β分别为(49. 035±2. 171)、(48. 422± 2. 113)、(48. 811±2. 372)min,AUC0-t分别为(1180. 499±49. 092)、(717. 159±23. 573)、(268. 601±19. 342)mg·L-1·min-1。机体总消除率(CL)分别为(0. 006 2±0. 000 4)、(0. 007 1± 0. 000 8)、(0. 009 2±0. 000 6)L·min-1·kg-1,平均保留时间(MRT)分别为(28. 17±1. 16)、(26. 23 ±0. 35)、(28. 66±0. 84)min。统计分析结果表明,AUC值随着剂量的线性增加而呈大幅度的增加,机体总消除率及平均保留时间差异无统计学意义。通过残差平方和(SUM)、赤池值(AIC)以及拟合系数(R2)判断,FGFC1在比格犬体内的药代动力学规律符合二房室模型(权重w = 1/c2)。具体的参数见Tab 3。

Tab 3 Pharmacokinetics of FGFC1 after intravenous injection of FGFC1(n =3)
2.3 FGFC1体内分布研究比格犬前肢静脉给予7. 5 mg·kg-1的FGFC1,在给药后60 min后比格犬体内的FGFC1在体内分布结果见Fig 4。

Fig 4 Tissue distribution of FGFC1 in Beagle dogs(n =3)
实验结果显示,FGFC1在比格犬的组织器官中分布较广泛,说明静脉注射后,FGFC1能到达各个器官和组织,能在器官和组织中积累。给药60 min后,肝脏和胆汁中含量较高,肺、肾脏、脾脏、胃、粪便、尿液中含量中等,其余含量较低。但是FGFC1具体排泄途径,以及代谢产物的结构和活性需要通过更缜密的实验来论证。
3 结论
实验结果显示,以成年雄性比格犬为实验动物,静脉给药FGFC1剂量分别为7. 5、5. 0、2. 5 mg· kg-1后,FGFC1的Cmax分别为(56. 48±6. 23)、(48. 63±5. 53)、(13. 64±2. 76)mg·L-1,T1/2β分别为(49. 035±2. 171)、(48. 422±2. 113)、(48. 811 ±2. 372)min,MRT分别为(28. 17±1. 16)、(26. 23 ±0. 35)、(28. 66±0. 84)min,CL分别为(0. 0062 ±0. 0004)、(0. 0071±0. 0008)、(0. 0092±0. 0006)L·min-1·kg-1。可见,FGFC1能在比格犬体内迅速代谢,且在体内滞留时间比较长,能很好地发挥生物学作用。
组织分布的结果显示,FGFC1在比格犬的脑、心脏、肺等器官都能检测到FGFC1的原型药,说明FGFC1能对各种血栓症状发挥其作用,包括脑血栓、肺血栓、心肌梗塞等血栓疾病。
在HPLC检测比格犬血浆中FGFC1时发现,在血浆中可以检测到原型药(29 min左右)和其代谢产物(11 min左右),但是其代谢产物是否由活性作用还有待进一步研究。
综上所述,FGFC1药物代谢动力学参数被确定,显示出在比格犬体内具有较好的药物动力学特性以及良好的组织分布特点,证明FGFC1具有良好的成药性特征,可用于溶血栓候选药物FGFC1的进一步研究与开发。
参考文献:
[1]张艳,吴文惠,周培根,等.海洋微生物来源纤溶活性化合物的筛选及其分离[J].中国海洋药物杂志,2008,27(6): 39 -43.
[1]Zhang Y,Wu W H,Zhou P G,et al.Screening and isolation of fibrinolytic active compound from marine microorganism[J].Chin J Drugs,2008,27(6):39-43.
[2]王幸,吴文惠,孙立春,等.具有纤溶活性作用的海洋真菌代谢产物的分离与菌株鉴定[J].天然产物研究与开发,2012,24(1):57-61.
[2]Wang X,Wu W H,Sun L C,et al.Isolation of fibrinolytic active compound from marinefungi and initial identification of the strain [J].Nat Prod Res Dev,2012,24(1):57-61.
[3]Liu K,Yan L Q,Yao G C,Guo X J.Estimation of p-coumaric acid as metabolite of E-6-O-p-coumaroyl scandoside methyl ester in rat plasma by HPLC and its application to a pharmacokinetic study [J].J Chromatogr B,2006,831(1-2): 303-6.
[4]Kovaˇríková P,KlimeJ,těrba M,et al.HPLC determination of a novel aroylhydrazone iron chelator(o-108)in rabbit plasma and its application to a pilot pharmacokinetic study[J].J Chromatogr B,2006,838(2): 107-12.
[5]Kashinath R P,Atri D T,Gopal P,et al.Ratil A D,Tripathi.Thermodynamic properties of aqueous electrolyte solutions of LiCl,LiBr,LiI[J].J Chem Eng Data,1990,35(2):166-8.
[6]Zhang Y,Huo M R,Zhou J P,Xie S F.PKSolver: an add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel[J].Comput Meth Prog Bio,2010,99(3): 306 -14.
Pharmacokinetics and tissue distribution of FGFC1,a novel marine fibrinolytic compound in Beagle dogs
WANG Ge1,WU Wen-hui2,WANG Xiao-yu2,ZHANG Chao-yan1,BAO Bin1
(1.College of Food Science and Technology,2.Institute of Marine Drug and Healthy Food,Shanghai Ocean University,Shanghai 201306,China)
Abstract:Aim To detect the concentration of the novel marine fibrinolytic compound FGFC1(fungi fibrinolytic compound 1)on Beagle dogs’plasma and tissue by high performance liquid chromatography(HPLC),and also to investigate the pharmacokinetics and tissue distribution in Beagle dogs with intravenousinjection,and to evaluate the FGFC1 into medicinal.
Methods Chromatographic column: HP-C18(4. 6 mm×250 mm,5 μm); the column temperature was 40℃; the mobile phase was acetonitrile-0. 1% trifluoroacetic acid gradient elute,the flow rate of 1 mL· min-1; the ultraviolet detection wavelength was 265 nm.The dog plasma samples were collected at different intervals after intravenous injection of three different doses(7. 5,5. 0,2. 5 mg·kg-1)of FGFC1,and the concentration of FGFC1 in plasma and tissue was determined by HPLC method for estimating pharmacokinetic parameters and tissue distribution.Results The parameters of 7. 5,5. 0,2. 5 mg·kg-1were as follows: its elimination half-life(T1/2β)was(49. 035± 2. 171),(48. 422±2. 113)and(48. 811±2. 372)min,respectively; the peak concentration was(56. 48 ±6. 23),(48. 63±5. 53),(13. 64±2. 76)mg· L-1,respectively; clearance rate(CL)was(0. 0062 ±0. 0004),(0. 0071±0. 0008)and(0. 0092± 0. 0006)L·min-1·kg-1,respectively; mean retention time(MRT)was(28. 17±1. 16),(26. 23± 0. 35)and(28. 66±0. 84)min,respectively.Tissue distribution revealed that FGFC1 could quickly distributed into the heart,liver,spleen,lung,kidney,intestine,stomach,brain,intestine,testicle,urine and feces.Interestingly,the highest drug(FGFC1)concentration level was detected in the liver.Conclusions
The above study shows a good pharmacokinetic profile as well as a good tissue distribution,indicating a druggable nature of the structure.Therefore,we consider that FGFC1 is promising for further study.
Key words:FGFC1; pharmacokinetics; tissue distribution; HPLC; Beagle dogs; plasma concentration
作者简介:王格(1989-),男,硕士生,研究方向:药物代谢动力学,E-mail: league050301@ outlook.com;
基金项目:国家高技术研究发展计划资助项目(No 2011AA09070109);国家自然科学基金资助项目(No 81341082);上海海洋大学科技发展专项基金资助项目(No 14200069)
收稿日期:2015-02-14,修回日期:2015-04-09
文献标志码:A
文章编号:1001-1978(2015)07-1019-05
doi:10.3969/j.issn.1001-1978.2015.07.026