黄芩苷通过Wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的促进作用
李晨睿,孟志远,牛银波,翟远坤,潘亚磊,谢 丽,梅其炳(西北工业大学生命学院空间生物实验模拟技术国防重点学科实验室,陕西西安 710072)
黄芩苷通过Wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的促进作用
李晨睿,孟志远,牛银波,翟远坤,潘亚磊,谢丽,梅其炳
(西北工业大学生命学院空间生物实验模拟技术国防重点学科实验室,陕西西安710072)
中国图书分类号: R-332; R284.1; R329.24; R345.61; R394.2; R681; R977. 3
摘要:目的研究黄芩苷(baicalin)对大鼠骨髓间充质干细胞(rat bone marrow derived mesenchymal stem cells,rBMSC)成骨分化过程中Wnt/β-catenin信号通路的影响。方法采用贴壁筛选法体外培养rBMSC,给予黄芩苷3、5、7 d后,比
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.007.html
梅其炳(1953-),男,博士,教授,博士生导师,研究方向:骨丢失发生机制及其药物防护,通讯作者,Tel: 029-84779212,E-mail: qbmei@ nwpu.edu.cn较药物处理组与对照组之间碱性磷酸酶(ALP)的活性。同时检测给予黄芩苷对碱性磷酸酶阳性克隆和矿化结节形成的影响。提取总mRNA和总蛋白,用实时荧光定量PCR检测黄芩苷对Wnt10a、GSK-3β、β-catenin以及LEF1 mRNA水平的影响。免疫印迹检测药物处理对β-catenin以及Runx2蛋白表达量的影响。结果黄芩苷明显提高ALP的活性。10 μmol·L-1浓度的黄芩苷还可增加碱性磷酸酶克隆数和钙化结节的形成。黄芩苷还可提高Wnt10a、β-catenin、GSK-3β、LEF1以及osteocalcin的mRNA水平,并提高β-catenin和Runx2的蛋白表达量。结论黄芩苷在0. 1~50 μmol·L-1的给药浓度下可促进rBMSC的成骨分化成熟,Wnt/β-catenin信号可能参与调控rBMSC的成骨分化。
关键词:黄芩苷;大鼠骨髓间充质干细胞;成骨分化; Wnt/βcatenin信号通路;碱性磷酸酶
骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)来源于骨髓,是具有自我更新及多向分化功能的细胞[1]。BMSCs的成骨分化能力随年龄增加而减弱,并在微重力环境下被抑制,这可能是导致骨质流失的重要原因之一[2-4]。Wnt/β-catenin信号通路是调控BMSCs成骨分化的重要信号通路[5]。近年来研究表明,多种植物药或天然药物单体能有效防治骨质疏松,如续断、蛇床子素等[6-8]。黄芩为唇形科植物,富含黄酮类化合物,黄芩苷是其中的主要活性组分(化学结构见Fig 1)。在不同结构的36个黄酮类化合物中,黄芩苷对原代成骨细胞碱性磷酸酶活性促进作用最为明显,并且通过上调Wnt/β-catenin信号促进成骨细胞分化[9]。然而,黄芩苷对rBMSC的成骨分化的作用及其分子机制还未见报道。本实验以大鼠rBMSC为对象,研究黄芩苷对细胞增殖及成骨分化和成熟的影响,以及对Wnt/β-catenin信号通路的调控。

Fig 1 Chemical structure of baicalin
1 材料与方法
1.1实验材料体质量220~250 g的Sprague-Dawley大鼠4只,购自中国人民解放军第四军医大学实验动物中心(动物合格证号: SCXK军2007-007)。DMEM/F12培养液、胎牛血清、青-链霉素及0.25% Trypsin-EDTA购自Thermo Scientific Hyclone公司。黄芩苷(纯度≥99%)、抗坏血酸、β-甘油磷酸钠、地塞米松、MTT试剂、固蓝RR、茜素红、二甲基亚砜(DMSO)均购自Sigma-Aldrich公司。碱性磷酸酶测定试剂盒购自南京建成生物工程研究所。总RNA提取试剂盒(离心柱型)、反转录试剂盒、SYBR Green荧光定量预混试剂均购自天根生化科技(北京)有限公司。引物由北京奥科鼎盛生物科技有限公司设计合成。β-catenin、Runx-2单克隆抗体以及辣根过氧化物酶标记的二抗购自Abcam公司。
1.2实验方法
1.2.1大鼠骨髓间充质干细胞的分离培养大鼠颈椎脱臼处死,于75%酒精中浸泡10 min,在无菌条件下快速分离股骨及胫骨,切除两端骨骺,用5 mL注射器抽取一定量DMEM/F12培养液冲洗骨髓腔至液体澄清。收集冲洗液,用微量移液器吹打后静置5 min。取上清液,于1 000 r·min-1离心5 min,弃上清,用含10%体积分数胎牛血清的DMEM/F12使细胞重悬,反复吹打后计数,以104个/cm2的密度接种于6孔板中,置于37℃、5% CO2培养箱中培养。3d后首次换液,每日观察细胞生长情况,待贴壁细胞达80%融合后用胰酶进行消化传代培养(此为第一代P1)。待细胞传代至P3时进行实验,96孔板、24孔板、6孔板接种密度为2×103、2 ×105、4×105细胞/孔。
1.2.2 ALP活性测定细胞接种于96孔板,培养24h后进行成骨性诱导(诱导培养液中抗坏血酸、β-甘油磷酸钠和地塞米松浓度分别为0. 284、10、2× 10-3mmol·L-1)。同时进行给药处理,系列黄芩苷终浓度为0. 1、0. 5、1、5、10、50 μmol·L-1,每组设6个复孔。给药组与对照组培养液均含有1‰的DMSO。于37℃、5%CO2培养箱中培养3、5、7 d,每3 d换液1次。弃培养液,PBS洗2次,每孔加入缓冲液和基质液各50 μL,混匀于37℃水浴15 min,加入150 μL显影液,于520 nm波长下测吸光度(OD)。根据试剂盒说明配制酚标液标准曲线,根据酚标液及样本的吸光度值计算酶活性,结果以每孔15 min内产生酚的摩尔量表示。
1.2.3碱性磷酸酶阳性克隆(CFU-FALP)分析细胞接种于12孔板,培养24 h后成骨诱导,给药组给予10 μmol·L-1黄芩苷,对照组加入空白诱导培养基,给药组与对照组培养液均含有1‰的DMSO。7 d后采用偶氮偶合法进行ALP组织化学染色。PBS 洗2遍,10%甲醛溶液固定1 min,加入基质液(含0.1%的α-萘基磷酸钠和固蓝RR盐的Michaelis氏巴比妥钠-HCl缓冲液,pH 8.9)中反应30 min。出现褐色斑点时弃掉基质液,PBS洗后固定,照相保存结果,用Image-Pro Plus 6.0软件扫描CFU-FALP的面积、数量和灰度,进行统计学分析。
1.2.4矿化结节形成细胞接种于24孔板,培养24h后成骨诱导,给药组给予10 μmol·L-1黄芩苷,对照组加入空白诱导培养基,给药组与对照组培养液均含有1‰的DMSO。d12弃培养液,PBS洗2次,10%甲醛固定5 min。加入茜素红染色剂,37℃孵育1 h,观察矿化结节的形成情况。照相保存结果,用Image-Pro Plus 6.0软件扫描矿化结节的面积、数量和灰度,进行统计学分析。
1.2.5 Real time-qPCR分析细胞接种于6孔板,培养24h后成骨诱导,给药组给予10 μmol·L-1黄芩苷,对照组加入空白诱导培养基,给药组与对照组培养液均含有1‰的DMSO。8、24、48 h后,按试剂盒方法提取总RNA,用超微量紫外可见分光光度计检测浓度和纯度,调整RNA浓度至1 μg,取1 μL逆转录为cDNA。在体系中加入引物(见Tab 1)和SYBR Green试剂,于Bio-Rad CFX96型实时荧光定量PCR仪上,以两步法对cDNA进行扩增。预变性阶段,在95反应10 min,一个循环。PCR反应阶段,分别为95反应15 s、57反应30 s、72反应30 s,共40个循环。记录CT(cycle threshold)值,通过ΔΔCT =(CT目的基因-CT内参基因)处理组-(CT目的基因-CT内参基因)对照组,计算各组2-ΔΔCT,即得该目的基因给药组mRNA表达与对照组mRNA的倍数。
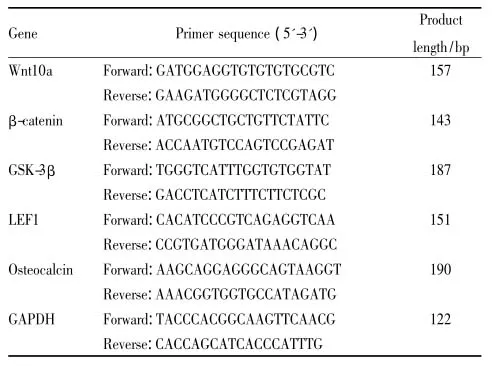
Tab 1 Specific primer sequences for Real-time qPCR
1.2.6 Western blot分析细胞接种于6孔板,培养24 h后成骨诱导,给药组给予1、10、50 μmol· L-1浓度黄芩苷,对照组加入空白诱导培养基,给药组与对照组培养液均含有1‰的DMSO。处理3 d后,每孔用300 μL细胞裂解液(含有PMSF 1 mmol ·L-1)提取总蛋白。用超微量紫外可见分光光度计检测蛋白浓度,加入含有溴酚蓝的上样缓冲液,于95℃变性5 min,经12 % SDS-PAGE电泳分离后,将待测蛋白转移至PVDF膜上,用5 %脱脂奶粉于室温下摇床封闭1 h,加入用TBST稀释的β-catenin、Runx2、β-actin的一抗(稀释比例为1∶1 000),4℃过夜。次日用TBST将PVDF膜洗3次后,加入用TBST稀释的辣根过氧化物酶标记的二抗,室温下摇动2 h。洗膜3次后,将发光液涂抹于PVDF膜上,于暗室曝光。将胶片进行拍照,用IPP6.0软件对条带的灰度值进行测定,用相对定量进行分析。
2 结果
2.1不同浓度黄芩苷对碱性磷酸酶活性的影响如Fig 2所示,rBMSC经成骨诱导后,ALP活性随时间而增加,诱导7 d后ALP活性最高。不同浓度黄芩苷在5、7 d均能增加ALP活性(P<0. 01),并呈现出浓度依赖性,其中10 μmol·L-1黄芩苷对ALP活性增加最为明显,而在50 μmol·L-1时ALP活性略有降低。

Fig 2 Effect of baicalin on ALP activityat various concentrations(n =6)*P<0. 05,**P<0. 01 vs con
2.2黄芩苷对碱性磷酸酶活性阳性克隆形成的影响如Fig 3所示,rBMSC经成骨诱导7 d后,对照组与给药组均能形成碱性磷酸酶活性阳性克隆(CFU-FALP)。通过IPP 6.0软件对进行CFU-FALP灰度扫描(Tab 2),给予黄芩苷1、10、50 μmol·L-1后,CFU-FALP的面积、数量和相对灰度高于对照组,且两组间差异有统计学意义(P<0. 05或P<0. 01)。

Tab 2 Intensity scanning of CFU-FALPformation 7 days after osteogenic induction(n =4)
2.3黄芩苷对钙化结节形成的影响如Fig 4所示,rBMSC经成骨诱导12 d后,对照组与黄芩苷组均形成钙化结节。给予黄芩苷1、10、50 μmol·L-1后,钙化结节形成数量多于对照组。经IPP6.0软件分析(Tab 3),钙化结节的面积、数量和相对灰度高于对照组,且两组间差异有显著性(P<0. 01)。

Fig 3 Effect of baicalin at various concentrations on CFU-FALPformation 7 daysafter osteogenic induction.A: CON,B: baicalin at 1μmol·L-1; C: baicalin at 10μmol·L-1; D: baicalin at 50 μmol·L-1
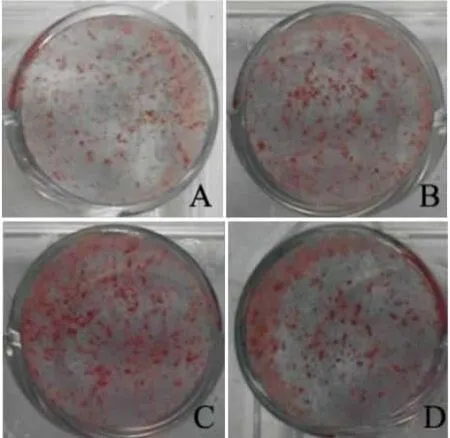
Fig 4 Effect of baicalin at various concentrations on mineralized nodule formation 12 days after osteogenic inductionA: CON; B: baicalin at 1 μmol·L-1; C: baicalin at 10 μmol· L-1; D: baicalinat 50 μmol·L-1
2.4黄芩苷对Wnt/β-catenin信号通路相关基因表达的影响经10μmol·L-1黄芩苷处理原代rBMSC 12、24、36 h后,Real time-qPCR检测Wnt/β-catenin信号通路表达的变化,用相对定量法2-ΔΔCT分析检测结果。如Tab4所示,给药组在12、24、36 h均
Tab 3 Intensity scanning of mineralized nodule formation 12 days after osteogenic induction(±s,n =4)

Tab 3 Intensity scanning of mineralized nodule formation 12 days after osteogenic induction(±s,n =4)
AreaNumber Group/mm2·well-1/mineralized nodule·well-1Intensity CON 30.34±6.53 702.78±49.50 21955.34±2397.71 1 μmol·L-1 54.55±6.23** 973.64±74.70** 71181.98±5769.01**10 μmol·L-1 68.14±4.93** 1218.64±147.13** 90613.62±6423.42**50 μmol·L-1 64.03±5.41** 1157.68±85.70** 74511.73±5773.22***P<0. 05,**P<0. 01 vs CON
Tab 4 Effect of baicalin at 10 μmol·L-1on mRNA expression of Wnt/β-catenin molecular 12,24,36 h after osteogenic differentiation(±s,n =3)
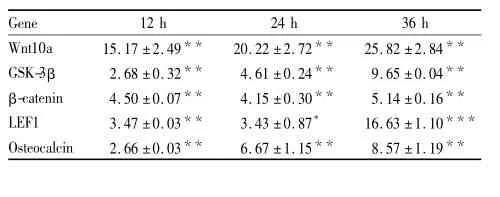
Tab 4 Effect of baicalin at 10 μmol·L-1on mRNA expression of Wnt/β-catenin molecular 12,24,36 h after osteogenic differentiation(±s,n =3)
Gene 12 h 24 h 36 h Wnt10a 15.17±2.49** 20.22±2.72** 25.82±2.84**GSK-3β 2.68±0.32** 4.61±0.24** 9.65±0.04**β-catenin 4.50±0.07** 4.15±0.30** 5.14±0.16**LEF1 3.47±0.03** 3.43±0.87* 16.63±1.10***Osteocalcin 2.66±0.03** 6.67±1.15** 8.57±1.19***P<0. 05;**P<0. 01 vs CON
可明显提高Wnt10a、GSK-3β、β-catenin、LEF1和osteocalcin的基因表达量(P<0. 05 or P<0. 01)。其中黄芩苷在36 h对Wnt10a以及LEF1mRNA表达水平影响最为明显,与同时间对照组相比,相对于管家基因GAPDH分别提高25. 82倍和16. 63倍。
2.5黄芩苷对β-catenin和Runx2蛋白表达量的影响经1、10、50 μmol·L-1黄芩苷处理原代rBMSC 3 d后,采用Western blot检测β-catenin和Runx2蛋白表达量。结果如Fig 5所示,黄芩苷仅在10 μmol·L-1浓度下能明显提高Runx2的蛋白表达量,而黄芩苷在1、10、50 μmol·L-1的给药浓度下均能提高β-catenin的蛋白表达量。
3 讨论
近年来研究表明,植物药在防治骨质疏松方面具有巨大潜力。在传统中药方剂的基础上开发和改良出多个抗骨质疏松中成药。Wang等[10]总结了12项抗骨质疏松中成药的随机对照试验并评价其有效性,受试者包括1 816名骨质疏松患者。结果表明,受试中药制剂都明显增加了患者腰椎的骨密度。多种黄酮类化合物在细胞或动物水平显示出明显促成骨作用,如淫羊藿苷、染料木黄酮、白藜芦醇、蛇床子素等[10-14]。与传统治疗骨质疏松药物相比,植物药来源广泛且毒副作用较低,因此具有较大的应用开发价值。

Fig 5 Effect of baicalin at various concentrations on protein expression of β-catenin and Runx2 after osteogenic differentiation for 3 days*P<0. 05,**P<0. 01 vs CON
BMSCs源于骨髓,具有自我更新及多向分化功能,在一定条件下能够分化为成骨细胞、脂肪细胞、成肌细胞、成软骨细胞、神经细胞等[1]。促进BMSCs的成骨分化,能够增加骨形成及骨强度。近年来,应用BMSCs对骨相关疾病进行细胞治疗引起极大关注,BMSCs在骨组织工程中也表现出巨大的应用潜力[15-17]。本实验结果表明,黄芩苷能够促进BMSCs的成骨分化成熟,明显提高ALP活性、ALP阳性克隆形成、钙化结节形成,并提高Runx2基因及蛋白表达,所测定指标均与细胞成骨分化密切相关。
Wnt/β-catenin信号通路在调控BMSC成骨分化过程中发挥重要作用,但文献报道有正、负调控两种结果。转染Wnt1、Wnt10a、Wnt10b及β-catenin 的ST2细胞经成骨诱导后,细胞ALP活性及钙化能力明显提高[5]。整体动物水平,FABP4-Wnt10b转基因小鼠的骨量为野生型小鼠的4倍[18]。GSK-3α/β抑制剂603281-31-8能促进C3H10T1/2细胞的骨向分化[19]。C3H10T1/2细胞转染Wnt3A腺病毒载体后,通过上调CNN1/Cyr61表达增加其骨向分化[20]。然而Wnt3a抑制人BMSC的ALP活性并抑制其矿化[21-22]。实验结果的不一致可能与采用的细胞类型及Wnt信号分子的水平高低密切相关。除了诱导BMSC分化,Wnt/β-catenin信号的过度激活能诱导BMSC衰老[23]。并且利用转基因小鼠,在骨细胞持续激活β-catenin表达能够明显增加松质骨骨量,但减弱骨力学性能[24]。因此,Wnt/β-catenin信号强弱对调控结果的影响,以及Wnt/β-catenin信号在不同细胞谱系、细胞周期所起的作用值得深入研究。
据报道,黄芩苷促进成骨细胞分化并非通过雌激素信号通路发挥作用,而是通过激活Wnt/β-catenin信号[7]。我们发现黄芩苷能够提高Wnt10a、GSK-3β、β-catenin和LEF1的基因表达,并在蛋白水平提高β-catenin的表达量,表明黄芩苷可能通过调控Wnt/β-catenin信号而促进BMSCs的分化成熟。BMSCs的分化成熟是复杂的过程,在黄芩苷调控rBMSC成骨分化的过程中是否有其他Wnt/β-catenin信号分子或其他信号通路的参与还有待于进一步研究。
参考文献:
[1]Guan M,Yao W,Liu R,et al.Directing mesenchymal stem cells to bone to augment bone formation and increase bone mass[J].Nat Med,2012,18(3): 456-62.
[2]Baker N,Boyette L B,Tuan R S.Characterization of bone marrow -derived mesenchymal stem cells in aging[J].Bone,2015,70C: 37-47.
[3]张晨,吕东媛,孙树津,等.地基微重力效应模拟影响骨髓间充质干细胞生物学行为及其调控机理研究进展[J].医用生物力学,2014,29(3): 285-91.
[3]Zhang C,Lyu D Y,Sun S J,et al.Impacts of ground-based microgravity simulation on biological responses of bone marrow mesenchymal stem cells and its underlying mechnisms: a mini-review [J].J Med Biomechanics,2014,29(3): 285-91.
[4]Qian X,Zhang C,Chen G,et al.Effects of BMP-2 and FGF2 on the osteogenesis of bone marrow-derived mesenchymal stem cells in hindlimb unloaded rats[J].Cell Biochem Biophys,2014,70(2): 1127-36.
[5]Cawthorn W P,Bree A J,Yao Y,et al.Wnt6,Wnt10a and Wnt10b inhibit adipogenesis and stimulate osteoblastogenesis through a β-catenin-dependent mechanism[J].Bone,2012,50(2): 477-89.
[6]Li C R,Li Q,Liu R J,et al.Medicinal herbs in the prevention and treatment of osteoporosis[J].Am J Chin Med,2014,42(1): 1-22.
[7]牛银波,潘亚磊,李晨睿,等.续断防治骨质疏松的研究进展[J].中国药理学通报,2013,29(7): 892-4.
[8]Niu Y B,Pan Y L,Li C R,et al.Research progress of Radix dipsaci in the prevention and treatment of osteoporosis[J].Chin Pharmacol Bull,2013,29(7): 892-4.
[7]鲍君杰,谢梅林,朱路佳.蛇床子素治疗去卵巢大鼠骨质疏松的实验研究[J].中国药理学通报,2011,27(4): 591-2.
[8]Bao J J,Xie M L,Zhu L J.Treatment of osthol on osteoporosis inovariectomized rats[J].Chin Pharmacol Bull,2011,27(4): 591 -2.
[9]Guo A J,Choi R C,Cheung A W,et al.Baicalin,a flavone,induces the differentiation of cultured osteoblasts: an action via the Wnt/beta-catenin signaling pathway[J].J Biol Chem,2011,286(32): 27882-93.
[10]Wang Z Q,Li J L,Sun Y L,et al.Chinese herbal medicine for osteoporosis: a systematic review of randomized controlled trails [J].Evid Based Complement Alternat Med,2013,2013:356260.
[11]Zhai Y K,Guo X Y,Ge B F,et al.Icariin stimulates the osteogenic differentiation of rat bone marrow stromal cells via activating the PI3K-AKT-eNOS-NO-cGMP-PKG[J].Bone,2014,66: 189 -98.
[12]Yang L,Yu Z,Qu H,Li M.Comparative effects of hispidulin,genistein,and icariin with estrogen on bone tissue in ovariectomized rats[J].Cell Biochem Biolhys,2014,70(1): 485-90.
[13]Durbin S M,Jackson J R,Ryan M J,et al.Resveratrol supplementation influences bone properties in the tibia of hindlimb-suspended mature Fisher 344×Brown Norway male rats[J].Appl Physiol Nutrit Metabol,2012,37(6):1179-88.
[14]Zhai Y K,Pan Y L,Niu Y B,et al.The importance of the prenyl group in the activities of osthole in enhancing bone formation and inhibiting bone resorption in vitro[J].Int J Endocrinal,2014,2014:921954.
[15]Bianco P,Cao X,Frenette P S,et al.The meaning,the sense and the significance: translating the science of mesenchymal stem cells into medicine[J].Nat Med,2013,19(1): 35-42.
[16]Guan M,Yao W,Liu R,et al.Directing mesenchymal stem cells to bone to augment bone formation and increase bone mass[J].Nat Med,2012,18(3): 456-62.
[17]Ovares-Navarrete R,Hyzy S L,Haithcock D A,et al.Coordinated regulation of mesenchymal stem cell differentiation on microstructured titanium surfaces by endogenous bone morphogenetic proteins[J].Bone,2015,73:208-16.
[18]Bennett C N,Longo K A,Wright W S,et al.Regulation of osteoblastogenesis and bone mass by Wnt10b[J].Proc Natl Acad Sci USA,2005,102(9): 3324-9.
[19]Kulkarni N H,Onyia J E,Zeng Q,et al.Orally bioavailable GSK-3alpha/beta dual inhibitor increases markers of cellular differentiation in vitro and bone mass in vivo[J].J Bone Miner Res,2006,21(6): 910-20.
[20]Si W,Kang Q,Luu H H,et al.CCN1/Cyr61 is regulated by the canonical Wnt signal and plays an important role in Wnt3A-induced osteoblast differentiation of mesenchymal stem cells[J].Mol Cell Biol,2006,26(8): 2955-64.
[21]De Boer J,Siddappa R,Gaspar C,et al.Wnt signaling inhibits osteogenic differentiation of human mesenchymal stem cells[J].Bone,2004,34(5): 818-26.
[22]Boland G M,Perkins G,Hall D J,et al.Wnt 3a promotes proliferation and suppresses osteogenic differentiation of adult human mesenchymal stem cells[J].J Cell Biochem,2004,93(6): 1210-30.
[23]Zhang D Z,Wang H J,Tan Y Z.Wnt/β-catenin signaling induces the aging of mesenchymal stem cells through the DNA damage response and the p53/p21 pathway[J].PLoS One,2011,6(6): E21397.
[24]Chen S X,Feng J Q,Bao Q W,et al.Adverse effects of osteocytic constitutive activation of β-catenin on bone strength and bone growth[J].J Bone Miner Res.doi: 10.1002/jbmr.2453,2015
Baicalin induces osteogenic differentiation of rat bone marrow derived mesenchymal stem cells via Wnt/β-catenin signaling pathway
LI Chen-rui,MENG Zhi-yuan,NIU Yin-bo,ZHAI Yuan-kun,PAN Ya-lei,XIE Li,MEI Qi-bing
(Key Laboratory for Space Bioscience and Biotechnology,School of Life Sciences,Northwestern Polytechnical University,Xi’an 710072,China)
Abstract:Aim To investigate the role of Wnt/β-catenin signaling pathway on the baicalin-induced osteogenic differentiation in rat bone marrow derived mesenchymal stem cells(rBMSC).Methods rBMSC was isolated and cultured by adherence screening method.Alkaline phosphatase(ALP)amount,CFU-FALP and mineralized nodules were compared between each baicalin group and vehicle control group at different time points.Real time q-PCR was employed to evaluate the mRNA level of Wnt signaling-related marker(Wnt10a,GSK-3β,β-catenin and LEF1)after baicalin treatment.Protein expression of β-catenin and Runx2 was measured by Western blot.Results Baicalin significantly increased ALP activities from day 3 to day 7.The formation of CFU-FALP and mineralized nodules remarkably increased after rBMSC was treated with1,10,50 μmol·L-1baicalin.mRNA levels of Wnt10a,β-catenin,GSK-3β,LEF1and osteocalcin were enhanced significantly in baicalin-treated group compared to control group.Protein expression of βcatenin and Runx2 was also elevated.Conclusion Baicalin(0. 1 to 50 μmol·L-1)promotes the osteogenic differentiation and maturation of rBMSC,in which Wnt/β-catenin signaling pathway might be involved.
Key words:baicalin; rat bone marrow derived mesenchymal stem cells(rBMSC); osteogenic differentiation; Wnt/β-catenin signaling pathway; alkaline phosphatase
作者简介:李晨睿(1982-),女,博士,博士后,研究方向:骨丢失发生机制及其药物防护,E-mail: chenruilee525@126.com;
基金项目:中央高校基本科研业务费专项资金资助(No 3102014JKY15009,3102014KYJD020)
收稿日期:2015-03-30,修回日期:2015-04-28
文献标志码:A
文章编号:1001-1978(2015)07-0919-06
doi:10.3969/j.issn.1001-1978.2015.07.007