瓜蒌皮提取物对高糖诱导人脐静脉内皮细胞凋亡的影响及机制研究
刘思妤,谷 彬,卢新华,王俊杰,谭 斌(湘南学院基础医学部,湖南郴州 423000)
瓜蒌皮提取物对高糖诱导人脐静脉内皮细胞凋亡的影响及机制研究
刘思妤,谷彬,卢新华,王俊杰,谭斌
(湘南学院基础医学部,湖南郴州423000)
中国图书分类号: R-284. 1; R322. 123; R329. 25; R587. 2
摘要:目的探讨瓜蒌皮提取物(extractive pericarpium trichosanthes,EPT)对体外高糖诱导人脐静脉内皮细胞凋亡的抑制作用及其机制。方法体外培养人脐静脉内皮细胞株(HUVECs),观察不同浓度瓜蒌皮提取物干预高糖处理的HUVECs凋亡的变化。MTT法检测HUVECs的存活率、采用Hoechst染色法检测细胞凋亡、采用比色法测定细胞内Caspase-3的活性、Western blot 法以及免疫荧光染色法检测核因子-κB(nuclear factor kappa B,NF-κB)的蛋白表达和p65核移位情况。结果30 mmol·L-1葡萄糖处理内皮细胞48h能引起细胞活性明显降低,细胞凋亡率及caspase-3的活性明显增加,细胞中NF-κB蛋白表达升高及p65核移位增加。用瓜蒌皮提取物(12.5、25、50 mg·L-1)预处理细胞1 h,可以增加细胞活性;降低细胞凋亡率、caspase-3的活性及NF-κB蛋白表达,呈浓度依赖性,且对高糖诱导的p65核移位有抑制作用。结论瓜蒌皮提取物对体外高糖诱导的HUVECs凋亡有抑制作用,其作用机制与下调NF-κB表达和降低caspase-3活性有关。
关键词:瓜蒌皮提取物;高糖;内皮细胞;凋亡; NF-κB; Caspase-3; MTT
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.020.html
谭斌(1968-),男,教授,研究方向:心血管药理学,通讯作者,E-mail: tanbin1661@126.com
糖尿病血管病变是糖尿病主要的慢性并发症之一。高血糖能通过诱导内皮细胞功能障碍,加速细胞凋亡而导致血管内皮受损,从而引起动脉粥样硬化(As)的发生[1]。瓜蒌皮(亦称栝楼皮)是葫芦科植物栝楼或者双边栝楼等的果皮,具有清热化痰,利气宽胸的功效,主要用于治痰热咳嗽、咽痛、胸闷、消渴等疾病[2]。前期研究表明,瓜蒌皮提取物能通过清除自由基,减少一氧化氮(NO)的灭活,对糖尿病大鼠血管内皮有保护作用[3],但并未对其保护机制做详细的阐述。高血糖时的活性氧等因素损害血管内皮,导致其抗氧化能力降低[4],而高糖诱导的氧化应激能通过激活核因子NF-κB途径,促使内皮细胞凋亡,释放各种细胞因子,引发一系列的病理改变,最终导致疾病发生[5]。因此本研究在前期实验的基础上进一步分离瓜蒌皮有效成分,采用高糖诱导的人脐静脉内皮细胞凋亡模型,探讨瓜蒌皮对内皮细胞的保护机制是否涉及NF-κB途径。
1 材料
1.1药材及细胞株实验用瓜蒌皮购自湖南省郴州市老百姓大药房(经湖南省郴州市药品检验所黄丽彬副主任中药师鉴定为葫芦科植物栝楼干燥成熟果皮);人脐静脉血管内皮细胞株HUVECs(编号: C-003-5C),购自中国科学院细胞生物学研究所上海细胞库。
1.2主要试剂胰蛋白酶,武汉亚法生物技术公司; DMEM培养基,Hyclone公司;胎牛血清(FBS),浙江杭州四季青公司; MTT,Sigma公司;细胞凋亡-Hoechst染色试剂盒,碧云天生物技术研究所,批号: C0003; NF-κB激活-核转运检测试剂盒,碧云天生物技术研究所,批号: SN368; caspase-3活性检测试剂盒,碧云天生物技术研究所,批号: C1115; NF-κB p65抗体,Abcam公司,批号: ab16502;其余试剂均为市售分析纯产品。
1.3仪器MCO-15AC二氧化碳培养箱(日本三洋公司),CXK41荧光倒置显微镜(日本OLYMPUS),JHT-DDC超净工作台(山东省济南洁康设备厂),荧光酶标仪(Thermo公司),Mini-Protean Tetra System(美国Bio-Rad公司),TGL-16G-A台式低温离心机(上海安亭科学仪器厂),LS-B50L-Ⅰ立式压力蒸汽灭菌器(江阴滨江医疗设备有限公司),FA1604电子分析天平(上海精密仪器公司)。
2 方法
2.1药物的制备将100 g瓜蒌皮粉碎,用70 %的乙醇冷凝回流,将回流所得溶液浓缩后用氯仿萃取,再将萃取液浓缩至浸膏。采用硅胶柱层析法分离所得浸膏,选用极性较大的甲醇:氯仿系统作为洗脱剂。收集中间层即得瓜蒌皮有效成分(extractvie pericarpium trichosanthes,EPT),再将其浓缩回流,所得浸膏静置在空气流通处挥干,得到样品5. 89 g。用DMSO配制成储备液(50 g·L-1),DMSO终浓度控制在0.1 %。
2.2细胞培养HUVECs接种于含10 %胎牛血清的低糖DMEM培养基的细胞培养瓶中,置于37℃、5% CO2的细胞培养箱中培养,2~3 d换液1次,待细胞铺满培养瓶的80%时,用2. 5 g·L-1的胰蛋白酶消化,用培养基终止消化,均匀接种于6孔或96孔的培养板中。
2.3实验分组实验分为4组:①正常对照组(Control):实验中不加任何物质干扰;②高糖损伤组(Glucose):在细胞培养系中加终浓度为30 mmol ·L-1的葡萄糖;③EPT预处理组(+ EPT):在细胞培养系中预先用终浓度为12. 5、25、50 mg·L-1EPT预处理1 h,再加30 mmol·L-1葡萄糖和终浓度为12. 5、25、50 mg·L-1EPT继续共培养;④高渗组(Mannitol):在细胞培养系中加终浓度为30 mmol· L-1甘露醇。各组细胞培养48 h后检测相应指标。
2.4 MTT法检测HUVECs细胞的存活率收集对数生长期的HUVECs,以1×105·L-1的密度接种于96孔板。贴壁24 h后,同步化12~24 h,分别按上述实验分组培养48 h,加入20 μL 5 g·L-1MTT,使其终浓度为0. 5 g·L-1,置于培养箱继续培养4 h。小心吸取各孔培养液,每孔加入150 μL DMSO,微震荡15 min,选择490 nm为测定波长,用酶标仪测量各孔的OD值,以无细胞孔为空白对照,每组6个复孔,重复3次。以对照组为100%。
2.5 Hoechst 33258荧光染色观察细胞核的形态学改变将细胞按实验分组处理后,去除各孔上清液加入固定液,固定15 min后用PBS洗两遍,再加入Hoechst 33258染色液,染色5 min后用PBS洗两遍,滴一滴抗荧光淬灭封片液,激发波长350 nm,发射波长460 nm,于荧光显微镜下观察蓝色细胞核,正常细胞的细胞核呈正常的蓝色,而凋亡细胞的细胞核会呈致密浓染,或呈碎块状致密浓染,颜色有些发白,用软件Image J计算细胞凋亡率。
2.6比色法测定细胞内caspase-3的活性分别收集各组细胞,PBS洗两次,600×g 4℃离心5min收集细胞,PBS洗1次,按每2×106个细胞加入100 μL裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15 min,4℃20 000×g离心15 min。把上清转移到冰浴预冷的离心管中,Bradford法测定蛋白浓度。各组取相同量蛋白,分别加入10 μL Ac-DEVD-pNA(2 mmol·L-1)后混匀,37℃孵育120 min,用酶标仪于405 nm波长处测定其吸光度值,结果以各组与正常对照组比值表示。
2.7 Western blot法检测NF-κB p65蛋白的表达
提取贴壁细胞总蛋白并通过考马斯亮蓝法测定其蛋白含量。所提细胞总蛋白经SDS-PAGE分离后以β-actin为内参照,兔抗羊NF-κB p65-IgG为一抗,通过Western blot法测定其NF-κB p65相对表达量,实验重复3次。
2.8 NF-κB核移位检测吸除培养液,PBS洗1次,加固定液固定15 min后,洗涤液洗涤3次,每次3 min,加免疫染色封闭液,室温封闭1 h后去除封闭液,加入NF-κB p65抗体,4℃孵育过夜,而后洗涤3次,再加入抗兔Cy3,室温孵育1 h后洗涤,加入细胞核染色液(DAPI),室温染色5 min,吸除染色液洗涤,滴加适量的抗荧光淬灭封片液,荧光显微镜下观察NF-κB染色为红色荧光,细胞核染色为蓝色荧光。
2.9统计学方法数据用SPSS17.0统计软件进行处理,数据用±s表示。组间差异显著性采用单因素方差分析(One-Way ANOVA)进行统计学分析,组间的两两比较采用LSD法。
3 结果
3.1 EPT对高糖处理HUVECs存活率的影响
高糖处理明显抑制HUVECs细胞活力(P<0. 01)。不同浓度EPT处理48 h后,HUVECs的存活率较高糖组明显升高,呈剂量依赖性(P<0. 05或P<0. 01),由此推测,EPT可明显拮抗高糖诱导的HUVECs损伤(Fig 1)。
3.2 EPT对高糖处理HUVECs凋亡的影响高糖孵育48 h后,HUVECs凋亡细胞明显增加(P<0. 01)。不同浓度EPT处理48 h后,凋亡细胞较高糖组明显减少,呈剂量依赖性(P<0. 05或P<0. 01)。甘露醇组凋亡细胞与正常对照组相近,说明渗透压对HUVECs凋亡影响不大(Fig 2)。
3.3 EPT对高糖诱导HUVECs caspase-3活性的影响以OD405反映caspase-3活性强弱。与正常对照组比较,高糖组caspase-3活性明显升高(P<0. 01)。与高糖组比较,不同浓度EPT组内皮细胞caspase-3活性呈现剂量依赖性降低(P<0. 05或P<0. 01)。甘露醇组caspase-3活性与正常对照组相近,说明渗透压对HUVECs caspase-3活性影响不大(Fig 3)。

Fig 1 Effect of EPT on high glucose-induced cellular viability in human umbilical vein endothelial cells(±s,n =6)1: Control; 2: Glucose 30 mmol·L-1; 3: + EPT 12.5 mg·L-1; 4: + EPT 25 mg·L-1; 5: + EPT 50 mg·L-1; 6: Mannitol 30 mmol· L-1,*P<0. 05,**P<0. 01 vs Glucose group.
3.4 EPT对高糖诱导HUVECs NF-κB p65蛋白表达水平的影响与正常对照组比较,高糖组NF-κB p65蛋白表达明显增加(P<0. 01)。与高糖组比较,不同浓度EPT组HUVECs NF-κB p65蛋白表达呈剂量依赖性降低(P<0. 05或P<0. 01)。渗透压对HUVECs NF-κB p65蛋白表达影响不大(Fig 4)。
3.5 EPT对高糖诱导HUVECs NF-κB核移位的影响红色荧光为Cy3标记的NF-κB p65蛋白,蓝色荧光为DAPI标记的细胞核双链DNA。与正常对照组比较,高糖组NF-κB p65蛋白在细胞核中存在较多,说明NF-κB被激活,发生核移位(P<0. 01)。与高糖组比较,不同浓度EPT组HUVECs NF-κB p65的激活、核移位呈剂量依赖性降低(P<0. 05或P<0. 01)(Fig 5)。
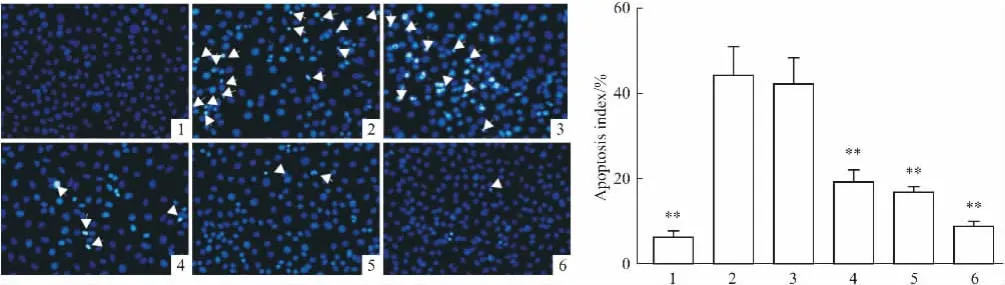
Fig 2 Effect of EPT on high glucose-induced apoptosis in human umbilical vein endothelial cells(±s,n =3)1: Control; 2: Glucose 30 mmol·L-1; 3: + EPT 12.5 mg·L-1; 4: + EPT 25 mg·L-1; 5: + EPT 50 mg·L-1; 6: Mannitol 30 mmol·L-1,**P<0. 01 vs Glucose group.
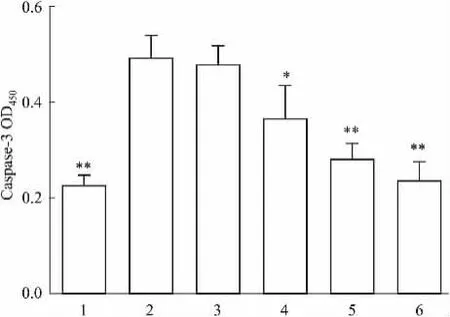
Fig 3 Effect of EPT on high glucose-induced Caspase-3 activity in human umbilical vein endothelial cells(±s,n =3)1: Control; 2: Glucose 30 mmol·L-1; 3: + EPT 12.5 mg·L-1; 4: + EPT 25 mg·L-1; 5: + EPT 50 mg·L-1; 6: Mannitol 30 mmol· L-1,*P<0. 05,**P<0.01 vs Glucose group.
4 讨论
瓜蒌皮是用于治疗心血管疾病的有效中药,《中药志》中有记载瓜蒌皮可“宽胸散结、清化热痰,用治痰热咳嗽、心胸闷痛”[6]。动物实验表明,瓜蒌皮提取物能有效降低高脂血症大鼠血液中的TC和LDL-C,改善氧自由基代谢,调节血脂,降低血小板聚集,抑制血栓形成,保护血管内皮[7-8]。我们前期实验也证明,瓜蒌皮初提物对ox-LDL诱导的人脐带静脉血管内皮细胞损伤有保护作用,其保护作用与抑制氧化应激,降低ADMA和TNF-α浓度,促进NO的分泌有关[9],同时也初步探讨了初提物对糖尿病大鼠血管内皮的保护作用[3],但其机制尚未清楚。因此,本实验对瓜蒌皮有效成分做进一步分离,利用高糖诱导内皮细胞凋亡模型,对其机制做了进一步探讨。

Fig 4 Effect of EPT on high glucose-induced protein expression of NF-κB p65 in human umbilical vein endothelial cells(±s,n =3)1: Control; 2: Glucose 30 mmol·L-1; 3: + EPT 12.5 mg·L-1; 4: + EPT 25 mg·L-1; 5: + EPT 50 mg·L-1; 6: Mannitol 30 mmol· L-1,*P<0. 05,**P<0. 01 vs Glucose group.

Fig 5 Effect of EPT on high glucose-induced nuclear translocation of NF-κB p65 in human umbilical vein endothelial cells(±s,n =3)1: Control; 2: Glucose 30 mmol·L-1; 3: + EPT 12.5 mg·L-1; 4: + EPT 25 mg·L-1; 5: + EPT 50 mg·L-1;6: Mannitol 30 mmol·L-1,*P<0. 05,**P<0. 01 vs Glucose group.
内皮功能障碍是糖尿病血管病变的关键因素之一[10]。研究显示,高糖能诱导内皮细胞凋亡,影响血管内皮完整性,导致血管并发症[11]。本实验表明,体外培养的HUVECs在高糖条件下48 h,细胞活力明显下降,凋亡的细胞数明显增多。高浓度葡萄糖渗透压较高,为避免渗透压对实验的影响,设置了可以造成同等高渗状态的甘露醇组,实验表明高糖诱导的内皮细胞凋亡与其本身的代谢有关,而不是由于细胞外高渗状态刺激引起的。瓜蒌皮提取物干预后,能明显抑制高糖所致的细胞活力下降,并减少内皮细胞的凋亡,提示瓜蒌皮提取物对高糖诱导的内皮细胞凋亡有较好的抑制作用。
NF-κB是具有重要生理功能的转录因子,近年研究表明,NF-κB在糖尿病血管并发症中扮演了重要的角色。Heng等[12]通过建立动脉粥样硬化高脂糖尿病大鼠模型研究发现,模型大鼠胸主动脉NF-κB的mRNA和蛋白表达明显升高,2型糖尿病小鼠冠状动脉内皮功能障碍也与AGE/RAGE信号通路介导的氧化应激激活NF-κB有关[13]。实验证明,NF-κB的激活与氧化应激及细胞凋亡相关[14],同时,龙石银等[15]研究证实在H2O2诱导的内皮细胞凋亡中,NF-κB表达升高;间歇性高糖条件下也可诱导内皮细胞凋亡并激活NF-κB信号通路[16]。也有研究发现,在高糖作用下激活的NF-κB还可使COX-2表达上调,促进caspase-3活化诱导内皮细胞凋亡[17]。本研究结果亦表明,高糖处理后,HUVECs NF-κB p65明显从细胞质移位与细胞核内,NF-κB p65蛋白表达量明显增加,凋亡效应分子和执行者caspase-3活性明显增加,细胞凋亡率明显升高。
瓜蒌皮提取物能明显减少高糖诱导的caspase-3活性的增加,同时使NF-κB p65蛋白表达以及NF-κB p65核移位明显下降,并且能减少HUVECs凋亡率。说明瓜蒌皮提取物可能通过抑制核因子NF-κB的活化,降低caspase-3的活性,抑制HUVECs凋亡,从而减轻高糖对内皮细胞的损伤作用,发挥保护血管内皮的作用。然而高糖对内皮细胞的损伤是一个复杂的过程,瓜蒌皮对损伤的保护作用,其相应机制以及临床应用价值都有待进一步深入系统的研究。
(致谢:感谢心血管研究湖南省重点实验室及心脑血管天然药物研究湖南省高校重点实验室对本实验给予的帮助。)
参考文献:
[1]乔进,窦志华,吴峰,等.灵芝多糖联合二甲双胍预防糖尿病大鼠主动脉病变及对VEGF表达的影响[J].中国药理学通报,2014,30(8): 1079-84.
[1]Qiao J,Dou Z H,Wu F,et al.Effect of combination of ganoderma lucidum polysaccharide and metformin onaortic lesions and expression of VEGF in type 2 diabetic rats[J].Chin Pharmacol Bull,2014,30(8): 1079-84.
[2]李爱峰,孙爱玲,柳仁民,张永清.栝楼果皮化学成分研究[J].中药材,2014,(03):428-31.
[2]Li A F,Sun A L,Liu R M,Zhang Y Q.Chemical constituents of trichosanthes kirilowii peels[J].J Chin Med Mat,2014,(03): 428-31.
[3]罗革灵,陈伟利,谷彬,等.瓜蒌皮提取物对糖尿病大鼠血管内皮的保护作用[J].中国心血管病研究,2009,7(7): 549 -51.
[3]Luo G L,Chen W L,Gu B,et al.Protective effect of the extract of pericarpium trichosanthes against damages of the endothefim in diabetic rats[J].Chin J Cardiov Res,2009,7(7):549-51.
[4]许慧琴,农伟虎,刘成鼎,等.山茱萸最佳配伍组分对高糖致ECV304细胞氧化损伤的保护作用[J].中国药理学通报,2011,27(8):1077-9.
[4]Xu H Q,Nong W H,Liu C D,et al.The effect of the best compatibility of components in Fruetus Corni of protecting the oxidative damage of vascular endothelial cells cultured in high glucose medium[J].Chin Pharmacol Bull,2011,27(8):1077-9.
[5]Chen F,Qian L H,Deng B,et al.Resveratrol protects vascular endothelial cells from high glucose-induced apoptosis through inhibition of NADPH oxidase activation-driven oxidative stress[J].CNS Neurosci Ther,2013,19(9):675-81.
[6]中国医学科学院药物研究所.中药志:第3册[M].2版.北京:人民卫生出版社,1984:311.
[6]Institute of Materia,Chinese Academy of Science.History of Chinese Medicine: Volume 3[M].Version 2.Beijing: People' s medical publishing house,1984:311.
[7]王冬梅,代世元,芦丽莉,等.瓜蒌皮提取物对大鼠动脉粥样硬化保护作用的实验研究[J].北华大学学报(自然科学版),2008,9(02):128-31.
[7]Wang D M,Dai S Y,Lu L L,et al.Experimental studies on protective effect of EPT on atherosclerosis in mice[J].J Beihua Univ(Nat Sci),2008,9(02):128-31.
[8]芦丽莉,王冬梅.瓜蒌皮提取液对实验性高脂血症大鼠血清
NO,SOD,MDA的影响[J].北华大学学报(自然科学版),2008,9(5):423-5.
[8]Lu L L,Wang D M.Effects of extract of trichosanthes Kirilowii Pericarp(ETP)on serum NO,SOD and MDA of rats with hyperlipoidemi[J].J Beihua Univ(Nat Sci),2008,9(5):423-5.
[9]谭斌,刘韵,谷彬,等.瓜蒌皮提取物对人脐带静脉内皮细胞损伤的保护作用[J].中国心血管病研究,2010,8(9): 706 -9.
[9]Tan B,Liu Y,Gu B,et al.Protective effect of EPT against damages of the human umbilicus vein endothelial cells[J].Chin J Cardiovasc Res,2010,8(9):706-9.
[10]何敏,徐济良,吴锋.2型糖尿病大鼠主动脉内皮细胞氧化损伤及缬沙坦的保护作用[J].中国药理学通报,2007,23(3):354-8.
[10]He M,Xu JL,Wu F.Aortic endothelial cells injury induced by ox idative stress in type 2 d iabetes rats and the protective effect of valsartan[J].Chin Pharmacol Bull,2007,23(3):354-8.
[11]He Y,Wang N,Shen Y,et al.Inhibition of high glucose-induced apoptosis by uncoupling protein 2 in human umbilical vein endothelial cells[J].Int J Mol Med,2014,33(5): 1275-81.
[12]Heng X P,Huang S P,Cheng X L,et al.Research of Dangua Recipe on intervening the glycolipid metabolism and oxidative stress in diabetic rats with atherosclerosis[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2013,33(2):244-51.
[13]Gao X,Zhang H,Schmidt A M,et al.AGE/RAGE produces endothelial dysfunction in coronary arterioles in type 2 diabetic mice [J].Am J Physiol Heart Circ Physiol,2008,295(2):491-8.
[14]Yang R H,Lin J,Hou X H,et al.Effect of docosahexaenoic acid on hippocampal neurons in high-glucose condition: involvement of PI3K/AKT/nuclear factor-kappaB-mediated inflammatory pathways[J].Neuroscience,2014,274: 218-28.
[15]龙石银,张彩平,高细强,等.NF-κB/IκB在二苯乙烯苷抑制过氧化氢诱导内皮细胞凋亡中的表达变化[J].中国药理学通报,2011,27(10):1353-7.
[15]Long S Y,Zhang C P,Gao X Q,et al.Effects of 2,3,5,4'-tetrahydroxy-stilbene-2-O-β-D-glucoside on the expression of NF-κB/IκB and apoptosis of HUVECs induced by H2O2[J].Chin Pharmacol Bull,2011,27(10): 1353-7.
[16]Chen G,Chen Y F,Chen H F,et al.The effect of NF-κB pathway on proliferation and apoptosis of human umbilical vein endothelial cells induced by intermittent high glucose[J].Mol Cell Biochem,2011,347:127-33.
[17]Sheu M L,Ho F M,Yang R S,et al.High glucose induces human endothelial cell apoptosis through a phosphoinositide 3-kinaseregulated cyclooxygenase-2 pathway[J].Arterioscler Thromb Vasc Biol,2005,25(3): 539-45.
Effects of extractive pericarpium trichosanthes on apoptosis of HUVECs induced by high glucose
LIU Si-yu,GU Bin,LU Xin-Hua,WANG Jun-jie,TAN Bin
(Dept of Pharmacology,Xiangnan University,Chenzhou Hunan 423000,China)
Abstract:Aim To study the inhibitory effects of extractive pericarpium trichosanthes(EPT)on high glucose-induced apoptosis in human umbilical vein endothelial cells(HUVECs)and its underlining mechanisms.Methods HUVECs were cultured.Effects of EPT at different concentrations on the high-glucose-induced apoptosis in HUVECs were observed.The cell viability of HUVECs was determined by MTT colorimetric method.Cell apoptosis was identified by Hoechst staining.The intracellular activity of Caspase-3 was detected with colorimetry.Protein expression and p65 nuclear translocation of NF-κB were detected by Western blot and immunofluorescence staining.Results Treated with 30 mmol·L-1glucose for 48 hours had a significantly decrease on cell viability compared with control,and the apoptotic rate and Caspase-3 activity were increased markedly,the protein expression of NF-κB was upregulated and p65 nuclear translocation in HUVECs increased; Pre-incubation with EPT(12. 5,25,50 mg·L-1)for 1 hour enhanced the cell viability,and decreased the apoptotic rate and Caspase-3 activity and downregulated the expression of NF-κB in a dose-dependent manner.Moreover,EPT could inhibit p65 translocation.Conclusion EPT can protect HUVECs against the apoptosis induced by high glucose in vitro,and its mechanism may be related with downregulation of NF-κB expression and inhibition of the intracellular activity of Caspase-3.
Key words:extractive pericarpium trichosanthes(EPT); high glucose; HUVECs; apoptosis; NF-κB; Caspase-3; MTT
作者简介:刘思妤(1981-),女,博士生,讲师,研究方向:心血管及中药药理学,Tel: 0735-2653160,E-mail: siruner @ 163.com;
基金项目:湖南省中医药管理局重点基金项目(No 201227);湖南省卫生厅科研基金项目(No B2011-073);湖南省教育厅十二·五重点建设学科基金项目资助(No湘教发[2011]76 号);湖南省心脑血管天然药物研究重点实验室基金项目资助(No湘教通[2008]246号)
收稿日期:2015-04-07,修回日期:2015-05-06
文献标志码:A
文章编号:1001-1978(2015)07-0988-06
doi:10.3969/j.issn.1001-1978.2015.07.020