缺氧预处理诱导大鼠心肌细胞差异表达microRNA的芯片筛选与生物信息学分析
何淑芳,朱海娟,程 洁,许士进,杨 婉,张 野(安徽医科大学第二附属医院麻醉科,安徽合肥 230601)
缺氧预处理诱导大鼠心肌细胞差异表达microRNA的芯片筛选与生物信息学分析
何淑芳,朱海娟,程洁,许士进,杨婉,张野
(安徽医科大学第二附属医院麻醉科,安徽合肥230601)
中国图书分类号: R-332; R322.11; R342.2; R394. 2; R845. 22
摘要:目的筛选缺氧预处理(hypoxia preconditioning,HPC)诱导成年大鼠心肌细胞差异表达的microRNA(miRNA),并预测分析miRNA调控的靶基因与功能。方法体外分离培养成年大鼠心室肌细胞,分为对照组(CON)和缺氧预处理组(HPC),CON组细胞正常培养,HPC组细胞经历10 min缺氧和30 min再给氧,提取心肌细胞总RNA,行miRNA芯片筛选,qRT-PCR验证芯片结果。利用软件预测差异表达miRNA调控的靶基因,分析靶基因富集的基因功能(gene ontology,GO)和信号通路(pathway)。结果与CON组相比,HPC可诱导大鼠心肌细胞miRNA表达谱发生明显改变,共有12 个miRNA上调,14个miRNA下调(P<0. 01,FDR<0. 05);选择其中荧光信号值>500的7个miRNA,用于生物信息学分析。qRT-PCR检测miR-133b-5p、miR-664-1-5p、miR-6216水平,变化趋势与芯片结果一致。生物信息学分析显示差异表达miRNA所调控的靶基因功能明显富集于27个GO和6条信号通路。结论HPC可诱导成年大鼠心肌细胞miRNA表达谱明显改变,这些差异表达miRNA可能通过调控靶基因参与HPC介导的心肌细胞保护作用。
关键词:心肌细胞;成年大鼠;缺氧预处理; microRNA;芯片;生物信息学
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.011.html
张野(1968-),男,博士,教授,主任医师,博士生导师,研究方向:麻醉药理学,通讯作者,Tel: 0551-63869480,E-mail: zhangye_hassan@ sina.com
缺血性心脏病严重危害人类健康,在全球前10位死亡原因中居于首位[1]。心肌缺血导致急性心肌梗死后,尽早通过溶栓、冠状动脉介入或搭桥手术等方法恢复缺血心肌组织灌注是最有效的治疗措施,然而再灌注本身会引起心肌缺血/再灌注损伤(ischemia reperfusion injury,IRI),不但降低再灌注的临床疗效,而且可能增加急性心肌梗死后的死亡率和心力衰竭发生率。如何预防或减轻心肌IRI,已成为目前心脏病学领域的研究热点。
自1986年Murry等[2]提出缺血预处理(ischemic preconditioning,IPC)的概念以来,大量研究已经证实了IPC的心肌保护作用,但其确切机制仍不清楚。microRNA(miRNA)是一类由18~25个核苷酸组成的小分子RNA,在转录后水平调节靶基因的表达,参与各种疾病病理生理过程。近年研究表明miRNA通过调控心肌细胞的凋亡或氧化应激,在心肌缺血、再灌注、预处理等过程中均发挥重要作用[3]。心肌细胞缺氧预处理(hypoxia preconditioning,HPC)可以模拟体内IPC,有助于心肌细胞对抗之后更严重的缺氧性损伤,抑制心肌细胞凋亡[4],是体外研究IPC作用与机制的重要手段。本研究利用miRNA芯片研究HPC对成年大鼠心肌细胞miRNA表达谱的影响并分析其靶基因功能,拟从miRNA水平初步探讨IPC保护心肌IRI的作用机制。
1 材料
1.1实验动物清洁级成年♂SD大鼠购自江苏大学实验动物中心(合格证批号: SCXK(苏)2009-0002)。
1.2主要试剂及仪器M199培养基、TRIzol(Invitrogen),DMEM(Dulbecco's modified eagle medium)培养基(Gibco)购自Life Technologies公司;新生牛血清(NBS)购自杭州四季青公司; 2,3-Butanedione monoxine(BDM)、Insulin-transferring-selenium(ITS)、牛血清白蛋白(BSA)购自Sigma公司; All-in-OneTMmiRNA qRT-PCR Detection Kit(AQMD-020)及miRNA引物购于广州复能基因公司; microRNA微阵列芯片由LC Sciences公司提供。主要仪器包括缺氧小室(加拿大Stem Cell公司); Langendorff离体心脏灌流装置(淮北正华生物仪器设备有限公司); Agilent Bioanalyzer 2100,Mx3000PTMReal Time PCR扩增仪(美国Agilent公司)等。
2 方法
2.1分离培养正常大鼠心室肌细胞参照文献[5]并加以改进分离成年大鼠心室肌细胞。正常大鼠断头处死后取出心脏,主动脉逆行插管,经Langendorff灌流、Ⅱ型胶原酶消化、梯度复钙、差速贴壁等步骤获得钙耐受的活细胞,杆状细胞率>80%。分离成功的细胞置于5% CO2、37℃培养箱内,在含ITS、BDM、BSA的M199培养基内进行培养。
2.2心肌细胞缺氧预处理原代培养大鼠心肌细胞分为2组,每组4例(n =4):对照组(CON)、缺氧预处理组(HPC)。HPC组心肌细胞培养液更换为低糖(5 mmol·L-1)、无血清DMEM,置于缺氧小室中,并冲入95% N2+ 5% CO2以驱走O2造成缺氧环境,将密闭的缺氧小室放入培养箱,37℃下缺氧培养10 min,随后更换含10% NBS的高糖(25 mmol ·L-1)DMEM培养液,5% CO2、95 %空气、37℃培养30 min。对照组细胞在含10% NBS的高糖DMEM培养液中正常培养。预处理后即刻收集心肌细胞,提取RNA用于miRNA芯片分析。
2.3 microRNA芯片检测分析心肌细胞给予HPC后,立即收集心肌细胞,TRIzol试剂提取各组细胞总RNA,采用Agilent Bioanalyzer 2100鉴定RNA的纯度和质量。利用YM-100微离心滤器将RNA样品进行大小分别,取5 μg小RNA(<300nt),用Poly(A)聚合酶在总RNA 3'端加上Poly(A)尾,并进行荧光标记。杂交反应在uParaflo微流体芯片上过夜进行。检测探针均使用PGR(photogenerated reagent)化学法进行原位合成。RNA与探针杂交后,与标记特异结合的Cy3染料在微流体芯片上循环流动进行染色。利用激光扫描仪(GenePix 4000B,Molecular Device)采集杂交图像,使用Array-Pro图像分析软件进行图像数字化转换,并使用LOWESS过滤(Locally-Weighted Regression)进行信号归一化。使用genecluster2.0和Cluster3.0分析软件进行聚类分析(此部分实验由杭州LC Sciences生物技术有限公司完成)。
2.4荧光定量RT-PCR验证芯片结果选取芯片中显著差异表达的miRNA进行验证。miR-133b-5p、miR-6216、miR-664-1-5p以及内参U6的扩增引物购自广州复能基因公司(序列保密)。按照Allin-OneTMmiRNA qRT-PCR试剂盒说明书,PolyA加尾法逆转录RNA,PCR程序设定为:95℃10 min变性,95℃10 s、60℃20 s、72℃10 s重复40个循环进行扩增;熔解曲线程序采用Agilent仪器默认程序。反应结束仪器自动生成CT值(threshold cycles,CT)及熔解曲线图。熔解曲线呈单一锐利主峰说明PCR产物单一,扩增反应特异性好。每个样本设3个重复管,同时设无模板阴性对照(NTC)。2-△△CT法计算实验组相对于空白对照组的miRNA表达的差异倍数[6]。
2.5靶基因预测与功能显著性分析采用miRNA生物信息学软件TargetScan、miRanda对芯片检测的差异表达miRNA(信号值>500且P<0. 01)进行靶基因的预测,选择两种软件交集的靶基因。基于GO(Gene ontology)数据库,应用DAVID软件根据靶基因的基因功能富集程度(enrichment P-value),进行GO显著性分析;基于KEGG(Kyoto Encyclopedia of Gene and Genomes)数据库,应用DAVID软件根据靶基因在信号通路中的富集程度,进行Pathway显著性分析。计算P值,并根据P值排序计算FDR 值(false discovery rate)[7]。
2.6统计学处理采用SPSS10. 0软件进行数据分析。计量资料以±s表示,组间比较采用t检验。生物信息学数据分析采用Fisher精确检验和卡方检验进行统计。
3 结果
3.1 RNA纯度及质量鉴定各组RNA样本的OD260/OD280比值均在1. 8~2. 0之间,RIN≥7. 0,28S/18S≥0. 7,28S rRNA和18S rRNA条带清晰,5S rRNA条带较弱,说明RNA样品完整性好,纯度高,无明显降解,可以用于后续芯片检测实验。见Fig 1。
3.2 miRNA表达谱差异及聚类分析miRNA芯片结果显示,与CON组相比,HPC组共有26个miRNA表达发生明显变化(P<0. 01,FDR<0. 05),其中12个miRNA上调,14个miRNA下调,明显差异表达miRNA的聚类分析结果见Fig 2。荧光信号值>500的miRNA中,2个miRNA(miR-133b-5p,let-7d-5p)明显上调,5个miRNA(miR-664-1-5p,-6216,-6215,30a-5p,30e-5p)明显下调(P<0. 01,FDR<0.05)。见Tab 1。
3.3荧光定量RT-PCR验证差异表达miRNA为了验证miRNA芯片结果,选择差异表达最为明显的miR-133b-5p、miR-664-1-5p、miR-6216进行验证,利用荧光定量RT-PCR法检测CON与HPC组3种miRNA差异表达情况。结果表明HPC组miR-133b-5p、miR-664-1-5p、miR-6216表达趋势与芯片结果一致,但变化倍数不同。见Fig 3。

Fig 1 Qualification of total RNA by bioanalyzer The representative analysis results of total RNA in(A)Control group and(B)hypoxia preconditioning group
Tab 1 Differentially expressed miRNAs between CON and HPC groups(n =4,±s)

Tab 1 Differentially expressed miRNAs between CON and HPC groups(n =4,±s)
CON: cardiomyocytes was cultured in normal condition; HPC: cardiomyocytes were subjected to hypoxia for 10 min followed by 30 min reoxygenation.
Signal valueFold change MiRNAs CON HPC(HPC/CON) P value rno-miR-133b-5p 10170±1013 27852±1208 2.740.0003 rno-let-7d-5p 3451±311 4487±381 1.30 0.008 rno-miR-664-1-5p 9563±976 8200±1049 0.24 <0.0001 rno-miR-6216 1761±262 529±93 0.30 0.0002 rno-miR-6215 2446±96 1715±120 0.70 0.0009 rno-miR-30a-5p 12757±775 10360±312 0.81 0.003 rno-miR-30e-5p 12117±914 9544±271 0.79 0.009
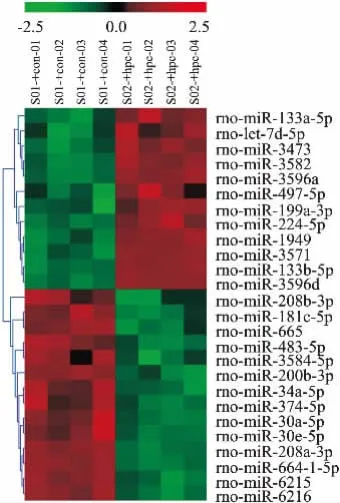
Fig 2 Hierarchical clustering analysis of differentially expressed miRNAs between CON and HPC groups(P<0.01,FDR<0.05,n =4)The colors display miRNA expression variance: red indicates a higher gene expression,green lower expression,and black the median value.
3.4差异表达miRNA靶基因显著富集的GO与Pathway靶基因GO显著性分析结果显示,HPC诱导差异表达miRNA调控的靶基因功能主要富集于27个GO(P<0. 01,Fig 4A)。其中16个GO涉及生物学过程,包括GTP酶活性的正性调控、磷脂酰肌醇去磷酸化、周期依赖蛋白激酶活性调节、细胞膜融合等;5个GO涉及细胞组分,包括肌动蛋白细胞骨架、转录激活复合物、胞核、膜组分、细胞内; 6 个GO涉及分子功能,包括泛素特异性蛋白酶活性、半胱氨酸肽酶活性、氨基酸连接酶活性、RNA聚合酶Ⅱ调控转录因子活性等。Pathway显著性分析显示靶基因明显富集于6条信号通路(P<0. 05,Fig 4B),分别为Toll样受体信号通路、MAPK信号通路、Chagas疾病通路、醛固酮调节的钠重吸收通路、RIG-I样受体信号通路、TGF-β信号通路。

Fig 3 Validation of miRNAs microarray data via qRT-PCR(±s,n =3)The relative expression value of miR-133b-5p,miR-664-1-5p and miR-6216 were normalized to U6 RNA level.*P<0.05 vs CON group.
4 讨论
miRNA是近年来新发现的一类内源性小分子非编码RNA,其结合于mRNA的3’UTR区域,通过诱导mRNA的降解、翻译抑制等形式,在转录后水平调节靶基因的表达,参与调控细胞增殖、分化、凋亡、代谢等多种生物学过程。研究人员发现在心脏缺血/再灌注过程中很多miRNA发生改变,并推测在预处理过程中发生改变的miRNA可能对抗心肌缺血/再灌注损伤,发挥心肌保护作用[8]。
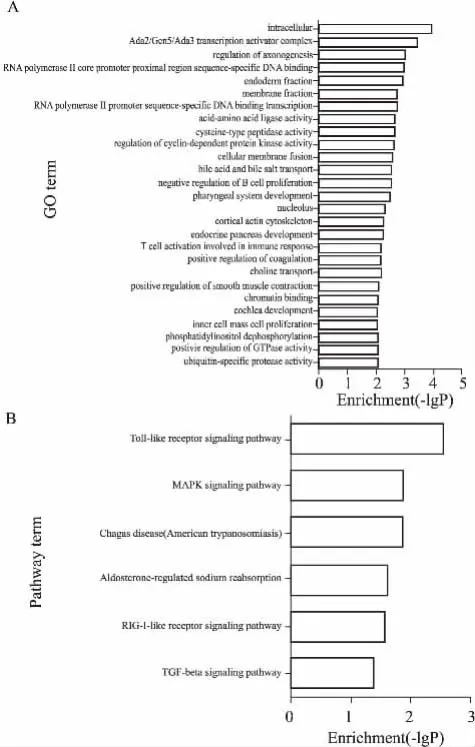
Fig 4 GO and KEGG pathway analysis ondifferentially expressed miRNAsA: 27 GO terms enriched in hypoxia preconditioning; B: 6 KEGG pathways enriched in hypoxia preconditioning.The -lgP is the negative logarithm of the P-value.
我们前期研究发现缺氧10 min/复氧30 min的预处理可以减轻大鼠心肌细胞缺氧/复氧损伤,抑制心肌细胞凋亡[9]。本研究利用miRNA芯片技术,筛选HPC诱导大鼠心肌细胞差异表达的miRNA,miRNA表达谱芯片技术一种新型高通量、广谱的基因筛选方法,具有较高的特异性和敏感性。我们通过芯片筛选发现,HPC诱导大鼠心肌细胞中共26个miRNA发生明显改变,选择差异表达最为显著的miR-133b-5p、miR-664-1-5p、miR-6216进行qRTPCR检测验证,结果与芯片结果基本一致,说明芯片检测结果准确可靠。在这些明显差异表达的miRNA中,miR-133b与miR-133a同属于miR-133家族,两者具有很高的同源性,已知miR-133a具有抗心肌细胞凋亡作用,在心肌IRI过程中表达下调但可被IPC上调[10],然而miR-133b在心肌细胞凋亡中的作用机制尚不明确。miR-30家族也在心血管疾病中发挥重要作用,最新研究发现,大鼠心肌梗死诱导miR-30家族表达上调,抑制miR-30家族表达可以对抗心肌缺血后损伤,发挥心肌保护作用。而其他miRNA如miR-664-1-5p、let-7d-5p、miR-6216、miR-6215等在心肌缺血/再灌注过程中的作用尚未见报道。
miRNA芯片检测结合生物信息学分析有助于更好地了解miRNA调控的靶基因功能与涉及的信号通路,可以提高芯片分析的研究效率和准确性。我们同时利用Targetscan、miRanda两个靶基因预测软件预测差异表达miRNA可能调控的靶基因,并选择两种软件交集的靶基因,以避免单一软件预测的假阳性。通过对靶基因所富集的GO(基因功能)和Pathway(信号通路)进行分析,发现HPC诱导差异表达miRNA所调控的靶基因功能明显富集于27个GO,主要涉及细胞周期调控、激酶活性、细胞信号转导、细胞泛素化调节、转录因子活性调节等。靶基因投射的6条信号通路中,已知Toll样受体信号通路通过调节免疫和炎症反应,在心肌缺血/再灌注损伤中发挥至关重要的作用[11-12]; MAPK信号通路参与调控心肌细胞凋亡[13-14]、TGF-β信号通路在心肌梗死后重塑和心肌纤维化中发挥重要作用[15];而其他3条信号通路在心肌缺血/再灌注损伤中的作用尚不明确。
综上所述,本研究利用miRNA表达谱芯片及生物信息学技术,筛选出HPC诱导心肌细胞明显差异表达的miRNA,并对其调控的靶基因和信号通路进行预测分析,从miRNA角度初步探讨了HPC发挥心肌细胞保护作用的可能机制,为进一步深入研究HPC的miRNA调控机制提供了基础。
参考文献:
[1]Parlakpinar H,Ozer M,Acet A.Effects of captopril and angiotensin II receptor blockers(AT1,AT2)on myocardial ischemiareperfusion induced infarct size[J].Cytokine,2011,56(3): 688-94.
[2]Murry C E,Jennings R B,Reimer K A.Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J].Circulat,1986,74(5): 1124-36.
[3]Salloum F N,Yin C,Kukreja R C.Role of microRNAs in cardiac preconditioning[J].J Cardiovasc Pharmacol,2010,56(6):581-8.
[4]黄杰,郑宏.缺氧预处理在心肌保护中的作用机制[J].临床麻醉学杂志,2012,28(10): 1019-21.
[4]Huang J,Zheng H.Mechanisms of hypoxia preconditioning in cardioprotection[J].J Clin Anesthesiol,2012,28(10): 1019-21.
[5]Louch W E,Sheehan K A,Wolska B M.Methods in cardiomyocyte isolation,culture,and gene transfer[J].J Mol Cell Cardiol,2011,51(3): 288-98.
[6]李覃,王伟,张实,等.白藜芦醇调节STAT3与miR-21表达抗肝癌作用的初步研究[J].中国药理学通报,2014,30(2): 186-91.
[6]Li T,Wang W,Zhang S,et al.Effect of resveratrol on hepatocellular carcinoma by regulating STAT3 and miR-21[J].Chin Pharmacol Bull,2014,30(2): 186-91.
[7]Benjamini Y,Drai D,Elmer G,et al.Controlling the false discovery rate in behavior genetics research[J].Behav Brain Res,2001,125(1-2): 279-84.
[8]Salloum F N,Yin C,Kukreja R C,et al.Role of microRNAs in cardiac preconditioning[J].J Cardiovasc Pharmacol,2010,56(6): 581-8.
[9]吴昊,何淑芳,朱海娟,等.阿片受体,PI3K/Akt和ERK信号通路在瑞芬太尼预处理减轻大鼠心肌细胞缺氧/复氧损伤中的作用[J].中华麻醉学杂志,2013,33(9): 1117-20.
[9]Wu H,He S F,Zhu H J,et al.Role of opioid receptors and PI3K/Akt and ERK signaling pathways in reduction of hypoxia/reoxygenation-induced injury to cardiomyocytes by remifentanil preconditioning in rats[J].Chin J Anesthesiol,2013,33(9): 1117-20.
[10]He B,Xiao J,Ren A J,et al.Role of miR-1 and miR-133a in myocardial ischemic postconditioning[J].J Biomed Sci,2011,18(1): 22.
[11]Rohde D,Schon C,Boerries M,et al.S100A1 is released from ischemic cardiomyocytes and signals myocardial damage via Tolllike receptor 4[J].EMBO Mol Med,2014,6(6):778-94.
[12]Ha T,Liu L,Kelley J,et al.Toll-like receptors: new players in myocardial ischemia/reperfusion injury[J].Antioxid Redox Signal,2011,15(7): 1875-93.
[13]Becatti M,Taddei N,Cecchi C,et al.SIRT1 modulates MAPK pathways in ischemic-reperfused cardiomyocytes[J].Cell Mol Life Sci,2012,69(13):2245-60.
[14]Wang L,Li X,Zhou Y,et al.Downregulation of miR-133 via MAPK/ERK signaling pathway involved in nicotine-induced cardiomyocyte apoptosis[J].Naunyn Schmiedebergs Arch Pharmacol,2014,387(2):197-206.
[15]Rainer P P,Hao S,Vanhoutte D,et al.Cardiomyocyte-specific transforming growth factor beta suppression blocks neutrophil infiltration,augments multiple cytoprotective cascades,and reduces early mortality after myocardial infarction[J].Circ Res,2014,114(8): 1246-57.
Screening and bioinformatics analysis of differentially expressed miRNAs induced by hypoxia preconditioning in rat cardiomyocytes
HE Shu-fang,ZHU Hai-juan,CHENG Jie,XU Shi-jing,YAN Wan,ZHAGN Ye
(Dept of Anesthesiology,the Second Affiliated Hospital of Anhui Medical University,Hefei 230601,China)
Abstract:Aim To screen the differentially expressed microRNAs(miRNAs)induced by hypoxia preconditioning(HPC)in adult rat cardiomyocytes,and predict miRNAs-regulated target genes and their functions.Methods Cardiomyocytes were isolated from adult rat ventricular myocardium and cultured(in vitro).The cells were divided into 2 groups: control group(CON)and hypoxia preconditioning group(HPC).The cardiomyocytes in HPC group were subjected to 10 min hypoxia followed by 30 min reoxygenation,while the cells in CON group were cultured under normal condition.After that,total RNA was extracted and then subjected to miRNA microarray to screen differentially expressed miRNAs.The microarray results were further validated by quantitative RTPCR(qRT-PCR).Bioinformatics analysis was performed to predict the miRNAs-regulated target genes and analyze the enriched gene ontology(GO)and signaling pathway(Pathway).Results HPC caused significant changes in miRNAs expression in cardiomyocytes as compared to CON group.A total of 12 miRNAs were up-regulated and 14 miRNAs were down-regulated(P<0. 01,FDR<0.05).The differentially expressed 7 miRNAs with a fluorescent signal intensity >500 were selected for further bioinformatics analysis.The expression of miR-133b-5p,miR-664-1-5p and miR-6216 detected by qRT-PCR exhibited the similar patterns of up or down regulation to those shown in microarray results.Bioinformatics analysis revealed that miRNAs-regulated target genes were significantly enriched in 27 GOs and 6 signal pathways.Conclusion
The expression profile of miRNAs in rat cardiomyocytes is significantly affected by HPC.These differentially expressed miRNAs might participate in HPC-induced cardioprotection by regulating their target genes in rat cardiomyocytes.
Key words:cardiomyocytes; adult rat; hypoxia preconditioning; microRNA; microarray; bioinformatics
作者简介:何淑芳(1977-),女,博士,副教授,硕士生导师,研究方向:麻醉药理学,E-mail: hsf77 @163.com;
基金项目:国家自然科学基金课题(No 81200171);安徽省科技厅年度重点项目(No 1301043030);高校省级自然科学研究重大项目(No KJ2014ZD16)
收稿日期:2015-03-15,修回日期:2015-04-30
文献标志码:A
文章编号:1001-1978(2015)07-0940-05
doi:10.3969/j.issn.1001-1978.2015.07.011