4-氨基-2-三氟甲基苯基维甲酸酯对人乳腺癌细胞株MDA-MB-231诱导分化作用及可能的机制研究
雷 静,陈飞虎,葛金芳,李 悦,高文凡,邓子云(安徽医科大学药学院,安徽合肥 230032)
4-氨基-2-三氟甲基苯基维甲酸酯对人乳腺癌细胞株MDA-MB-231诱导分化作用及可能的机制研究
雷静,陈飞虎,葛金芳,李悦,高文凡,邓子云
(安徽医科大学药学院,安徽合肥230032)
中国图书分类号: R329.24; R329.11; R737.902.2; R916.4
摘要:目的观察4-氨基-2-三氟甲基苯基维甲酸酯(4-anino-2-trifluoromethyl-phenyl retimate,ATPR)对人乳腺癌细胞株MDA-MB-231抑制增殖诱导分化作用,探讨其可能的作用机制。方法体外培养人乳腺癌细胞株MDA-MB-231,MTT检测细胞增殖,绘制细胞生长曲线,瑞氏-吉姆萨染色观察细胞形态变化,酶联免疫法检测粘蛋白MUC-1活性,流式细胞术检测细胞周期,实时荧光定量PCR法和Western blot法检测维甲酸受体(retinoic acid receptors,RAR)RARα、RARβ、RARγ和维甲类受体(retinoid X receptors,RXR)RXRα、RXRβ、RXRγ基因和蛋白的表达。结果ATPR能够抑制MDA-MB-231细胞的增殖,具有浓度-时间依赖性,染色后镜下观察MDA-MB-231细胞生长密度降低,形态趋于正常。ELISA结果显示,ATPR作用后明显降低MDA-MB-231细胞培养上清中MUC-1的浓度;流式细胞术结果显示,MDA-MB-231细胞中G0/G1期表达量增加,S期表达量减少,细胞阻滞在G0/G1期比例增加。q-RT-PCR和Western blot结果显示,ATPR作用后,RARγ的mRNA和蛋白表达水平降低,RXRs mRNA和蛋白水平无明显变化。结论ATPR可以抑制人乳腺癌细胞株MDA-MB-231增殖并诱导其分化,其机制可能与RARγ的表达有关。
关键词:全反式维甲酸;4-氨基-2-三氟甲基苯基维甲酸酯;诱导分化; MDA-MB-231细胞;维甲酸受体;维甲类受体;雌激素受体;
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.017.html
陈飞虎(1962-),男,教授,博士生导师,研究方向:分子药理学,通讯作者,Tel: 0551-65161116,E-mail: cfhchina @ sohu.com
维甲酸类化合物在脊椎动物发育、细胞分化和维持机体平衡中发挥着非常广泛的效应,在体内生理活性代谢产物包括全反式维甲酸、13-顺式维甲酸、9-顺式维甲酸,它们可以通过和细胞核内维甲酸受体(RARs)和维甲类受体(RXRs)结合于DNA的应答元件,进而调节靶基因的表达,发挥抑制细胞增殖和诱导分化作用。全反式维甲酸(all trans retinoic acid,ATRA)作为诱导分化剂的代表目前广泛用于急性早幼粒白血病的临床治疗[1],但同时存在维甲酸综合征耐药性等不足限制其进一步临床使用[2-4]。本实验室以ATRA为先导化合物,通过对其碳链末端极性基团进行结构修饰,合成了一系列新的维甲酸衍生物,经过体外药效学筛选发现4-氨基-2-三氟甲基苯基维甲酸酯具有较强的抗肿瘤增殖和诱导分化活性,有望成为一种新型抗肿瘤药。课题组前期研究发现4-氨基-2-三氟甲基苯基维甲酸酯(4-anino-2-trifluoromethyl-phenyl retimate,ATPR)对多种肿瘤细胞具有诱导分化作用[5-8],本实验观察ATPR对人乳腺癌细胞株MDA-MB-231是否具有诱导分化作用,并探究ATPR对维甲酸受体RARs及维甲类受体RXRs表达的影响。
1 材料与方法
1.1材料新型维甲酸衍生物由安徽医科大学药学院合成(Fig 1),纯度为99. 66 %,溶于无水乙醇,配制成1×10-2mol·L-1浓度,-20℃储存备用。高糖DMEM培养液为Hyclone公司产品;胎牛血清购自杭州四季青生物工程材料有限公司;瑞氏-吉姆萨染料购自南京建成生物工程研究所; MUC-1试剂盒为美国R&D公司产品;逆转录试剂盒和PCR试剂盒均为Promage公司产品; q-PCR引物由上海生工生物工程技术服务有限公司合成;实时荧光定量PCR仪,立陶宛Fermentas公司产品;抗RARα、RARβ、RARγ、RXRα、RXRβ、RXRγ抗体购自Santa Cruz公司;β-actin抗体购自北京中杉金桥生物技术有限公司。
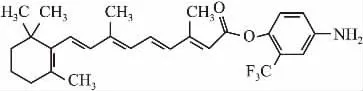
Fig 1 Chemical structure of 4-Amino-2-Trifluoromethyl-Phenyl Retinate(ATPR)
1.2细胞培养MDA-MB-231细胞株购自中科院上海细胞所,采用含10 %胎牛血清(FCS)的DMEM培养液,并加入青霉素105IU·L-1和链霉素100 mg ·L-1的培养体系培养。培养环境为37℃,5 % CO2培养箱,每2天换1次液,取对数生长期细胞进行实验。
1.3 MTT法检测细胞增殖将MDA-MB-231细胞以3×104个/孔的浓度接种于96孔培养板,每孔接种量为100 μL。待细胞贴壁后,分为空白对照组(加入DMEM培养液100 μL)、溶剂对照组(含0. 05 %无水乙醇)、阳性对照组ATRA(10-5mol·L-1)及ATPR(10-4、10-5、10-6、10-7、10-8、10-9mol·L-1)组,每组设6个复孔,每孔的总体积为200 μL。分别于24、48、72、96 h后更换为无血清培养液,并加入MTT(浓度为5 g·L-1)20 μL,继续培养4 h后,弃上清,每孔加入150 μL的DMSO,震荡摇匀,使甲瓒颗粒充分溶解。于酶联免疫检测仪上,以波长490 nm,试剂对照组调零,测吸光度(A490)值,重复3次,取其平均值,并用SPSS计算IC50值。
1.4细胞生长曲线绘制将MDA-MB-231细胞以1×104个/孔的浓度接种于24孔培养板,每孔接种量为1 mL。待细胞贴壁后,实验分组同“1. 3”,将其置于37℃含5 % CO2培养箱中,培养1~7 d。每天进行细胞计数,每个时间点设3个复孔,取其均值,以培养时间为横轴,细胞计数为纵轴,绘制细胞生长曲线。
1.5细胞形态学观察以1×106个/孔的浓度接种于6孔板,每孔加入盖玻片,将细胞悬液滴于盖玻片上,实验分组同1.3,作用72 h收集盖玻片,用PBS冲洗盖玻片,甲醇固定10 min,自然干燥,在盖玻片上依次滴加瑞氏-吉姆萨染料A液和B液,流水冲洗细胞,干燥后在显微镜下观察细胞形态并拍照。
1.6分化标志物MUC-1检测取对数生长期细胞,以1×104个/孔的浓度接种于24孔板,待细胞贴壁后,实验分组同1.3,作用72 h后,收集细胞上清,3 000 r·min-1离心10 min后,参照试剂盒方法检测MUC-1。
1.7细胞周期和DNA倍体分析取对数生长期细胞,以1×106个/孔的浓度接种于6孔板,实验分组同1.3,作用72h后,收集细胞,用PBS洗涤2次,70%冷乙醇-20℃冰箱固定过夜。固定后的细胞离心,弃上清,加入碘化丙啶(PI,终浓度为100 mg· L-1)和RNase(终浓度为50 mg·L-1),4℃避光染色30 min后,在EPICS XL-MCL型流式细胞仪上分析,检测3×104以上细胞,并用ModfitLT软件进行DNA倍体及细胞周期分析。
1.8实时定量荧光逆转录聚合酶链反应(q-RTPCR)检测RARα、RARβ、RARγ、RXRα、RXRβ、RXRγmRNA的表达
1.8.1 RNA提取和逆转录将1×109·L-1细胞接种于培养瓶,实验分为空白对照组(加入DMEM培养液)、溶剂对照组(含0.05%无水乙醇)、阳性对照组ATRA(10-5mol·L-1)及ATPR(10-5mol ·L-1)组,作用72 h后,按TRIzol一步法提取细胞中总RNA,以紫外分光光度计测RNA含量和纯度(RNA在260和280 nm的光密度比值为1. 8~2. 0),以1. 5%琼脂糖凝胶电泳鉴定其完整性(28S 和18SRNA条带比值I>2. 0),用5 μg总RNA为模板,逆转录成cDNA。
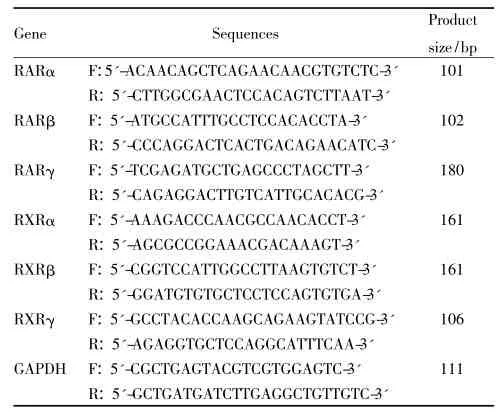
Tab 1 Oligonucleotide primer sequences used for q-RT-PCR analysis
1.8.2 q-RT-PCR将cDNA用无酶水稀释10倍,上、下游引物各稀释10倍后,按以下体系将反应物加至q-RT-PCR反应板中,每组至少3个复孔,冰上操作: Syber green I: 5 μL; cDNA: 0. 5 μL; P1: 0. 3 μL; P2:0. 3 μL;无酶水: 3. 9 μL共10 μL体系。反应条件1:预变性95℃,10 min;变性95℃15 s;反应条件2:退火95℃15 s;60℃30 s;延伸72℃30 s,45个循环后,延伸7℃230 s。扩增反应结束后取出96孔反应板,关闭仪器,分析数据,若观察到各基因熔解曲线为锐利的单一峰,说明扩增序列特异性强,定量准确。
1.9 Western blot检测RARα、RARβ、RARγ、RXRα、RXRβ、RXRγ蛋白的表达将1×109·L-1细胞接种于培养瓶中,实验分组同“1. 8. 1”,作用72 h后,弃培养液,用预冷的PBS洗3遍,每瓶加入400μL RIPA裂解液(含10 % PMSF)裂解30 min,用细胞刮快速将细胞转入1. 5 mL EP管中,离心取上清,用BCA蛋白定量试剂盒进行定量。将上清与上样缓冲液按4∶1进行分装,100℃煮10 min变性,-80℃保存待用。等量的蛋白样品进行SDSPAGE,将电泳分离的蛋白转移到PVDF膜上。TBST洗膜10 min,室温下用含5 %的脱脂奶粉(TBST溶解)封闭3 h,随后加入一抗(1∶300)4℃孵育过夜,TBST洗脱4次,加入相应的二抗孵育1 h,用TBST漂洗4次,将PVDF膜用化学发光剂染色1 min。
2 结果
2.1 ATPR对MDA-MB-231细胞增殖的影响如Tab 2所示,与空白对照组相比,溶剂对照组A490变化不明显,表明无水乙醇(0.05 %)作为溶剂对细胞增殖无影响,因此可排除无水乙醇对本实验的影响。显微镜下观察各组细胞发现,与溶剂对照组比较,ATPR(10-4mol·L-1)体外给药24 h时即对MDA-MB-231细胞的增殖产生明显影响,细胞形态皱缩,细胞凋亡; ATPR(10-5、10-6、10-7、10-8、10-9mol·L-1)体外给药24 h时对MDA-MB-231细胞增殖并无明显影响,但作用48、72和96 h后,ATPR(10-5、10-6、10-7、10-8、10-9mol·L-1)对细胞增殖均具有不同程度的抑制作用。如Fig 2所示,72 h时ATPR对MDA-MB-231细胞抑制作用的IC50值最低。
Tab 2 Effects of ATPR on the proliferation of MDA-MB-231 cells(±s,n =3)

Tab 2 Effects of ATPR on the proliferation of MDA-MB-231 cells(±s,n =3)
**P<0.05,**P<0.01 vs the solvent group.
Concentration/A490 Group-124 h 48 h 72 h 96 h mol·L Control 0.303±0.02 0.537±0.055 0.867±0.0690.942±0.043 Solvent 0.329±0.04 0.535±0.041 0.972±0.023 0.951±0.040 ATPR 10-4 0.081±0.016**0.079±0.018**0.088±0.009**0.070±0.06**10-5 0.325±0.038 0.477±0.036*0.584±0.068**0.668±0.104*10-6 0.349±0.050 0.489±0.055* 0.606±0.018**0.735±0.074* 10-7 0.362±0.030 0.552±0.049 0.604±0.084* 0.772±0.112 10-8 0.359±0.047 0.563±0.067 0.764±0.044 0.851±0.091 10-9 0.363±0.034 0.597±0.068 0.789±0.104 0.914±0.103 ATRA 10-5 0.331±0.038 0.463±0.03** 0.578±0.074**0.642±0.073
3.2 MDA-MB-231细胞生长曲线绘制台盼蓝染色后绘制细胞生长曲线,结果如Fig 3所示,与溶剂对照组比较,ATPR浓度越大,细胞生长曲线越低平,其中10-5mol·L-1ATPR对MDA-MB-231细胞增殖的抑制作用最强,用药后24h开始出现抑制作用,并且在72 h抑制作用最明显,说明ATPR对MDAMB-231细胞的抑制作用具有浓度-时间依赖性。

Fig 2 ATPR inhibits the half inhibition concentration(IC50)in MDA-MB-231 cells(±s,n =3)

Fig 3 Growth curves of MDA-MB-231 cells treated with ATPR(±s,n =3)**P<0. 01 vs the solvent group.
2.3细胞形态学观察不同浓度ATPR作用后,MDA-MB-231细胞形态学变化如Fig 4所示,正常组细胞生长密度大,细胞形态不规则,ATPR用药后细胞生长密度降低,核质比降低,细胞形态规则,细胞形态随药物浓度增加改变越明显。
2.4分化标志物MUC-1的检测ATPR作用后观察MDA-MB-231细胞上清中MUC-1的变化,结果如Tab 3所示,与溶剂对照组相比,MUC-1含量随ATPR浓度的升高而下降,ATPR浓度为10-5mol·L-1时MUC-1含量下降最明显,差异具有统计学意义。
2.5 MDA-MB-231细胞周期变化如Fig 5所示,FCM检测细胞周期显示,与溶剂对照组相比,ATRA(10-5mol·L-1)和ATPR(10-5、10-6mol·L-1)用药后,G0/G1期细胞百分比上升,S期细胞百分比下降,差异有统计学意义(P<0. 05); G2/M期细胞改变不明显。结果表明ATPR影响MDA-MB-231细胞周期,将细胞阻滞在G0/G1期。

Fig 4 Effect of ATPR on the morphological changes of MDA-MB-231 cells after 72h(400×)1: Control;2: Solvent;3: ATPR(10-5mol·L-1);4: ATPR(10-6mol·L-1); 5: ATPR(10-7mol·L-1); 6: ATPR(10-8mol·L-1); 7: ATPR(10-9mol·L-1);8: ATRA(10-5mol·L-1).

Fig 5 Change of cell cycle distribution of MDA-MB-231 cells treated with ATPR(n =3,±s)1: Control;2: Solvent;3: ATPR(10-5mol·L-1);4: ATPR(10-6mol·L-1);5: ATPR(10-7mol/L);6: ATPR(10-8mol·L-1);7: ATPR(10-9mol·L-1);8: ATRA(10-5mol·L-1),*P<0.05,**P<0. 01 vs the solvent group.
Tab 3 Effect of ATPR on the concentration of mucin 1(MUC-1)(±s,n =3)

Tab 3 Effect of ATPR on the concentration of mucin 1(MUC-1)(±s,n =3)
*P<0. 05,**P<0. 01 vs the solvent group.
Group Concentration/mol·L-1 MUC-1/kU·L-1Control - 61.49±1.66 Solvent - 61.00±1.28 ATPR 10-5 43.87±1.37**10-6 51.31±2.22*10-7 54.08±3.39 10-8 57.55±3.59 10-9 59.47±1.48 ATRA 10-5 44.08±2.25
2.6 RARα、RARβ、RARγ、RXRα、RXRβ、RXRγ mRNA的表达结果如Fig 6所示,与溶剂对照组相比,ATPR(10-5mol·L-1)作用后,RARα、RARβ mRNA表达无明显变化,RARγ mRNA表达下降,RXRα、RXRβ、RXRγ mRNA表达无明显变化。提示ATPR用药后MDA-MB-231细胞RARγ mRNA表达下降。
2.7 RARα、RARβ、RARγ、RXRα、RXRβ、RXRγ蛋白的表达结果如Fig 7所示,与溶剂对照组相比,ATPR(10-5mol·L-1)作用后,RARα、RARβ蛋白表达无明显变化,RARγ蛋白表达下降,RXRα、RXRβ、RXRγ蛋白表达无明显变化。提示ATPR用药后MDA-MB-231细胞RARγ蛋白表达下降。
3 讨论
乳腺癌是女性最常见的恶性肿瘤,目前对乳腺癌的治疗手段包括手术治疗、全身化疗、放射治疗及内分泌治疗等[9]。放化疗通常不具有选择性,既能杀死肿瘤细胞,又杀死了大量的正常细胞。20世纪80年代Sachs[10]发现在一些抑制增殖和诱导分化的物质作用下,小鼠白血病细胞系的异常分化是可逆的,由此提出了诱导分化治疗的概念。诱导分化治疗的基本特点是不直接杀伤肿瘤细胞,而是诱导其分化为正常或接近正常的细胞,减慢肿瘤细胞增殖速度,最终使恶性肿瘤缓解,从而避免常规放、化疗所引起的骨髓抑制、免疫抑制等毒副作用[11]。全反式维甲酸作为经典的诱导分化剂,已广泛应用于急性早幼粒白血病的临床治疗,但ATRA存在一系列的问题,如维甲酸综合征耐药等影响其疗效,本课题组以ATRA为先导化合物,合成的维甲酸衍生物ATPR对多种肿瘤细胞株具有抑制增殖诱导分化作用,前期研究发现,ATPR对雌激素受体阳性人乳腺癌细胞株MCF-7具有诱导分化作用,本实验探讨在雌激素受体阴性人乳腺癌细胞株MDA-MB-231上,ATPR对其是否具有诱导分化作用?实验结果表明,ATPR抑制MDA-MB-231细胞的增殖存在浓度-时间依赖性行为。

Fig 6 Effect of ATPR on the mRNA expression of retinoic acid receptors(RARs)and Retinoid X acid receptor(RXRs)in MDAMB-231 cells(n =3,±s)1: Control; 2: Solvent; 3: ATRA(10-5mol·L-1); 4: ATPR(10-5mol·L-1).**P<0. 01 vs the solvent group.
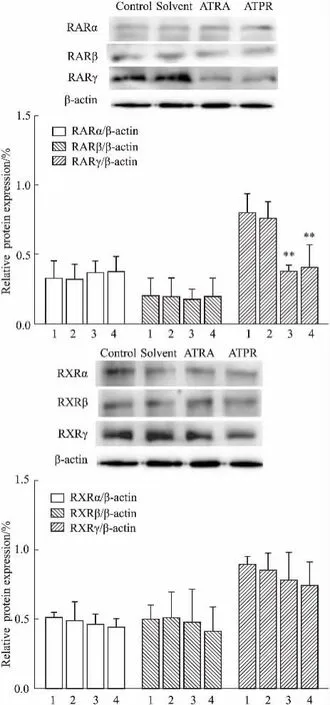
Fig 7 Effect of ATPR on the proteins expression of retinoic acid receptors(RARs)and retinoid X receptors(RXRs)in MDA-MB-231 cells(n =3,±s)1: Control;2: Solvent; 3: ATRA(10-5mol·L-1); 4: ATPR(10-5mol·L-1).**P<0. 01 vs the solvent group.
细胞分化主要表现在形态和功能两个方面,形态分化是细胞分化的基本特征。瑞氏-吉姆萨染色结果显示,MDA-MB-231细胞经ATPR处理后形态发生改变,细胞生长密度下降,核质比降低。MUC-1是一种在上皮性肿瘤高度或异常表达的膜糖蛋白,常作为乳腺癌细胞分化程度的一个重要指标[12]。研究发现,ATPR作用后,MDA-MB-231细胞分泌MUC-1含量为(43. 87±1. 37)kU·L-1,较溶剂对照组(61. 00±1. 28)kU·L-1差异有显著性。细胞形态学的改变和分化标志物MUC-1含量的变化都说明ATPR对MDA-MB-231细胞具有诱导分化作用。
肿瘤细胞的周期学特点是细胞群体主要分布于DNA合成活跃S期,而分化细胞群体主要分布于DNA合成静止的G1/G0期。因此细胞周期不可逆的阻滞于G0/G1期是细胞分化的重要特征。本研究结果显示,MDA-MB-231细胞周期发生明显改变,G0/G1期的细胞比例增多,S期细胞比例下降,呈明显的G0/G1期阻滞。说明ATPR可以调控MDAMB-231细胞周期,将其阻滞在G0/G1期比例升高,具有诱导分化效果。
维甲酸受体属于核受体超家族中的一个子家族,在这个超家族中还包括甾体类、维生素D和甲状腺激素受体及过氧化物酶体增殖物激活受体、昆虫脱皮类固醇受体和许多尚未知其配体的孤儿受体。Ayaori等[13]研究表明,维甲酸类化合物如ATRA、9cis RA首先通过与细胞质的维甲酸结合蛋白Ⅰ、Ⅱ(CRABPⅠ、CRABPⅡ)结合,转运至细胞核,与核受体RARs和RXRs形成的同/异二聚体结合,从而发挥抑制细胞生长、分化以及凋亡等调节作用。维甲酸受体子家族包括: RARs和RXRs,分别有α、β、γ 3种亚型。有文献指出在激素依赖性和非激素依赖性乳腺癌中,维甲酸作用后,维甲酸受体表达各不相同,在MDA-MB-231细胞中RARα、RXRα的表达非常低[14]。本课题组前期研究发现ATPR抑制MCF-7细胞增殖过程中,维甲酸受体RARs、雌激素受体ERs的表达发生变化。根据这一现象我们探讨维甲酸受体在ATPR对MDA-MB-231细胞诱导分化过程发挥怎样的变化? q-PCR和Western blot结果表明与溶剂对照组相比,ATPR用药后,RARγ的表达降低,RARα、RARβ、RXRα、RXRβ和RXRγ表达无明显变化。上述结果提示,ATPR对MDA-MB-231细胞中不同的维甲酸受体表达的影响是不同的,与文献的研究结果一致[14]。
(本实验在安徽省天然药物活性研究重点实验室完成,衷心感谢导师陈飞虎教授对我的课题悉心指导,感谢葛金芳老师在我实验遇到困难时耐心解答,感谢实验室的同学们在实验期间对我实验技术的帮助,最后感谢母校安徽医科大学给我提供良好的学习环境。)
参考文献:
[1]Sanz M A,Martin G,Diaz-Mediavilla J.All-trans-retinoic acid in acute promyelocytic leukemia[J].N Engl J Med,1998,338(6): 393-4.
[2]De la Serna J,Montesinos P,Vellenqa E,et al.Causes and prognostic factors of remission induction failure in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and idarubicin[J].Blood,2008,111(7): 3395-402.
[3]Montesinos P,Díaz-Mediavilla D J,Debén G,et al.Central nervous system involvement at first relapse in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline monochemotherapy without intrathecal Prophylaxis[J].Haematologica,2009,94(9): 1242-9.
[4]Yarali N,Tavil B,Kara A,et al.Acute renal failure during ATRA treatment[J].Pediatr Hematol Oncol,2008,25(2): 115-8.
[5]阮晶晶,陈飞虎,徐佼,等.4-氨基-2-三氟甲基苯基维甲酸酯对K562细胞分化和细胞周期的影响[J].中国药理学通报,2009,25(9):1238-43.
[5]Ruan J J,Chen F H,Xu J,et al.4-amino-2-trifluoromethyl-phenyl retinate induced K562 cell differentiation and cell cycle influence [J].Chin Pharmacol Bull,2009,25(9): 1238-43.
[6]彭晓清,陈飞虎,雷静,等.4 -氨基-2-三氟甲基苯基维甲酸酯通过PTEN/PI3K/AKT抑制YAC-1细胞增殖和诱导其分化[J].中国药理学通报,2014,30(1):60-5.
[6]Peng X Q,Chen F H,Lei J,et al.Differentiation induction effect of 4-amino-2-trifluoromethyl-phenyl retinate on lymphoma cancer cell and its possible mechanisms[J].Chin Pharmacol Bull,2014,30(1): 60-5.
[7]汪楠,陈飞虎,葛金芳,等.4-氨基-2-三氟甲基苯基维甲酸酯对MCF-7细胞增殖分化的影响极其机制研究[J].中国药理学通报,2013,29(6): 767-72.
[7]Wang N,Chen F H,Ge J F,et al.Differentiation induction effect of 4-amino-2-trifluoromethyl-phenyl retinate on human breast cancer MCF-7 cell and its possible mechanisms[J].Chin Pharmacol Bull,2013,29(6): 767-72.
[8]Hu K W,Pan X H,Chen F H,et al.A novel retinoic acid analog,4-amino-2-trifluoromethyl-phenyl Retinate,inhibits gastric cancer cell Growth[J].Int J Mol Med,2014,33(2): 415-22.
[9]DeSantis C E,Lin C C,Mariotto A B,et al.Cancer treatment and survivorship statistics,2014[J].CA Cancer J Clin,2014,64(4): 252-71.doi:10.3322
[10]Sachs L.Growth,differentiation and the reveral of malignancy [J].Sci Am,1986,254(1): 40-7.
[11]Machner B,Neppert B,Paulsen M,et al.Pseudotumor cerebri as a reversible side effect of all-trans retinoic acid treatment in acute promyelocytic leukaemia[J].European J Neurol,2008,15: e68-e69.
[12]Yu F,Yao H,Zhu P,et al.Let-7 regulates self renewal and tumorigenicity of breast cancer cells[J].Cell,2007,14(11): 1109 -23.
[13]Ayaori M,Yakushiji E,Ogura M,et al.Retinoic acid receptor agonists regulate expression of ATRA-binding cassette transporter G1 in macrophages[J].Biochim Biophys Acta,2012,1821(4): 561-72.
[14]Conzen S.Minireview: nuclear receptors and breast cancer[J].Mol Endocrinol,2008,22(10):2215-28.
Inducing effect of 4-Amino-2-Trifluoromethyl-Phenyl Retinate on differentiation of human breast cancer MDA-MB-231 cell and its possible mechanisms
LEI Jing,CHEN Fei-hu,GE Jin-fang,LI Yue,GAO Wen-fan,DENG Zi-yun
(School of Pharmacy,Anhui Medical University,Hefei 230032,China)
Abstract:Aim To investigate the effect of 4-Amino- 2-Trifluoromethyl-Phenyl Retinate on human breastcancer cells MDA-MB-231 and the possible mechanisms.Method Human breast cancer MDA-MB-231cells were incubated with different concentrations of ATPR in vitro.MTT assay was performed to measure the proliferation of MDA-MB-231.Cell growth curves were made by counting cells and morphologic changes were observed by Wright-Giemsa staining.The differentiation marker mucin-1(MUC-1)was measured by enzyme linked immunosorbent assay(ELISA).Cell cycle was examined by Flow cytometry(FCM).The expression of retinoic acid receptors(RARs)and retinoid X receptors(RXRs)were detected by Western blot and Quantitative real-time PCR(q-RT-PCR),respectively.Results Compared with solvent group,ATPR could inhibit the proliferation of MDA-MB-231 cells in a time-and dose dependent manner and induce the maturing and normality of morphology.The express of MUC-1 was significantly decreased,and the progres of cell cycle was blocked in the G0/G1-phase.The expression of RARγ was decreased.Conclusions ATPR could inhibit proliferation and induce differention of MDA-MB-231cells,it's associated with RARγ.
Key words:ATRA; ATPR; differentiation; MDA-MB-231cells; RARs; RXRs; ERs
作者简介:雷静(1988-),女,硕士生,研究方向:中药药理学,E-mail: leijing99@126.com;
基金项目:国家科技部“重大新药创制”科技重大专项(No 2011ZX09401)
收稿日期:2015-03-14,修回日期:2015-04-07
文献标志码:A
文章编号:1001-1978(2015)07-0973-07
doi:10.3969/j.issn.1001-1978.2015.07.017

