硫化氢对肥胖小鼠肝脂质蓄积的影响
郑乃汭,张优敬,吴东栋,刘 彬,吉爱玲,李彦章,皇甫超申(.河南大学护理学院,河南开封 475000;.河南大学医学院环境医学研究所,河南开封 475004)
硫化氢对肥胖小鼠肝脂质蓄积的影响
郑乃汭1,2,张优敬2,吴东栋2,刘彬1,吉爱玲2,李彦章2,皇甫超申2
(1.河南大学护理学院,河南开封475000;2.河南大学医学院环境医学研究所,河南开封475004)
中国图书分类号: R-332; R322.47; R344; R575. 5; R589. 2; R916. 4; R977. 3
摘要:目的探讨硫化氢对肥胖小鼠肝脏脂质蓄积的影响。方法C57BL/6J小鼠,随机分为对照组、模型组、硫化氢干预组。对照组喂普通饲料,模型组和硫化氢干预组喂高脂饲料。从第13周开始,硫化氢干预组注射硫氢化钠,剂量为50 μmol·kg-1·d-1,模型组注射等量生理盐水,16周末处死动物。肝脏组织匀浆,取上清,做生化检测,测量各组小鼠肝组织中甘油三酯、胆固醇含量;肝脏石蜡切片做H&E染色观察肝组织一般形态;冷冻切片,油红染色观察肝组织脂质蓄积情况;肝脏新鲜冰冻组织提取RNA,PCR检测小鼠肝脏中CPT-1、FAS的基因表达情况,并用ELISA法检测CPT-1、FAS的活性。结果模型组、硫化氢干预组小鼠体重明显高于对照组。与模型组相比,硫化氢干预组小鼠体重减轻;肝组织内甘油三酯、胆固醇含量明显下降;肝组织病理变化程度减轻,脂质蓄积减少;肝脏CPT-1表达及活性增高,FAS表达及活性降低。结论硫化氢可以降低肥胖小鼠肝组织脂肪含量,减轻肝脂肪变性程度,其机制可能与肝组织CPT-1表达增加、FAS表达下降有关。
关键词:硫化氢;肥胖;脂肪肝;脂肪酸合成酶;肉毒碱棕榈酰基转移酶-1;小鼠
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.012.html
皇甫超申(1964-),男,硕士,教授,研究方向:环境医学,Tel:0378-3880585,E-mail: chaoshen6403@ henu.edu.cn.
随着人们生活水平的提高,生活方式的改变,肥胖患病率呈逐年上升趋势。肥胖的发生原因主要是不合理的膳食结构,特别是高脂饮食造成的。约50%的肥胖症患者合并有非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD),由此引发非酒精性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化甚至肝癌。有研究表明,肥胖程度与非酒精性脂肪肝、非酒精性肝炎的病变程度明显相关[1]。高脂饮食造成高脂血症,进而脂质在肝细胞内异常蓄积,导致肝细胞脂肪变性是肝细胞遭受高血脂的第一次打击。发生脂肪变性的肝细胞功能下降,对氧化应激、炎症因子损伤的敏感性增强,当高脂血症时,体内氧自由基和过氧化脂质水平增加,抗氧化能力下降,极易造成高血脂对肝细胞的二次打击,从而导致非酒精性肝炎的发生和病变的进展。
有研究证实,高脂血症患者血浆内硫化氢(hydrogen sulfide,H2S)含量下降[2]。高脂饲养的小鼠血浆或肝组织内硫化氢含量也降低[3]。硫化氢是一种气体信号分子,发挥稳定血压、舒张血管、调节胃肠道功能、调节神经兴奋和肾脏保护作用。过去,硫化氢一直被认为是一种无色、具有臭鸡蛋气味的有毒气体,过量吸入会对身体很多器官造成严重的损害,直到20世纪90年代,Abe、Kimura发现硫化氢作为一种神经活性物质而存在,因此硫化氢被认为是继NO、CO之后的第3种气体信号分子[4]。在哺乳动物体内,硫化氢以半胱氨酸为底物,在5’磷酸-吡哆醛依赖性酶的胱硫醚-β-合酶(cystathionine-β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE),以及非5’-磷酸-吡哆醛依赖性酶3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)的催化下产生[5]。肝脏是体内生成H2S的主要部位,H2S可以调节正常大鼠及肝硬化大鼠的肝内微循环,改善肝硬化[6]。内源性硫化氢和硫化氢供体在生理?及病理生理条件下都有潜在的维持正常脂代谢的作用[7]。外源性给予硫化氢,是否有阻止或减轻肝细胞脂质蓄积,减轻或逆转肝细胞损伤的作用,目前尚未见文献报道。因此,本课题运用高脂饮食诱导小鼠肥胖,制作非酒精性脂肪肝模型,体外补充硫化氢,观察其是否会减轻肥胖小鼠肝脂质蓄积。
1 材料与方法
1.1主要试剂与仪器
1.1.1主要试剂饲料购自江苏美迪森生物医药有限公司,饲料能量来源见Tab 1;硫氢化钠(NaHS)购自美国Sigma-aldrich公司;无水乙醇、异丙醇等均购自天津市德恩化学试剂有限公司;油红O购自生工生物工程(上海)股份有限公司; RNA提取试剂盒、RNA纯化试剂盒、逆转录试剂盒均购自康为世纪生物科技有限公司;甘油三酯(TG)和胆固醇(TC)试剂盒购自南京建成生物工程研究所;脂肪酸合成酶(fatty acid synthase,FAS)和脂肪酸分解酶肉毒碱棕榈酰基转移酶-1(carnitine palmitoyltransferase-1,CPT-1)的引物由苏州金唯智生物科技有限公司合成(Tab 2); ELISA试剂盒购自郑州天驰生物试剂公司。

Tab 1 Energy comparison of different diets
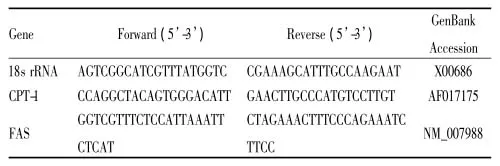
Tab 2 Sequences of primers used in study
1.1.2主要仪器Eppendorf高速台式冷冻离心机; Multiskan MK3型酶标仪(赛默飞世尔仪器有限公司);梯度PCR仪(Thermo公司,美国); BX51荧光显微镜(日本Olympus公司);超低温保存箱(Haier); WD-9413B凝胶成像分析仪、DYY-6C型电泳仪(北京市六一仪器厂)。
1.2方法
1.2.1实验动物分组和处理C57 BL/6J 6周龄健康♂小鼠30只,购自南京大学模式动物研究所,动物合格证号: 201401337,检疫合格,体质量: 18~22 g。室温控制在(20-25)℃,相对湿度60%-70%,定期更换垫料并进行消毒处理。随机选取8只小鼠饲喂普通饲料作为对照组,22只小鼠饲喂高脂饲料制作肥胖模型,至第12周末,根据文献,将体重超过对照组20%的小鼠作为肥胖小鼠[8],共有21只。将21只肥胖小鼠随机分模型组(10只)、硫化氢干预组(11只)。硫化氢干预组从第13周开始,每天早上9点腹腔注射硫氢化钠(50 μmol·kg-1·d-1,相当于2. 8 mg·kg-1·d-1),模型组注射等体积的生理盐水。对照组继续喂普通饲料,模型组和硫化氢干预组继续喂高脂饲料,饮用水选用自来水,自由进食。每周一下午测量并记录小鼠体重。所有动物在第16周末处死,取肝组织进行生化和病理形态学等检测。
1.2.2肝组织生化指标的检测取新鲜冰冻肝脏组织,匀浆、离心,取上清,按试剂盒说明书,用酶标仪测甘油三酯、胆固醇含量。
1.2.3肝脏病理组织学检测取每只小鼠相同部位的一小块肝组织,用4%多聚甲醛溶液固定,石蜡包埋切片,苏木素-伊红(HE)染色,光镜下观察形态。另取每只小鼠相同部位的一小块肝组织,做冰冻切片,切片厚度为6 μm,油红O染色,光镜下观察肝组织脂肪蓄积情况。
1.2.4 RT-PCR分析TRIzol试剂提取肝脏组织总RNA,Nanodrop检测RNA含量,Dnase处理,并用RNA试剂盒进行纯化。应用逆转录试剂盒进行cDNA第一链的合成,按说明书操作,总体积为20 μL。CPT-1的PCR扩增条件为: 95℃预变性2 min,循环40次(94℃变性35 s,59. 8℃退火35 s,72℃延伸35 s),72℃终延伸10 min。FAS的PCR扩增条件为: 95℃预变性2 min,循环40次(94℃变性35 s,54℃退火35 s,72℃延伸40 s),72℃终延伸10 min。18S rRNA的PCR扩增条件为: 95℃预变性1 min,循环30次(94℃变性35 s,51. 9℃退火35 s,72℃延伸40 s),72℃终延伸10 min。
1.2.5酶活性检测按ELISA试剂盒说明书,酶标仪检测小鼠肝组织CPT-1、FAS活性。
2 结果
2.1一般情况观察所有动物在实验过程中,每天计量小鼠进食和饮水量,观察小鼠活动情况。结果发现,各组小鼠进食量和饮水量以及活动情况无明显差别。对照组小鼠毛色正常,精神佳,与对照组相比,模型组和硫化氢干预组小鼠体型肥胖,毛色发亮。
2.2小鼠体重变化Fig 1A所示,从第5周开始,高脂组体重明显比普通饲料组增高(P<0. 05),到第12周末,体重平均比普通饲料组高(10. 0±1. 1)g。Fig 1B所示,从第13周末开始,与对照组相比,模型组和硫化氢干预组小鼠体重明显增高(P<0. 01),硫化氢干预组与模型组相比,体重明显下降(P<0. 01)。
2.3硫化氢干预对小鼠肝组织甘油三酯、胆固醇含量的影响Fig 2A所示,与对照组相比,模型组小鼠甘油三酯含量增高(P<0. 01)。与模型组相比,硫化氢干预组甘油三酯含量明显下降(P<0. 01)。Fig 2B所示,与对照组相比,模型组肝组织胆固醇含量明显升高(P<0. 05)。与模型组相比,硫化氢干预组肝组织胆固醇含量明显下降(P<0. 05)。

Fig 1 Effects of NaHS on body weight gain in mice(±s)
Male C57BL/6J mice(5 weeks old)were fed a normal-fat diet(NFD)or a high-fat diet(HFD)for 16 weeks.After 12 weeks of dietary manipulation to induce obesity,NaHS group received the high-fat diet with NaHS(2.8 mg·kg-1·d-1.ip).*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model.

Fig 2 Effects of NaHS on levels of liver triglyceride(TG)and total cholesterol(TC)in mice(±s)*P<0.05,**P<0.01 vs control;#P<0. 05,##P<0. 01 vs model.
2.4硫化氢干预对小鼠肝脏结构的影响Fig 3显示肝组织HE染色,对照组肝小叶结构正常,中央静脉和肝血窦清晰;模型组小鼠肝小叶模糊,肝索排列紊乱,肝窦狭窄,肝细胞内可见大量脂肪空泡;与模型组相比,硫化氢干预组肝小叶结构基本正常,肝窦清晰,肝细胞内脂肪空泡明显减少。

Fig 3 Effects of NaHS on tissue morphology of liver in obese mice(HE staining ×400)
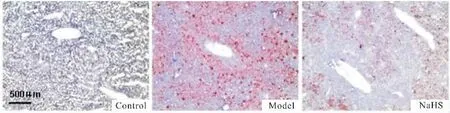
Fig 4 Effects of NaHS on lipid accumulation of liver in obese mice(ORO staining ×100)
2.5硫化氢干预对小鼠肝细胞脂质蓄积的影响
Fig 4所示为肝组织油红O染色切片,在光镜下肝组织内脂质呈红色。对照组肝组织的细胞形态和结构正常,个别肝细胞内有脂质沉积;模型组肝细胞内有大量脂质蓄积,肝小叶结构破坏;与模型组相比,硫化氢干预组脂质蓄积明显减少,肝小叶结构破坏程度减轻。
2.6硫化氢干预对小鼠肝脏CPT-1、FAS基因表达的影响Fig 5A所示为肝组织CPT-1和FAS基因表达电泳图。Fig 5B所示为电泳图灰度分析结果。与对照组相比,模型组CPT-1基因表达水平明显下降(P<0. 05)。与模型组相比,硫化氢干预组小鼠肝组织CPT-1基因表达明显增高(P<0. 01)。与对照组相比,模型组小鼠肝脏FAS基因表达水平有所增高(P<0. 05)。与模型组相比,硫化氢干预组小鼠肝组织FAS基因表达水平明显降低(P<0. 01)。
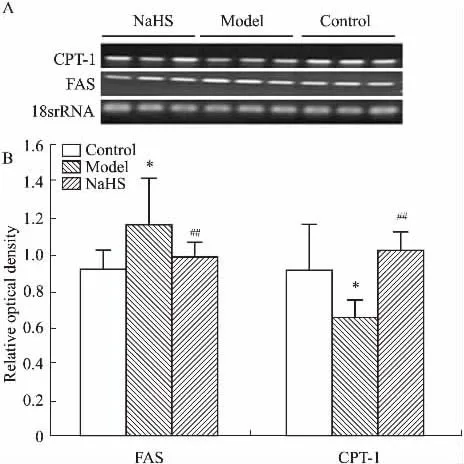
Fig 5 Effects of NaHS on mRNA expression levels of CPT-1 and FAS of liver in obese mice(±s)A: The mRNA expression levels of CPT-1 and FAS of liver were examined by RT-PCR; B:*P<0.05 vs control;##P<0.01 vs model.
2.7硫化氢干预对小鼠肝脏CPT-1、FAS活性的影响Fig 6A所示为肝组织CPT-1活性检测结果,与对照组相比,模型组CPT-1活性明显降低(P<0. 01);与模型组相比,硫化氢干预组CPT-1活性明显升高(P<0. 01)。Fig 6B所示为肝组织FAS活性检测结果,与对照组相比,模型组FAS活性有所增高(P<0. 01);与模型组相比,硫化氢干预组FAS活性明显降低(P<0. 01)。
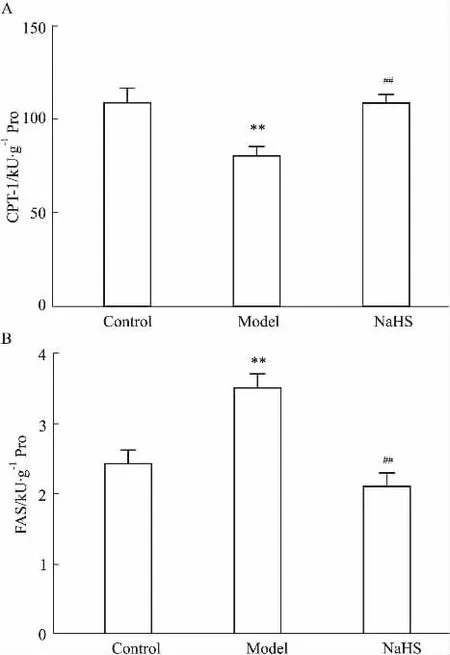
Fig 6 Effects of NaHS on activity of CPT-1 and FAS of liver in obese mice(±s)A: The activity of CPT-1 was detected by ELISA; B: The activity of FAS was detected by ELISA.**P<0. 01 vs control;##P<0. 01 vs model.
3 讨论
营养过剩可导致体重增加,其主要表现是体内过量脂质蓄积,身体肥胖。现在认为,肥胖是一种慢性代谢性疾病,可引发肝脂肪变性、非酒精性肝炎、肝硬化、糖尿病和心血管病。阻断脂肪在体内蓄积是预防和治疗肥胖的一种有效措施。许多研究发现,肥胖患者血浆中硫化氢含量下降与高胆固醇血症正相关[9],动物实验也证实肥胖可导致肝组织内硫化氢内源性合成减少,高脂饮食可抑制肝组织合成硫化氢。这些实验结果提示,硫化氢很可能参与肥胖时脂质的代谢。
硫化氢是近年来继发现一氧化氮和一氧化碳信号分子外,又一种被重新认识的气体信号分子。作为一种脂溶性的气体信号分子,硫化氢不借助任何细胞膜载体和通道,能自由进出细胞,从而对细胞发挥生理性调节作用。目前已发现,生理水平的硫化氢发挥稳定血压、扩张血管、调节神经兴奋等作用。在病理情况下,硫化氢还具有抗氧化、抗炎、抗凋亡的作用[10]。正常情况下,体内硫化氢水平保持动态平衡,它主要由含硫氨基酸为底物,在CSE和CBS等关键酶的催化下形成,形成的硫化氢又负反馈调节这些硫化氢合成的关键酶[11]。肝脏是内源性硫化氢产生的主要场所。肝组织来源的硫化氢有舒张血管、缓解门静脉高压、抗炎、抗氧化和肝细胞保护作用[12]。
本实验用高脂饲料饲喂小鼠12周,小鼠体重明显比饲喂普通饲料的对照组增加,说明小鼠肥胖模型诱导成功。从13周开始,腹腔注射硫氢化钠,外源性补充硫化氢,与模型组相比,小鼠饮食饮水量无差别,而体重逐渐下降,到16周末实验结束时,体重明显下降。初步实验结果提示,外源性补充硫化氢有减轻肥胖,降低小鼠体重的作用,且这种作用与动物食欲改变无关。课题组分析认为,硫化氢降低高脂饮食小鼠体重的机制很可能是参与体内脂质代谢,减少脂质在体内蓄积造成的。为此,本实验检测了小鼠肝组织甘油三酯和胆固醇的含量,结果发现,外源性补充硫化氢可使已经肥胖的小鼠肝组织甘油三酯和胆固醇含量下降。组织切片HE染色结果显示,肥胖小鼠肝小叶结构模糊,肝索扩大,肝血窦狭窄,肝细胞内大量空泡,部分区域炎症细胞浸润,提示肥胖小鼠发生了非酒精性肝炎。外源性补充硫化氢4周,小鼠肝组织结构基本恢复正常,肝细胞内空泡明显减少,炎症细胞少见。结果提示,外源性补充硫化氢可以逆转高脂饮食造成的肝脏脂肪蓄积。肝组织切片油红O染色进一步证实,高脂饮食造成的肝细胞空泡主要是大量脂质蓄积引起的,外源性补充硫化氢4周后,肝细胞内脂质蓄积明显减少,实验结果进一步证实了外源性补充硫化氢可以明显减少脂质在肝内的蓄积。
硫化氢对肝脂质代谢影响的机制目前还不清楚。一般在基础饲料中添加0. 5%~1. 0%胆固醇即可形成小鼠高胆固醇血症,同时肝脏甘油三酯(TG)含量也成倍增加,形成肝脂肪变性[13]。CPT-1是线粒体内脂肪酸β-氧化反应的限速酶,是反映脂肪分解的指标;反映脂肪酸合成的指标FAS是脂肪酸合成最后环节的限速酶。肝组织脂肪合成增多,分解减少是造成肝脏脂肪蓄积的直接原因。有文献证实高脂饮食可以导致小鼠肝细胞脂肪氧化酶CPT-1活性和mRNA表达减少,从而引起肝脂肪蓄积[14]。也有文献证实,高脂饮食导致小鼠脂肪酸合成酶FAS活性和mRNA表达量下降与肝脂肪蓄积相关[15]。脂肪酸合成和分解受细胞内氧化还原状态影响。硫化氢是公认的还原剂,可影响细胞内NAD+/NADH平衡,控制脂代谢[16]。高脂饮食可以导致肝细胞脂质过氧化应激,硫化氢水平升高,维持肝组织谷胱甘肽水平不变,从而保持氧化还原水平处于平衡状态[17]。本实验结果也显示,高脂饮食导致小鼠肝组织CPT-1 mRNA表达水平及酶活性明显下降,FAS mRNA表达水平及活性明显增加;外源性补充硫化氢,很可能通过调节高脂组小鼠肝细胞内氧化还原状态,抑制脂肪酸合成,促进脂肪酸分解,从而减轻肝脂肪蓄积。
硫化氢像一氧化氮和一氧化碳一样,其生物学作用也存在双向剂量效应关系,即高剂量有害,低剂量发挥细胞保护作用[18]。硫化氢的毒性作用主要表现为,动物从呼吸道吸入大剂量硫化氢,造成呼吸道上皮损伤;每天腹腔注射超过200 μmol·kg-1体重,会造成肺损伤[19-20]。正常哺乳动物组织和血浆硫化氢浓度达到1-160 μmol·L-1,硫化氢在小鼠体内约1/3以气体硫化氢形式存在,2/3以硫氢化钠形式存在[21]。硫氢化钠是常用的硫化氢供体,遇水后快速分解为钠离子和硫氢根离子,后者再与体内氢离子结合形成相等分子浓度的硫化氢。从本实验室预实验和文献来看,每天腹腔注射50 μmol· kg-1体重的硫氢化钠属于小鼠生理范围的剂量,没有发现对小鼠有毒副作用。
给大鼠腹腔注射硫氢化钠1 h后,大鼠血浆中硫化氢浓度达到高峰值80 μmol·L-1,约6 h后下降到20 μmol·L-1[22]。本实验每天通过腹腔注射1次硫氢化钠,可以推测,动物体内硫化氢浓度波动是很大的,在这种情况下补充的硫化氢依然对肥胖引起的肝组织脂肪蓄积有治疗作用。用缓释型的硫化氢供体,保持动物体内硫化氢浓度处于相对稳定状态,对肥胖诱发的肝脂肪蓄积是否有更好的治疗作用需要进一步研究。
(致谢:感谢河南大学分子医学实验室提供实验条件和技术支持!)
参考文献:
[1]Green C J,Hodson L.The influence of dietary fat on liver fat accumulation[J].Nutrients,2014,6(11):5018-33.
[2]Whiteman M1,Gooding K M,Whatmore J L,et al.Adiposity is a major determinant of plasma levels of the novel vasodilator hydrogen sulphide[J].Diabetologia,2010,53(8):1722-6.
[3]Peh M T,Anwar A B,Ng D S,et al.Effect of feeding a high fat diet on hydrogen sulfide(H2S)metabolism in the mouse[J].Nitric Oxide,2014,41(1):138-45.
[4]Yu X H,Cui L B,Wu K,et al.Hydrogen sulfide as a potent cardiovascular protective agent[J].Clin Chim Acta,2014,437:78-87.
[5]许岩,马娜,邓树泳,等.胱硫醚-β-合酶/硫化氢系统在鱼藤酮诱导PC12细胞损伤中的变化[J].中国药理学通报,2014,30(10): 1372-6.
[5]Xu Y,Ma N,Deng S Y,et al.Changes of endogenous cystathionine-β-synthase/hydrogen sulfide system in PC12 cells injury induced by rotenone[J].Chin Pharmacol Bull,2014,30(10): 1372 -6.
[6]Fan H N,Wang H J,Ren L,et al.Decreased expression of p38 MAPK mediates protective effects of hydrogen sulfide on hepatic fibrosis[J].Eur Rev Med Pharmacol Sci,2013,17(5):644-52.
[7]Mani S,Cao W,Wu L,Wang R.Hydrogen sulfide and the liver [J].Nitric Oxide,2014,02(006):1-10.
[8]杨爱君,崔雁,叶卉初,崔红.营养性肥胖动物模型的建立[J].临床和实验医学杂志,2005,23(4): 156-7.
[8]Yang A J,Cui Y,Ye H C,Cui H.The establishment of the diet-induced obesity animal model[J].J Clin Exp Med,2005,23(4): 156-7.
[9]Jain S K,Micinski D,Lieblong B J,Stapleton T.Relationship between hydrogen sulfide levels and HDL-cholesterol,adiponectin,and potassium levels in the blood of healthy subjects[J].Atherosclerosis,2012,225(1):242-5.
[10]Olas B.Hydrogen sulfide in hemostasis: friend or foe[J].Chem Biol Interact,2014,217:49-56.
[11]Kundu S,Pushpakumar S,Khundmiri S J,Sen U.Hydrogen sulfide mitigates hyperglycemic remodeling via liver kinase B1-adenosine monophosphate-activated protein kinase signaling[J].Biochim Biophys Acta,2014,1843(12):2816-26.
[12]Wang C,Han J,Xiao L,et al.Role of hydrogen sulfide in portal hypertension and esophagogastric junction vascular disease[J].World J Gastroenterol,2014,20(4):1079-87.
[13]Choi W H,Um M Y,Ahn J,et al.Cooked rice inhibits hepatic fat accumulation by regulating lipid metabolism-related gene expression in mice fed a high-fat diet[J].J Med Food,2014,17(1):36 -42.
[14]Ji C,Dai Y,Jiang W,et al.Postnatal overfeeding promotes early onset and exaggeration of high-fat diet-induced nonalcoholic fatty liver disease through disordered hepatic lipid metabolism in rats [J].J Nutr Biochem,2014,25(11):1108-16.
[15]Ramgopal M,Kruthika B S,Surekha D,Meriga B.Terminalia paniculata bark extract attenuates non-alcoholic fatty liver via down regulation of fatty acid synthase in high fat diet-fed obese rats[J].Lipids Health Dis,2014,13(58):1-7.
[16]Shang Z X,Lu C,Chen S F,et al.Effect of H2S on the circadian rhythm of mouse hepatocytes[J].Lipids Health Dis,2012,9(11):23-9.
[17]Hwang S Y,Sarna L K,Siow Y L,O K.High-fat diet stimulates hepatic cystathionine β-synthase and cystathionine γ-lyase expression[J].Can J Physiol Pharmacol,2013,91(11):913-9.
[18]Hua W,Zhou S L,Gong F Q.Biphasic regulation of hydrogen sulfide in inflammation[J].Chin Med J(Engl),2013,126(7):1360 -3.
[19]Wang J,Zhang H,Su C,et al.Dexamethasone ameliorates H2S-induced acute lung injury by alleviating matrix metalloproteinase-2 and -9 expression[J].PLoS One,2014,10,9(4): e94701.
[20]Reiffenstein R J,Hulbert W C,Roth S H.Toxicology of hydrogen sulfide[J].Annu Rev Pharmacol Toxicol,1992,32:109-34.
[21]Toldo S,Das A,Mezzaroma E,et al.Induction of microRNA-21 with exogenous hydrogen sulfide attenuates myocardial ischemic and inflammatory injury in mice[J].Circ Cardiovasc Genet,2014,7(3):311-20.
[22]Luo Z L,Tang L J,Wang T,et al.Effects of treatment with hydrogen sulfide on methionine-choline deficient diet-induced non-alcoholic steatohepatitis in rats[J].Gastroenterol Hepatol,2014,29(1):215-22.
Effect of hydrogen sulfide on hepatic lipid accumulation in obese mice
ZHENG Nai-rui1,2,ZHANG You-jing2,WU Dong-dong2,LIU Bin1,JI Ai-ling2,LI Yan-zhang2,HUANGFU Chao-shen2
(1.Nursing College of Henan University,Kaifeng Henan 475000,China;2.Institute of Environmental Medicine,Medical College of Henan University,Kaifeng Henan 475004,China)
Abstract: Aim To investigate the effect of hydrogen sulfide on hepatic lipid accumulation in obese mice.
Methods C57BL/6J mice were randomly divided into control group,model group,and NaHS group.The mice of the control group were fed with normal diet.The mice of the model group and the NaHS group were
fed with high-fat diet.From the thirteenth week,the mice of NaHS group were injected intraperitoneally with NaHS(H
2
S donor)in a dose of 50 μmol·kg
-1
per day for 4 weeks and the mice of the model group were injected with the same volume of saline.All mice were sacrificed at the end of the 16th week.The tissues of liver were homogenized and centrifugated.The supernatants were used for the determination of triglyceride and cholesterol in liver.The morphology of liver was tested by H&E staining.Liver lipid accumulation was determined by oil red staining.Total RNA was extracted from frozen tissue of liver.PCR was used to detect CPT-1,FAS gene expression and ELISA method was used to detect CPT-1,FAS activity in mice liver.
Results The body weight of the mice from NaHS group and model group was bigger than that of the mice from control group.Compared with the model group,the body weight of the mice from NaHS group was less; the content of triglyceride and cholesterol in liver was lower; the degree of liver tissue pathological changes and lipid accumulation were alleviated; CPT-1 expression and activity were increased; FAS expression and activity were decreased.Conclusions These data indicate that hydrogen sulfide can reduce the lipid content of liver tissue in obese mice and alleviate fatty liver.The mechanism may be associated with the increased expression of CPT-1 and the decreased expression of FAS in liver.
Key words:hydrogen sulfide; obesity; fatty liver; fatty acid synthase; carnitine palmitoyltransferase-1; mice
作者简介:郑乃汭(1988-),女,硕士生,研究方向:环境医学,E-mail: nairui0125@163.com;
基金项目:河南省科技发展计划项目(No 132300410012)
收稿日期:2015-02-15,修回日期:2015-04-02
文献标志码:A
文章编号:1001-1978(2015)07-0945-07
doi:10.3969/j.issn.1001-1978.2015.07.012

