神经肽Urocortin2对吗啡成瘾大鼠VTA神经元放电及DA能神经传递的影响
姚红月,宋斐然,刘春娜,李凤华,刘新宇(.辽宁医学院药理学教研室,辽宁锦州 000,.辽宁医学院附属第一医院,辽宁锦州 000,.中国医科大学,辽宁沈阳 000)
神经肽Urocortin2对吗啡成瘾大鼠VTA神经元放电及DA能神经传递的影响
姚红月1,2,宋斐然3,刘春娜1,李凤华2,刘新宇2
(1.辽宁医学院药理学教研室,辽宁锦州121000,2.辽宁医学院附属第一医院,辽宁锦州121000,3.中国医科大学,辽宁沈阳110001)
中国图书分类号: R-332; R322.81; R338.1; R749. 61; R971. 2; R977. 6
摘要:目的明确神经肽urocortin2(UCN2)在吗啡成瘾中抑制丘脑腹侧背盖区(ventral tegmental area,VTA)神经活动的机制。方法建立吗啡成瘾大鼠模型,采用七管微电泳方法,电泳UCN2对吗啡成瘾大鼠VTA神经元自发放电的改变,及UCN2对多巴胺(dopamine,DA)能神经元簇发放电模式的影响,明确UCN2在VTA神经元中与DA存在汇聚作用。另外,给予促皮质激素释放因子(coticortropin-releasing factor,CRF)受体阻断剂及蛋白激酶A(protein kinase A,PKA)抑制剂,明确UCN抑制吗啡成瘾中发挥关键作用。结果UCN2使82%(31/38)吗啡成瘾大鼠VTA神经元放电频率减慢,平均放电频率由微电泳前的(20. 89±2. 86)Hz减少到(13. 66±3. 93)Hz,给药前后放电频率降低具有显著性(P<0. 01),UCN2抑制作用可被PKA抑制剂H89及CRF-2R阻断剂AST-2B取消。另外,微电泳UCN2可抑制吗啡成
瘾大鼠VTA中DA神经元的爆发放电,AST-2B可增强DA的兴奋效应。结论UCN2与CRF-2R结合后,通过PKA信号途径,抑制VTA内DA神经元异常放电,在吗啡类药物成瘾中发挥抑制作用,为其用于临床治疗阿片类药物成瘾提供理论依据。
关键词:吗啡成瘾;优洛可啶;丘脑腹侧背盖区;多巴胺;神经元;微电泳;蛋白激酶A网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.018.html
刘新宇(1977-),男,博士,副教授,研究方向:神经内分泌学,通讯作者,Tel: 0416-4673465,E-mail: springnanaliu @163.com
吗啡等阿片类药物反复应用可造成耐受、依赖和成瘾,中断给药出现戒断综合征、强迫觅药行为及戒断后焦虑等精神神经系统症状。在阿片类药物的成瘾过程中,中脑腹侧被盖区(ventral tegmental area,VTA)起到重要的作用[1]。VTA靠近黑质与红核,含有大量DA能神经元。针对吗啡强化和依赖效应主要通过VTA的DA系统介导,VTA神经元的异常兴奋是吗啡成瘾的关键环节,但目前机制尚不清楚[2]。神经内分泌活性肽UCN是近年来发现的促皮质激素释放因子(coticortropin-releasing factor,CRF)肽类家族的一个新成员[3]。UCN具有与CRF相似的生物活性,通过下丘脑-腺垂体-肾上腺轴,促进腺垂体分泌肾上腺皮质激素,调节应激、应急反应、抗焦虑、镇静等作用。UCN作为一种新型的小分子神经活性肽,通过自分泌和(或)旁分泌途径,其作用是广泛的,相应作用机制也是多方面的[4]。有少量报道表明,UCN参与酒精成瘾及戒断后焦虑和觅药等行为的应激性反应[5]。但UCN对吗啡成瘾VTA神经元电活动及DA系统的影响未见报道,且机制也不明确。因此,本实验采用七管玻璃微电极细胞外记录方法,微电泳UCN2及CRF2受体抑制剂AST对VTA神经元放电情况的影响,同时也观察了UCN2对VTA中DA能神经递质传递的影响,以探讨VTA内存在的复杂的神经纤维联系及各种神经递质之间的相互作用,从而为VTA神经元放电异常及发作性疾病的诊治提供电生理学方面的依据。
1 材料与方法
1.1实验动物♂Sprague-Dawley(SD)大鼠,50只,体质量180~220 g,由辽宁医学院实验动物中心提供,动物合格证号: SCXK(辽)2003-0007。随机分为吗啡成瘾模型组40只和对照组10只。模型组采用剂量序贯递增法腹腔注射盐酸吗啡(Tab 1)建立大鼠吗啡成瘾模型,对照组在相同条件下给予生理盐水,12 d后采用纳洛酮(5 mg·kg-1)诱导吗啡成瘾戒断模型[6]。

Tab 1 Morphine dosage of administration
1.2七管玻璃微电极的拉制细胞外记录及微电泳采用51-217型微管拉制仪(美国STOELTING公司)所拉制的7管玻璃微电极。中心管尖端直径在4~8 μm,电阻为5~12 MΩ,管内灌注含1%滂胺天蓝的NaCl溶液(3. 0 mol·L-1)作为神经元放电活动的引导电极;外周管电阻为20-100MΩ,外周管内灌注下列药物,包括: UCN2(10-6mol·L-1); astressin2B-AST-2B(CRF-2受体阻断剂,10-6mol· L-1); DA及其非选择性阻断剂α-flupenthixol(FLU,10-5mol·L-1),蛋白激酶A(protein kinase A,PKA)及抑制剂(H-89,10-5mol·L-1)。
1.3实验方法上述实验动物用20%乌拉坦(1 g ·kg-1)麻醉后,于脑立体定位仪上行常规开颅。根据Paxions Watson大鼠脑图谱,确定VTA核团位置,坐标为前囟后5. 20~6. 80 mm,中线旁开0. 20~0. 80 mm,脑表下7. 0~8. 0 mm。应用微电极推进器将七管微电极缓慢插入VTA,神经元单位放电经DAM80微电极放大器采集及滤波后显示于示波器上,再经Spike2生物信号采集系统(英国CED公司)输入计算机并处理,生成序列密度直方图。观察吗啡成瘾大鼠VTA神经元放电情况,之后观察UCN2及AST-2B对VTA神经元放电影响。另外,微电泳DA及其阻断剂期间,给予UCN2对VTA神经元多巴胺能神经传递的影响;微电泳PKA及抑制剂H-89,进一步观察UCN2对吗啡成瘾大鼠VTA神经元影响是否通过PKA发挥作用。为排除可能发生的电流影响,只要注入生理盐水引起的任何放电改变,则该资料不列入统计之内。
1.4数据处理及统计记录微电泳药物前、后VTA神经元放电频率改变,微电泳药物后放电频率变化/% =(微电泳药物期间放电频率-微电泳前20s放电频率)/微电泳前20s放电频率×100%,电泳药物后放电变化超过±30%为有效临界值。
采用SPSS 13. 0统计软件进行统计学处理。所有数据以用±s表示。组间比较采用单因素方差分析及LSD-t检验进行统计学处理。
2 结果
实验中,共计观察了52个吗啡成瘾大鼠VTA神经元的自发放电活动,其自发放电频率快而且不规则,VTA神经元放电频率在10~25Hz之间,多为单个爆发式放电。
2.1微电泳UCN2及AST对VTA神经元自发放电的影响本结果中,共观察了38个吗啡成瘾大鼠的VTA神经元。微电泳UCN2(10-6mol·L-1,20nA,20s)使82%(31/38)神经元自发放电频率减慢,对7个神经元无作用。38个受试VTA神经元的平均放电频率由微电泳前的(20. 89±2. 86)Hz减少到(13. 66±3. 93)Hz,给药前后放电频率降低具有显著性(P<0. 01)。实验中发现,UCN2的抑制作用较明显,几乎没有潜伏期,但存在后作用。此外,在22个VTA神经元中单独微电泳AST(10-6mol· L-1,20nA,20s),可使73%(16/22)VTA神经元自发放电频率升高。受试VTA神经元放电频率由微电泳前的(21. 64±2. 82)Hz升高到(24. 25±2. 30)Hz(P<0. 01),在微电泳UCN2造成抑制效应的20个神经元中,微电泳UCN2(20nA,40s)期间给予AST(20nA,20s)可拮抗UCN2的抑制效应,使80%(16/20)对UCN2产生抑制效应的神经元放电频率明显加快,放电频率由微电泳AST前的(13. 35± 1. 89)Hz增加到(17. 80±2. 53)Hz,微电泳前后平均放电频率改变具有显著性(P<0. 01)。AST的起效迅速,无潜伏期,可引起爆发式放电,并可见双向动作电位增加(Fig 1A,1B)。

Fig 1 Effects of UCN2 on VTA neuronA: Effects of UCN2(10-6mol·L-1,20nA,20s)and AST-2B on VTA neuron.**P<0.01 vs normal group;##P<0. 01 vs UCN2 group,B: Effects of UCN2 on VTA neuron spontaneous firing rates.AST-2B was administrered during the period of UCN2.
2.2微电泳UCN2及AST对DA能神经传递的影响微电泳DA可使吗啡成瘾大鼠VTA神经元兴奋性进一步升高,而给予DA非选择性阻断剂可拮抗其兴奋效应。选取对DA产生兴奋效应的24个VTA神经元进行研究。在微电泳DA(20nA,40s)期间,在第20s微电泳UCN2(20nA,20s),使受试神经元中的79%(19/24)的放电频率明显降低。受试VTA中DA神经元的放电频率由微电泳UCN2前(25. 57±1. 64)Hz减少到(13. 42±1. 60)Hz,给药前后放电频率差异有显著性(P<0. 01)。微电泳DA的阻断剂FLU可使DA神经元放电频率明显降低,在微电泳期间给予UCN2(20nA,20s),对受抑制的VTA神经元中放电频率无明显影响,平均放电频率由微电泳UCN2前的(13. 88±1. 80)Hz变化到(13. 46±1. 78)Hz,给UCN2前后差异无显著性(P >0. 05)(Fig 2A,2B)。
2. 3 UCN2及AST对DA元中PKA的影响对DA产生兴奋效应的19个VTA神经元进行研究。在微电泳DA(20nA,80s)期间,在第20s微电泳H89(20 nA,40s),使受试神经元中的79%(15/19)的放电频率由微电泳H89前(25. 50±1. 58)Hz减少到(16. 17±1. 47)Hz,给药前后放电频率差异有显著性(P<0. 05)。在微电泳H89的第20 s,再微电泳UCN2(20nA,20 s),受试的VTA神经元中的52%(10/19)放电频率略降低,由(15. 80±2. 41)Hz改变为(15. 45±1. 28)Hz但给药前后差异无显著性(P>0. 05)(Fig 3A,3B)。
3 讨论
实验中发现,吗啡成瘾大鼠VTA神经元放电频率明显增加,呈爆发式放电,而神经肽UCN2能使其神经元放电频率明显减慢,提示UCN2对吗啡成瘾大鼠VTA神经元的放电起抑制作用。研究表明[7],阿片类药物能直接或间接刺激VTA,产生神经元异常高频放电,VTA是愉悦系统或奖赏系统的重要部分,当产生奖赏行为时,能够刺激VTA神经元兴奋性放电,产生药物依赖成瘾,本实验结果进一步提示,UCN2可以通过抑制VTA神经元异常高频放电,对阿片类药物成瘾起到抑制及治疗作用。

Fig 2 Effects of UCN2 on DA neuron
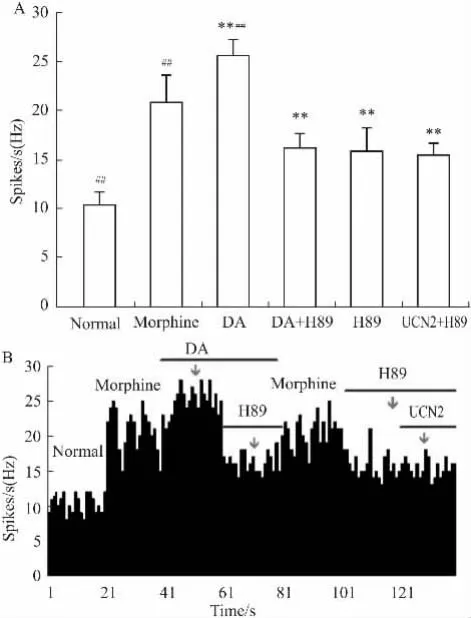
Fig 3 Effects of UCN2 on PKA pathwayA: Effects of UCN2(10-6mol·L-1,20nA,20s)and H89 on VTA's DA neuron.**P<0. 01 vs normal group;##P<0.01 vs h89 group; B: Effects of UCN2 on VTA's dopaminergic neuron spontaneous firing rates via PKA pathway.
实验中单独微电泳选择性CRF2R阻断剂AST-2B可增加受试VTA神经元的放电频率。微电泳UCN2期间,其抑制作用可被AST-2B所拮抗,结果提示UCN2对吗啡成瘾大鼠VTA神经元的抑制效应可能是通过与CRF2R结合后而产生。UCN有3种形式: UCN1、UCN2、UCN3。CRF受体主要有CRF-1R、CRF-2R两种,新近发现的非哺乳动物CRFR3受体,均为7次跨膜的G蛋白偶联受体,CRFR1受体能高亲和力地与CRF、UCN1肽结合。而UCN2、UCN3只对CRFR2受体有特异结合特征。UCN与CRF-R2结合后,具有抗氧化、抗衰老、抗焦虑、忧郁等多种生理作用及药理功能[8-9]。有研究表明,Urocortin在脑损伤过程中具有神经保护作用,特别是在药物成瘾、神经退行性疾病中发挥重要调节作用,但目前机制尚不十分明确[10]。因此,本实验结果进一步提示,UCN2在对吗啡类药物成瘾中主要是通过与CRF-R2结合发挥抑制作用。
实验结果表明,DA能投射纤维对VTA神经元有兴奋作用,UCN2可以拮抗DA的兴奋效应,且给予AST对DA兴奋效应具有一定协同作用,提示UCN2与VTA神经元中CRF2受体结合后,拮抗DA在吗啡成瘾中的兴奋毒性。有报道表明[11],VTA中的DA神经元异常兴奋,诱发VTA神经元过度爆发式放电,产生药物依赖性。UCN2是CRF肽类家族的成员,有研究表明,UCN2可增加实验鼠的迷宫探索能力,增强学习和记忆能力,具有抗焦虑作用及很强的镇静效应。UCN2与酒精成瘾有密切关系,微量核团注射UCN2能减少小鼠自我供给酒精的量,在酒精戒断过程中发挥作用。吗啡是通过阿片受体作用于VTA上的DA能神经元,从而引起DA释放增加,减弱或消除GABA能神经元对DA神经元的抑制作用,进一步促进DA释放。因此,本实验结果进一步提示,UCN2能够抑制VAT中DA神经元活动的物质将有望成为减轻吗啡成瘾的有效药物。
UCN2与CRF-2R结合后是如何引起效应的呢?其保护VTA神经元作用的机制,很可能与阻断了神经递质DA的兴奋毒性作用有关。有限的研究资料也表明: UCN与酒精成瘾有密切关系,微量核团注射UCN能减少小鼠自我供给酒精的量[10];可卡因戒断引起的长时程增强可被CRFR1和CRFR2受体拮抗剂阻断[11];在酒精戒断过程中,大鼠杏仁核细胞外CRF明显升高。上述结果均提示: UCN可能通过CRF-R2受体参与酒精成瘾及戒断后焦虑和觅药等行为的应激性反应[12]。另外,VTA的DA能神经元成簇放电导致其突触末梢DA释放量瞬时大量增加,已被公认是编码奖赏效应的功能信号,但诱发DA能神经元产生簇放电的神经机制尚不完全清楚[7]。在本实验中证实,微电泳PKA阻断剂H89后,再给予UCN2,可使VTA中DA神经元的放电频率略降低,但给药前后差异无显著性,该结果提示,UCN2与CRF-2R结合后,进而通过激活蛋白激酶A引起效应。
本实验结果表明,UCN2可以通过作用于CRF-2R能够抑制VTA神经元放电活动,降低神经元的过度兴奋性,并且降低DA能兴奋毒性,提示在吗啡成瘾病理情况下,UCN2可以起到神经元保护作用,研究结果为药物成瘾机制提供新的实验依据,对临床防治提供新的思路。
参考文献:
[1]Charalampopoulos I,Androulidaki A,Minas V,et al.Neuropeptide urocortin and its receptors are expressed in rat Kupffer cells [J].Neuroendocrinology,2006,84(1):49-57.
[2]胡蓉蓉,宋睿,苏瑞斌,等.多巴胺D3受体与阿片成瘾研究进展[J].国际药学研究杂志,2013,10(40):5525-6.
[2]Hu R R,Song R,Su R B,et al.Dopamine D3 receptor and opioid addiction: researeh advances[J].J Int Pharm Res,2013,10(40):5525-6.
[3]Walczewska J,Dzieza-Grudnik A,Siga O,Grodzicki T.The role of urocortins in the cardiovascular system[J].J Physiol Pharmacol,2014,65(6):753-66.
[4]Voltolini C,Battersby S,Novembri R,et al.Urocortin 2 role in placental and myometrial inflammatory mechanisms at parturition [J].Endocrinology,2015,156(2):670-9.
[5]Ryabinin A E,Yoneyama N,Tanchuck M A,et al.Urocortin 1 microinjection into the mouse lateral septum regulates the acquisition and expression of alchhol consumption[J].Neuroscience,2008,151(3):780-90.
[6]郑久明,张迪,刘新宇,刘春娜.神经肽urocortinⅡ对吗啡成瘾大鼠中脑腹侧被盖区神经元自发放电的影响[J].中国药理学通报,2014,30(5):735-6.
[6]Zheng J M,Zhang D,Liu X Y,Liu C N.Effects of neuropeptide urocortinⅡon spontaneous discharge of ventral tegmental area in morphineaddicted rats[J].Chin Pharmacol Bull,2014,30(5): 735-6.
[7]汤贤春,杨培润,吴明松,等.吗啡精神依赖大鼠奖赏环路多巴胺递质含量和D2受体表达的变化[J].中国药物依赖性杂志,2014,23(1):19-23.
[7]Tang X C,Yang P R,Wu M S,et al.Changes of dopamine content and D2 receptor expression in reward circuit in morphine dependent rats[J].Chin J Drug Depend,2014,23(1):19-23.
[8]Lawrence K M,Jackson T R,Jamieson D,et al.Urocortin-from Parkinson's disease to the skeleton[J].Int J Biochem Cell Biol,2014,23(60C):130-8.
[9]Stengel A,Taché Y.CRF and urocortin peptides as modulators of energy balance and feeding behavior during stress[J].Front Neurosci,2014,18(8):52.
[10]Pan W,kastin A J.Urocortin and the brain[J].Pregr Neurobiol,2008,84(2):148-56.
[11]Guan X,Zhang R,Xu Y,Li S.Cocaine withdrawal enhances long-term potentiation in rat hippocampus via changing the activity of corticotrophin-releasing factor receptor subtype 2[J].Nuroscience,2009,161(3):665-70.
[12]Valdez G R,Sabino V,Koob G F.Increased anxiety-like behavior and ethanol self-administration in dependent rats: reversal via corticotrophin-releasing factor-2 receptor activation[J].Alcohol Clin Exp Res,2004,28(6):865-72.
Effects of neuroactive peptide urocortin 2 on VTA neuron's spontaneous discharge and DA-ergic neurotransmission in morphine addiction
YAO Hong-yue1,2,SONG Fei-ran3,LIU Chun-na1,LI Feng-hua2,LIU Xin-yu2
(1.Dept of Pharmacology,Liaoning Medical University; 2.The First Affiliated Hospital of Liaoning Medical University,Jinzhou Liaoning 121000,China; 3.The China Medical University,Shenyang 110001,China)
Abstract:Aim To investigate the inhibitory effects of urocortin2(UCN2)on ventral tegmental area(VTA)nervous activity of morphine addiction rats and the mechanism.Methods Morphine addiction rats and the microiontophoresis method were used to observe the effects of UCN2 on VTA neuron' s spontaneous discharge changing rule,as well as the inhibitory effects of UCN2 on DA neuron' s cluster spontaneous discharge,to identify UCN2 and DA on the same VTA neuron.Morever,the inhibitor of corticotropin-regulating factor' s receptor(CRF-2R)and the blocker of protein kinase A(PKA),AST-2B and H89,were used to investigate the effects of UCN2 on VTA neuron' s of morphine addiction rats.Results UCN2 could inhibit the firing rate 82%(31/38)of the tested VTA neuron(P<0. 01),the discharge frequency changed from(20. 89±2. 86)Hz to(13. 66±3. 93)Hz(P<0. 01).Further,the inhibitor of PKA,AST-2B and H89 could ablolish the inhibitory effects of UCN2.Morever,the excitatory firing of VTA neurons was attenuated by addition of UCN2,while AST application could inhibit the UCN2's inhibitory effects.Conclusion UCN2 could regulate the effects of VTA via PKA pathway and may thereby contribute to the improvement of drug addiction.
Key words:morphine addiction; urocortin; ventral tegmental area; dopamine; neuron; microelectrophoresis; protein kinase A
作者简介:姚红月(1979-),女,硕士生,研究方向:神经药理学,E-mail:43948255@ qq.com;
基金项目:国家自然科学基金资助项目(No 81201037)
收稿日期:2015-02-28,修回日期:2015-03-17
文献标志码:A
文章编号:1001-1978(2015)07-0979-05
doi:10.3969/j.issn.1001-1978.2015.07.018

