维甲酸对皮肤角阮细胞水孔蛋白通道3表达的影响
维甲酸对皮肤角阮细胞水孔蛋白通道3表达的影响
陈建华
(江西中医药高等专科学校人体解剖学教研室,江西抚州344000)
摘要〔〕目的探讨维甲酸类药物对表皮角阮细胞中水孔蛋白通道(AQP)3表达的影响。方法异维A酸、阿维A、阿达帕林处理角朊细胞的体外培养模型(HaCaT),采用免疫组化、RT-PCR、Western印迹分子生物学方法检测不同浓度(0.000、0.001、0.010、0.060、0.100 mg/ml)、不同作用时间(0、6、12、24、48 h)及不同干预因素下对HaCaT中AQP3含量的变化。结果①浓度为0.010 mg/ml时,三组HaCaT中AQP3的表达均高于其他浓度(P<0.05);②0.010 mg/ml浓度的异维A酸、阿维A、阿达帕林作用12 h,三组HaCaT中AQP3的表达异维A酸组>阿维A组>阿达帕林组,组间比较差异显著(P<0.05)。结论维甲酸可调节HaCaT中AQP3的表达,0.010 mg/ml浓度的异维A酸组12 h的时候对HaCaT中AQP3表达的上调作用最明显。
关键词〔〕水孔蛋白通道3;维甲酸;角阮细胞;表皮细胞
中图分类号〔〕R39〔文献标识码〕A〔
第一作者:陈建华(1972-),男,主治医师,讲师,主要从事解剖组织学研究。
维甲酸类药物属维生素A的衍生物,现已广泛用于多种异常角化、增殖性皮肤病及抗衰老、抗氧化等美容方面的治疗,临床疗效确切〔1〕。但其一个非常明显且不可避免的副作用就是皮肤黏膜干燥、脱屑、皲裂,以补充水分、保湿剂等一般处理不能缓解,众多患者因不能耐受中断治疗,失去治愈疾病的机会〔2〕。水孔蛋白(AQPs)是一种位于细胞膜上的蛋白质,在细胞膜上组成孔道,可控制水在细胞的进出。在人体内目前发现已有AQPs11种,不仅存在于脑室膜、心脏、肺泡、胆道系统、肾脏、晶状体内囊、外分泌腺上皮细胞等和水、金属盐代谢有关的器官、组织,也存在于表皮的角阮细胞胞膜〔3,4〕。已有文献证实AQP3对于皮肤屏障功能的恢复起着重要的作用,通过调节AQP3的表达及功能变化,可以从一定程度上改善皮肤水分含量减少以及改善干燥性的皮肤病〔5~7〕。维甲酸引起皮肤黏膜干燥的副作用是否与AQP3的表达有关,目前尚无相关研究。本文研究维甲酸对人源角朊细胞(HaCaT)AQP3表达的影响。
1材料和方法
1.1主要试剂、细胞与仪器HaCaT(中国科学院细胞库),含血清的完全培养基及不含血清培养基(美国GIBCO公司),PCR试剂盒(上海硕盟生物),免疫组化试剂盒(武汉博士德),HRP标记山羊抗小鼠IgG,HRP标记山羊抗兔IgG(上海碧云天生物),含EDTA的胰酶(美国GIBCO公司),一抗:AQP3兔单克隆IgG和β-actin小鼠多克隆IgG(美国Santa Cruz公司)。异维A酸(商品名为泰尔丝,上海信谊延安药业有限公司生产)、阿维A(商品名为方希,重庆华邦制药有限公司)、阿达帕林药品(商品名为达芙文,法国高德美国际公司生产),以上3种药物10 ml内含所含成分为40 mg、20 mg、400 mg。细胞培养超净台(苏州净化),培养箱(美国Queue systems),倒置相差显微镜(日本奥林巴斯),高转速冷冻离心机(德国BiofugeStratos),转膜仪及电泳仪(美国伯乐公司),PCR仪(澳大利亚Rotor-gene)。
1.2细胞培养与传代HaCaT细胞培养于含10%胎牛血清及双抗的DMEM培养基中,置于5%CO2、37℃孵箱中传代培养。当细胞密度达到4×106以上的时候进行传代,清洗培养基后,用含0.02%EDTA的胰蛋白酶进行细胞消化,倒置显微镜观察细胞回缩即终止消化,加入同体积的有血清培养基,吹打,10 000 r/min离心5 min,弃上清,取细胞悬液,计数后接种到新的培养瓶中。
1.3分组及加药待细胞贴壁生长至4×106,分别予以不同浓度异维A酸、阿维A、阿达帕林(0.000、0.001、0.010、0.060、0.100 mg/ml),不同作用时间(0、6、12、24、48 h)给药刺激。
1.4免疫组化方法采用SP检测法,切片脱蜡,加入3%过氧化氢封闭阻断内源性过氧化物酶,50 μl非免疫动物血清封闭,加50 μlAQP3一抗过夜,50 μl生物素标记第二抗体,辣根过氧化物酶孵育,DBA显色,苏木素复染,中性树胶固封。结果判定:阳性细胞为细胞胞质胞膜在倒置显微镜下出现深棕黄色的染色。
1.5半定量逆转录聚合酶链反应(RT-PCR)方法取HaCaT细胞定量100 mg,提取总RNA。取2 μg总RNA行逆转录cDNA,取20 μl作为反应体系。PCR反应由逆转录产物2 μl以及18 S RNA和AQP3的引物共同组成。反应过程按照标准的RT-PCR步骤进行:首先预变性的反应条件为95℃、5 min,接着进行梯度变性反应,94℃、30 s,60℃、30 s,72℃、60 s,72℃、7 min递减,共进行30次的循环。接着对所得到的PCR产物进行琼脂糖凝胶电泳,通过拍摄电泳图像对所得到的电泳结果进行凝胶成像分析系统分析。内参选择18 SRNA作为参照,同样完成以上PCR系统的成像,对得到的半定量结果进行对比分析,通过量化的吸光度积分值进行分析(A值)。
1.6Western印迹方法取HaCaT细胞提取100 mg总蛋白。SDS-PAGE凝胶电泳,半干法转膜,加AQP3一抗(1∶500),4℃孵育过夜;辣根过氧化物酶标记的羊抗兔二抗(1∶1 000)37℃孵育1 h。ECL光化学法显色,用彩色图像分析系统测定吸光度。
1.7统计学方法应用SPSS21.0统计软件进行LSD检验。非参数检验Kruskal-wallisH检验及Mann-whitneyU检验。
2结果
2.1免疫组化法检测AQP3表达未加药刺激的HaCaT细胞AQP3主要在表皮基底层表达,且染色强度较弱。异维A酸、阿维A、阿达帕林刺激HaCaT细胞后AQP3几乎在基底层到棘层的全部区域都有分布,且染色强度较强。见图1。
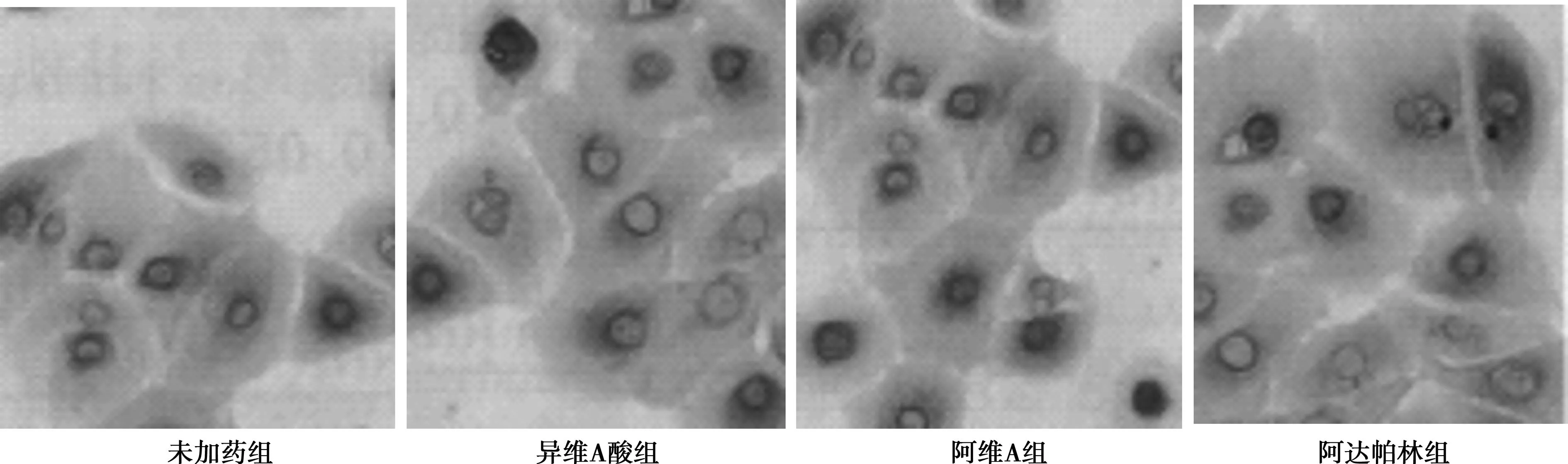
图1 免疫组化法检测HaCaT细胞AQP3表达(DAB,×200)
2.2异维A酸、阿维A、阿达帕林对HaCaT细胞中AQP3 mRNA表达的影响不同浓度异维A酸、阿维A、阿达帕林作用24 h时,0.010 mg/ml浓度时,HaCaT细胞中AQP3 mRNA的表达值高于其他浓度表达值,组间比较差异(P<0.05),见表1。HaCaT细胞在0.010 mg/ml异维A酸、阿维A、阿达帕林培养液中分别孵育6、12、24、48 h,结果显示HaCaT细胞AQP3 mRNA 表达在6 h开始增加,在12 h达到峰值,AQP3 mRNA的表达异维A酸组>阿维A组>阿达帕林组,组间差异显著(P<0.05),见表2。HaCaT细胞在0.010 mg/ml异维A酸、阿维A、阿达帕林培养液中分别孵育6、12、24、48 h,结果显示HaCaT细胞AQP3 mRNA 表达在6 h开始增加,在12 h达到峰值,AQP3 mRNA的表达异维A酸组>阿维A组>阿达帕林组,组间差异显著(P<0.05),见表2。
2.3异维A酸、阿维A、阿达帕林作用24 h对AQP3蛋白表达的影响不同浓度的异维A酸、阿维A、阿达帕林作用HaCaT细胞后的AQP3蛋白表达情况比较,浓度为0.010 mg/ml时,三组HaCaT中AQP3的表达均高于其他浓度,(P<0.05),见表3。比较HaCaT在0.010 mg/ml异维A酸、阿维A、阿达帕林培养液中分别孵育6、12、24、48 h,结果显示HaCaT中AQP3蛋白表达在6 h开始增加,在12 h达到峰值(P<0.05),三组HaCaT中AQP3的表达异维A酸组>阿维A组>阿达帕林组,组间比较差异显著(P<0.05),见表4。
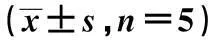

给药浓度(mg/ml)异维A酸组阿维A组阿达帕林组0.0000.82±0.311)0.72±0.261)0.72±0.291)0.0011.12±0.561)1.10±0.291)1.03±0.331)0.0101.70±0.561.56±0.451.45±0.440.0601.16±0.691)1.22±0.361)1.05±0.421)0.1000.68±0.231)0.87±0.311)0.98±0.261)
与0.010 mg/ml浓度比较:1)P<0.05
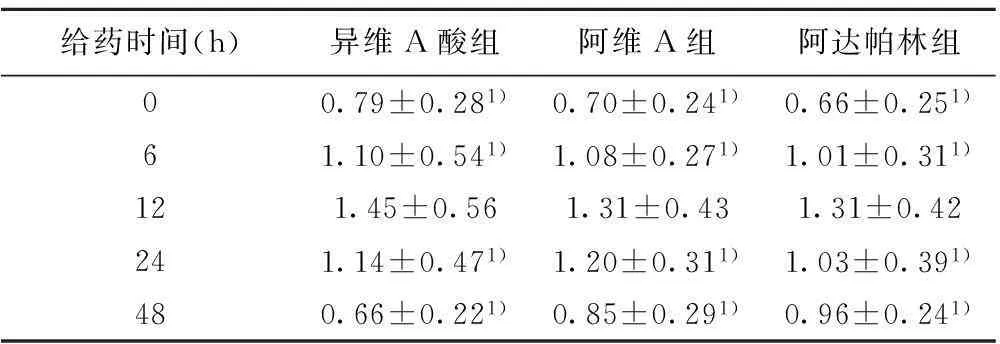
给药时间(h)异维A酸组阿维A组阿达帕林组00.79±0.281)0.70±0.241)0.66±0.251)61.10±0.541)1.08±0.271)1.01±0.311)121.45±0.561.31±0.431.31±0.42241.14±0.471)1.20±0.311)1.03±0.391)480.66±0.221)0.85±0.291)0.96±0.241)
与12 h组比较:1)P<0.05
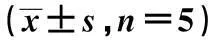
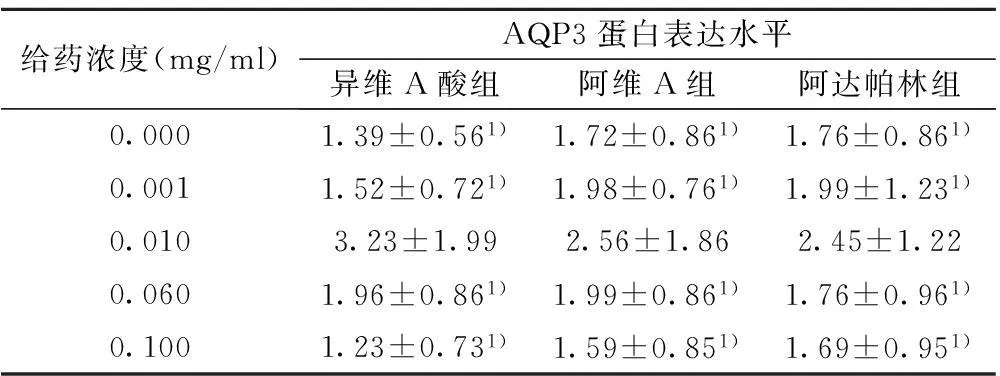
给药浓度(mg/ml)AQP3蛋白表达水平异维A酸组阿维A组阿达帕林组0.0001.39±0.561)1.72±0.861)1.76±0.861)0.0011.52±0.721)1.98±0.761)1.99±1.231)0.0103.23±1.992.56±1.862.45±1.220.0601.96±0.861)1.99±0.861)1.76±0.961)0.1001.23±0.731)1.59±0.851)1.69±0.951)
与0.010 mg/ml浓度比较:1)P<0.05
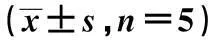
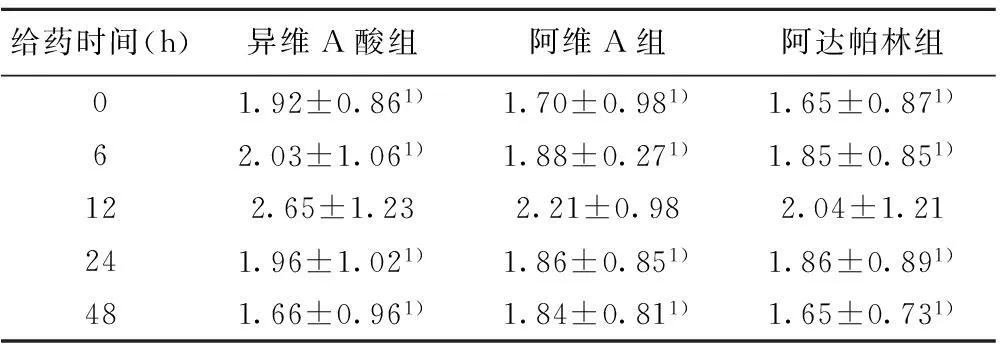
给药时间(h)异维A酸组阿维A组阿达帕林组01.92±0.861)1.70±0.981)1.65±0.871)62.03±1.061)1.88±0.271)1.85±0.851)122.65±1.232.21±0.982.04±1.21241.96±1.021)1.86±0.851)1.86±0.891)481.66±0.961)1.84±0.811)1.65±0.731)
与12 h组比较:1)P<0.05
3讨论
维甲酸是目前在皮肤科广泛应用的一类药物,具有多种的药理活性,其可以通过抑制角质细胞的异常增殖和分化,同时促进正常的角质化进程〔8,9〕。另外该药物还可以通过中性粒细胞的趋化作用记忆溶酶体的释放作用,抑制皮脂腺的分化,具有抗炎作用,临床上多用外用维甲酸类药物治疗痤疮、抗角质化皮肤等,临床上使用该药物已取得了确切的疗效〔10,11〕。但有一个不可回避的问题就是该类药物的主要副作用可以导致皮肤黏膜的干燥,通常一般的补水方法很难缓解,很多患者都因为无法耐受药物的副作用自行的停药,终止治疗。
水通道蛋白是几年来不断被人们认识的一类水特异性的膜蛋白,自从1988年发现AQP1以来,人们陆续发现了多种该类型的水通道蛋白,1994年发现了AQP3可对甘油等物质具有通透性,对水通道蛋白认识又更进了一步〔12,13〕。AQP3的高通透性,不仅仅可以运送水分还可以将内源性的甘油和皮脂腺中的甘油三酯带到表皮中,从而参与表皮细胞的甘油代谢工作〔14〕。
研究发现通过维甲酸刺激后,AQP3的阳性细胞数、mRNA及蛋白表达均上调,这与皮肤的透皮失水的原理相同,AQP3表达上调,使皮肤屏障被破坏,细胞处于高渗的状态,导致皮肤干燥等副作用的发生。同时我们还观察到,随着浓度的增加,达到一个峰值后AQP3表达又会随之下调,可能的原因考虑与药物的浓度过高以及作用时间过长有关,浓度的升高以及作用时间过长都会使得细胞内外药物不能充分代谢,导致渗透压的改变,当渗透压过大的时候细胞的结构就会受到破坏,甚至会出现细胞膜的溶解,导致细胞的死亡〔15〕。从维甲酸的药理作用及本研究结果上看,该药不仅具有抗炎作用,同时还可以促进表皮细胞HaCaT中AQP3的表达,以发挥其修复皮肤黏膜屏障的功能〔16〕。因此在临床的使用中应该把握好药物的剂量及药物的使用时间,不能一味追求高剂量和长期使用,以减少药物的副作用,达到维持维甲酸的最佳治疗效果。我们要做的是确保体内体外的调节一致性,由于我们所做的是体外实验,并没有考虑到体内的内环境对药物的调节作用,药物浓度的把握需要我们进一步验证。
综上所述,通过对角朊细胞的体外培养模型(HaCaT)AQP3 表达及甲酸类药物干预作用的研究,我们认为AQP3的表达与药物的干预的关系紧密,接下来需要进一步深入探讨AQP3在体内实验模拟疾病治疗作用,可以进一步阐明该类药物治疗的作用机制与途径,为临床治疗提供理论依据和治疗方案。
4参考文献
1Stiebel-Kalish H,Eyal S,Steiner I.The role of aquaporin-1 in idiopathic and drug-induced intracranial hypertension〔J〕.Med Hypotheses,2013;81(6):1059-62.
2Matsunaga N,Itcho K,Hamamura K,etal.24-hour rhythm of aquaporin-3 function in the epidermis is regulated by molecular clocks〔J〕.J Investi Dermatol,2014;134(6):1636-44.
3刘芳芬.水通道蛋白3与人皮肤成纤维细胞光老化的机制研究〔D〕.长沙:中南大学,2013.
4王沪凯.维甲酸药物对皮肤病的治疗探讨〔J〕.中国药物经济学,2012;3(1):24-5.
5Chaudhuri RK,Bojanowski K.Bakuchiol:a retinol-like functional compound revealed by gene expression profiling and clinically proven to have anti-aging effects〔J〕.Int J Cosmetic Sci,2014;36(3):221-30.
6徐之涵.新型维甲酸类化合物的合成和生物活性测试〔D〕.东华大学,2014.
7Choudhary V,Olala LO,Qin H,etal.Aquaporin-3 re-expression induces differentiation in a phospholipase d2-dependent manner in aquaporin-3-knockout mouse keratinocytes〔J〕.J Invest Dermatol,2015;135(2):499-507.
8何传果.硝酸银对角朊细胞增殖的作用〔D〕.遵义:遵义医学院,2013.
9Sakamoto Y,Hisatsune A,Katsuki H,etal.Aquaporin 5 increases keratinocyte-derived chemokine expression and NF-kappaB activity through ERK activation〔J〕.Biochem Biophys Res Comm,2014;448(4):355-60.
10Wu Z,Uchi H,Morino-Koga S,etal.Resveratrol inhibition of human keratinocyte proliferation via SIRT1/ARNT/ERK dependent downregulation of aquaporin 3〔J〕.J Dermatol Sci,2014;75(1):16-23.
11Poveda M,Hashimoto S,Enokiya Y,etal.Expression and localization of aqua-glyceroporins AQP3 and AQP9 in rat oral epithelia〔J〕.Bull Tokyo Dent Coll,2014;55(1):1-10.
12Blaydon DC,Kelsell DP.Defective channels lead to an impaired skin barrier〔J〕.J Sci,2014;127(Pt 20):4343-50.
13Melnik BC.The potential role of impaired notch signalling in atopic dermatitis〔J〕.Acta dermato-venereologica,2015;95(1):5-11.
14徐之涵,潘燊,黄焰根.新型维甲酸类化合物的合成及生物活性研究〔J〕.有机化学,2014;7(12):1391-8.
15杨娟,张锡宝.维甲酸受体及其作用机制研究进展〔J〕.皮肤性病诊疗学杂志,2014;5(3):423-6.
16Sugiyama Y,Yamazaki K,Kusaka-Kikushima A,etal.Analysis of aquaporin 9 expression in human epidermis and cultured keratinocytes〔J〕.FEBS,2014;4(5):611-6.
〔2013-12-09修回〕
(编辑曹梦园)

