全反式维甲酸对5/6肾大部切除大鼠肾间质纤维化的影响及其作用机制
刘 霞 马红萍
(1南通大学医学院病理生理学系,2机能实验室 南通 226001)
全反式维甲酸对5/6肾大部切除大鼠肾间质纤维化的影响及其作用机制
刘霞1马红萍2△
(1南通大学医学院病理生理学系,2机能实验室南通226001)
【摘要】目的探讨全反式维甲酸 (all-trans retinoic acid,atRA)对5/6肾大部切除 (5/6 nephrectomy,5/6Nx) 大鼠肾小管间质纤维化的作用及其机制。方法成年雄性SD 大鼠行5/6Nx后2周分为3组:5/6Nx组 (大豆油1 mL·kg-1·d-1,n=11)、 atRA1 组 (atRA 5 mg·kg-1·d-1,n=10)、atRA2组 (atRA 10 mg·kg-1·d-1,n=11),另设Sham组即假手术组 (大豆油1 mL·kg-1·d-1,n=7)。经灌胃给药,每日1次,连续给药12 周。测定24 h尿蛋白量和血肌酐浓度;肾脏病理切片采用VG染色,对肾小管间质纤维化进行评分;用Western blot检测肾皮质中α平滑肌肌动蛋白 (α-smooth muscle actin,α-SMA)和纤溶酶原激活物抑制剂1 (plasminogen activator inhibitor-1,PAI-1)的蛋白表达。结果术后14 周,atRA显著降低5/6Nx大鼠的24 h尿蛋白量和血肌酐浓度 (P均<0.05)。atRA显著降低该模型的肾小管间质纤维化 (P<0.01)。atRA显著下调该模型的肾皮质α-SMA和PAI-1表达 (P均<0.05),肾小管间质纤维化评分与α-SMA和PAI-1表达均呈显著正相关 (r分别为0.717 6和0.809 8,P均<0.01)。结论atRA可减少5/6Nx大鼠的尿蛋白水平,抑制肾皮质α-SMA和PAI-1的蛋白表达,从而减轻肾间质纤维化。
【关键词】维甲酸;肾切除术;肾小管间质纤维化;α平滑肌肌动蛋白;纤溶酶原激活物抑制剂1
*This work was supported by the General Program of College Natural Science Research Foundation of Jiangsu Province (11KJD310001) and the Application Research Project of Nantong City (BK2014035).
肾小管间质纤维化是多种肾脏疾病进展至终末期肾功能衰竭的共同通路[1],其病理特征是细胞外基质成分 (extracellular matrix,ECM)过多沉积于肾小管间质。ECM积聚是由ECM合成增多和/或ECM降解减少引起。α-平滑肌肌动蛋白 (α-smooth muscle actin,α-SMA)是肌成纤维细胞的标志性蛋白,当肾小管上皮细胞和间质成纤维细胞表达α-SMA时,肌成纤维细胞特征而大量合成分泌ECM[2]。 纤溶酶原激活物抑制剂 1 (plasminogen activator inhibitor-1,PAI-1)是纤溶酶原激活物 (plasminogen activator,PA)的抑制剂,通过抑制PA对纤溶酶原的激活,抑制ECM降解,促进ECM积聚[3]。研究表明PAI-1参与了肾纤维化的发生和发展[4]。维甲酸是维生素A的衍生物,包括全反式维甲酸 (all-trans retinoic acid,atRA),9-顺式维甲酸和13-顺式维甲酸。维甲酸具有抗增生和抗炎症作用,能抑制肾纤维化,保护肾结构和功能[5-10],但其抗纤维化机制有待进一步研究。本研究以大鼠5/6肾大部切除(5/6 nephrectomy,5/6Nx)为模型,观察atRA对肾功能、肾小管间质纤维化及肾脏α-SMA和PAI-1表达的影响,并进一步探讨atRA 的肾保护作用机制。
材 料 和 方 法
主要试剂atRA购自上海市第六制药有限公司,抗α-SMA抗体购自美国Sigma公司,抗PAI-1抗体购自美国BD公司,抗β-actin 抗体购自美国Santa Cruz公司,化学发光试剂盒购自美国Pierce公司。
大鼠5/6Nx模型的建立雄性SD大鼠(250~330 g)购自上海中科院实验动物中心。术前腹腔注射30%水合氯醛 (300 mg/kg)麻醉,经背部左侧切口暴露左肾,分离肾动脉左上支和中支并结扎,使左肾梗死约2/3,同时摘除右肾。假手术组(Sham组)大鼠仅分离左肾动脉分支,不予结扎,摘除右肾。
动物分组及给药术后2周,根据血肌酐水平的升高确定造模成功后将大鼠分成3组:5/6Nx模型组(n=11)用大豆油1 mL·kg-1·d-1灌胃;低剂量 atRA 组 (atRA1,n=10)用atRA 5 mg·kg-1·d-1灌胃;高剂量atRA 组 (atRA2,n=11)用atRA 10 mg·kg-1·d-1灌胃。另设Sham组(n=7)用大豆油1 mL·kg-1·d-1灌胃。避光条件下每天新鲜配制atRA的豆油悬浮液。术后2周起开始喂药,连续给药12周。 Lv等[11]报道,5和10 mg·kg-1·d-1的atRA能显著缓解自发性高血压大鼠的心肌纤维化,几乎无毒性作用;而30~60 mg·kg-1·d-1的atRA具有显著降低大鼠体重等不良反应,故本研究选用5和10 mg·kg-1·d-1这两个atRA剂量。
肾功能检测将每只大鼠单独地放在代谢笼中,留取24 h尿并量取总体积,在此期间大鼠自由饮水、进食。24 h后取尾血,采用自动生化测定仪测定血肌酐浓度和尿蛋白浓度,计算24 h尿蛋白总量。
肾小管间质纤维化评分取肾脏组织矢状切面约2 mm,常规石蜡包埋,切片厚度为4μm,VG染色。显微镜下高倍视野 (×400)拍照,每只大鼠选择至少20个高倍视野,采用CellSens Dimension软件 (日本Olympus公司)测定肾小管间质纤维化面积占总面积的百分比,作为肾小管间质纤维化评分。
Western blot检测肾皮质α-SMA和PAI-1的蛋白表达水平肾皮质组织于液氮中速冻,然后转存于-80 ℃冰箱。取肾皮质100 mg,加入1 mL组织裂解液,于冰水中匀浆。4 ℃下12 000×g离心10 min,取上清,用BCA法测定蛋白浓度。 取30μg总蛋白,加入相应量的5×SDS凝胶加样缓冲液,制备1×SDS缓冲液,进行SDS-PAGE蛋白电泳,湿转至PVDF膜上。将转印上蛋白的PVDF膜置于5%脱脂奶粉中室温封闭2 h。然后置于一抗工作液中,4 ℃过夜。洗膜,接着加入相应的辣根过氧化酶标记的二抗,室温放置1 h。洗膜,加入化学发光试剂作用5 min,将PVDF膜置于暗盒中,X光片感光。用Smart viewer 软件 (上海复日科技公司)对蛋白条带进行定量。
结果
atRA对5/6Nx大鼠24h尿蛋白量的作用4组术前24h尿蛋白量的差异无统计学意义 (图1)。 术后14 周,5/6Nx组的24h尿蛋白量显著高于Sham组 (P<0.01)。与 5/6Nx组比较,atRA1组和atRA2组的24h尿蛋白量显著下降 (P<0.05)。atRA1组的尿蛋白水平比较atRA2组更低,但差异无统计学意义。
atRA对5/6Nx大鼠血肌酐浓度的作用4组术前血肌酐浓度的差异无统计学意义(图2)。术后14周,5/6Nx组的血肌酐浓度显著高于Sham组 (P<0.01)。与 5/6Nx组比较,atRA1组和atRA2组的血肌酐浓度显著下降 (P<0.05)。atRA1组的血肌酐浓度较atRA2组更低,但差异无统计学意义。
atRA对5/6Nx大鼠肾小管间质纤维化的作用肾组织切片VG染色(图3)显示:5/6Nx组肾小管间质纤维化评分显著高于Sham组(P<0.01)。与5/6Nx组比较,atRA1组和atRA2组的肾小管间质纤维化评分显著下降 (P<0.01),但无剂量依赖性。
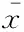
图1atRA对5/6Nx大鼠尿蛋白的作用
Fig1EffectofatRAonurinaryalbuminexcretionintheratswith5/6Nx

图2atRA对5/6肾大部切除大鼠血肌酐浓度的作用
Fig2EffectofatRAonserumcreatinineintheratswith5/6Nx
atRA对5/6Nx大鼠肾皮质α-SMA和PAI-1蛋白表达的作用5/6Nx组肾皮质α-SMA和PAI-1蛋白表达显著高于Sham组 (P均<0.05,图4)。 与5/6Nx组比较,atRA1组和atRA2组的肾皮质α-SMA和PAI-1蛋白表达显著下降 (P均<0.05),且呈现剂量依赖性,atRA2组肾皮质α-SMA和PAI-1蛋白表达较atRA1组下降更明显 (P均<0.05)。肾小管间质纤维化评分与α-SMA和PAI-1蛋白表达均呈显著正相关 (r分别为0.717 6和0.809 8,P均<0.01,图5)。

图3atRA对5/6Nx大鼠肾小管间质纤维化的作用
Fig3EffectofatRAonrenaltubulointerstitialfibrosisintheratswith5/6Nx
讨论
肾小管间质纤维化是肾衰竭的主要病理基础,肾小管间质损害比肾小球病变更能反映肾脏疾病的预后[12]。本研究以5/6Nx大鼠为模型,并用atRA处理,atRA能降低该模型的肾小管间质纤维化程度,与其降低24 h尿蛋白量和下调肾皮质α-SMA和PAI-1蛋白表达有关。
蛋白尿是肾脏滤过屏障功能障碍的重要特征。肾小球足细胞是肾脏滤过屏障的主要成分,其足突和裂孔膜是防止血浆白蛋白滤过的最后一道关键屏障。大多数的蛋白尿疾病与肾小球足细胞的足突消失和/或裂孔膜的破坏有关。原尿中大量蛋白逸出至肾小管管腔,引起肾小管间质损伤和纤维化[13],所以蛋白尿不仅是反映肾功能损伤的指标,也是导致肾疾病进展的直接病理因素。atRA能显著降低5/6Nx大鼠的24 h尿蛋白水平。atRA在体内和体外均能上调足细胞的裂孔膜相关蛋白podocin和nephrin的表达,从而发挥抗蛋白尿作用[7-8]。因为蛋白尿是肾脏疾病进展的一个危险因素,所以atRA的抗蛋白尿作用是其改善肾小管间质纤维化的机制之一。

图4atRA对5/6Nx大鼠肾皮质α-SMA和PAI-1表达的作用
Fig4EffectsofatRAonα-SMAandPAI-1expressionsintherenalcortexofratswith5/6Nx
纤维化是由ECM合成过多和/或降解减少从而ECM过多沉积造成的。正常肾脏中α-SMA的表达仅见于肾脏血管中层的平滑肌细胞。若肾小管上皮细胞、间质成纤维细胞和肾小球系膜细胞表达α-SMA,则标志着它们被激活,获得了肌成纤维细胞特征,增殖活跃且ECM合成分泌显著增加[2]。我们观察到5/6Nx组肾皮质α-SMA蛋白水平显著高于Sham组,atRA能显著降低α-SMA蛋白表达;肾小管间质纤维化程度与α-SMA表达呈显著正相关。 5/6Nx大鼠模型中除发生肾小管间质纤维化外,肾小球硬化也存在,所以该模型肾脏中增加的α-SMA不仅来源于肾小管上皮细胞和间质成纤维细胞,也来源于肾小球系膜细胞。atRA对肾小管间质和肾小球中α-SMA表达的影响可通过免疫组化来区分。atRA可通过直接抑制肌成纤维细胞的α-SMA表达来改善肾小管间质纤维化。肌成纤维细胞增殖活跃,atRA具有抗增殖特性,所以atRA可能通过抑制肌成纤维细胞的增殖来降低α-SMA表达,从而降低ECM合成。atRA也可能通过抑制单个肌成纤维细胞的α-SMA表达,从而抑制单个细胞水平上的ECM合成。 因为Wen等[14]观察到atRA的一种同型异构体——9-顺式维甲酸能抑制转化生长因子β1诱导的肾系膜细胞α-SMA表达,而不影响细胞数目。
A:α-SMA (r=0.7176,P<0.01);B:PAI-1 (r=0.8098,P<0.01).
图5肾小管间质纤维化评分与α-SMA和PAI-1表达的相关性
Fig 5Correlation between renal tubulointerstitial fibrosis score and α-SMA and PAI-1 expressions
纤维化不仅可由ECM合成增加造成,也可由ECM降解减少引起。ECM主要由基质金属蛋白酶 (matrix metalloproteinases,MMPs)和纤溶酶来降解[3]。纤溶酶可直接降解ECM,也可通过活化MMP来降解ECM。PAI-1作为组织型纤溶酶原激活物 (tissue-type plasminogen activator,tPA)和尿激酶型纤溶酶原激活物 (urokinase-type plasminogen activator,uPA)的抑制剂,抑制PA对纤溶酶原的激活,从而抑制ECM降解,促进ECM积聚。正常肾组织中PAI-1表达很低;肾损伤时其表达显著增高[4]。过表达PAI-1的小鼠器官纤维化比野生型小鼠严重[15-16],而PAI-1基因敲除后器官纤维化减轻[15,17-18]。我们观察到,与Sham组比较,5/6Nx组肾皮质PAI-1表达增加,atRA显著下调PAI-1表达;肾小管间质纤维化程度与PAI-1表达呈显著正相关,提示atRA可通过减少PAI-1表达降解ECM,从而缓解肾小管间质纤维化。 atRA可直接抑制肌成纤维细胞的PAI-1表达,我们曾报道atRA能直接抑制转化生长因子β1和血管紧张素Ⅱ诱导的体外培养的肾系膜细胞PAI-1和ECM表达纤维连接蛋白[19]。
atRA对5/6Nx大鼠肾皮质α-SMA和PAI-1表达的抑制作用呈现剂量依赖性;而在降低尿蛋白和血肌酐的作用方面,5 mg·kg-1·d-1atRA比10 mg·kg-1·d-1atRA更具优势,这可能是由较高剂量atRA的毒性作用和不良反应引起的,包括高脂血症和肝功能损害等[20],具有剂量依赖性。本研究选用较低剂量的atRA(5和10 mg·kg-1·d-1),在保证有效的同时尽量减少毒性作用和不良反应,但10 mg·kg-1·d-1的atRA仍能轻微升高血中三酰甘油水平,而5 mg·kg-1·d-1的atRA则无此不良反应[11]。本研究中2个剂量的atRA对肾间质纤维化的抑制作用未表现出剂量依赖性,这可能是由于较高剂量atRA的非特异性不良反应削弱了其特异性肾保护作用。
综上所述,atRA能有效降低5/6Nx大鼠的尿蛋白水平,能有效抑制肾皮质α-SMA和PAI-1表达,减少ECM合成,同时促进ECM降解,从而改善肾小管间质纤维化和肾功能。
参考文献
[1]UCERO AC,GONÇALVES S,BENITO-MARTIN A,etal.Obstructive renal injury:from fluid mechanics to molecular cell biology[J].OpenAccessJUrol,2010(2):41-55.
[2]MERAN S,STEADMAN R.Fibroblasts and myofibroblasts in renal fibrosis[J].IntJExpPathol,2011,92 (3):158-167.
[3]BARICOS WH,CORTEZ SL,EL-DAHR SS,etal.ECM degradation by cultured human mesangial cells is mediated by a PA/plasmin/MMP-2 cascade[J].KidneyInt,1995,47 (4):1039-1047.
[5]ZHOU TB,QIN YH,LI ZY,etal.All-trans retinoic acid treatment is associated with prohibitin expression in renal interstitial fibrosis rats[J].IntJMolSci,2012,13 (3):2769-2782.
[6]VON TOERNE C,BEDKE J,SAFI S,etal.Modulation of Wnt and Hedgehog signaling pathways is linked to retinoic acid-induced amelioration of chronic allograft dysfunction[J].AmJTransplant,2012,12 (1):55-68.
[7]SUZUKI A,ITO T,IMAI E,etal.Retinoids regulate the repairing process of the podocytes in puromycin aminonucleoside-induced nephrotic rats[J].JAmSocNephrol,2003,14 (4):981-991.
[8]VAUGHAN MR,PIPPIN JW,GRIFFIN SV,etal.ATRA induces podocyte differentiation and alters nephrin and podocin expressioninvitroandinvivo[J].KidneyInt,2005(68):133-144.
[9]HU P,QIN YH,PEI J,etal.Beneficial effect of all-trans retinoic acid (ATRA) on glomerulosclerosis rats via the down-regulation of the expression of alpha-smooth muscle actin:a comparative study between ATRA and benazepril[J].ExpMolPathol,2010,89 (1):51-57.
[10]MORATH C,RATZLAFF K,DECHOW C,etal.Chronic low-dose isotretinoin treatment limits renal damage in subtotally nephrectomized rats[J].JMolMed,2009,87 (1):53-64.
[11]LV L,YAO T,ZHU YZ,etal.Chronic all-trans retinoic acid treatment prevents medial thickening of intramyocardial and intrarenal arteries in spontaneously hypertensive rats[J].AmJPhysiolHeartCircPhysiol,2003,285 (4):H1370-H1377.[12]王海燕.重视和研究小管-间质损害在肾小球疾病发展和预后中的作用[J].中华肾脏病杂志,2000,16 (1):5-6.[13]CRAVEDI P,REMUZZI G.Pathophysiology of proteinuria and its value as an outcome measure in chronic kidney disease[J].BrJClinPharmacol, 2013,76(4):516-523.
[14]WEN X,LI Y,HU K,etal.Hepatocyte growth factor receptor signaling mediates the anti-fibrotic action of 9-cis-retinoic acid in glomerular mesangial cells[J].AmJPathol,2005,167(4):947-957.
[15]EITZMAN DT,MCCOY RD,ZHENG X,etal.Bleomycin-induced pulmonary fibrosis in transgenic mice that either lack or overexpress the murine plasminogen activator inhibitor-1 gene[J].JClinInvest,1996,97(1):232-237.
[17]ODA T,JUNG YO,KIM HS,etal.PAI-1 deficiency attenuates the fibrogenic response to ureteral obstruction[J].KidneyInt,2001,60 (2):587-596.
[18]NICHOLAS SB,AGUINIGA E,REN Y,etal.Plasminogen activator inhibitor-1 deficiency retards diabetic nephropathy[J].KidneyInt,2005,67 (4):1297-1307.
[19]LIU X,LV L,TAO BB,etal.All-trans retinoic acid inhibits the increases in fibronectin and PAI-1 induced by TGF-beta1 and Ang II in rat mesangial cells[J].ActaPharmacolSin,2008,29 (9):1035-1041.
[20]BRECHER AR,ORLOW SJ.Oral retinoid therapy for dermatologic conditions in children and adolescents[J].JAmAcadDermatol,2003,49 (2):171-182.
Effect of all-trans retinoic acid on renal tubulointerstitial fibrosisin the rats with 5/6 nephrectomy and its mechanisms
LIU Xia1, MA Hong-ping2△
(1DepartmentofPathophysiology,2FunctionalLaboratory,MedicalSchoolofNantongUniversity,Nantong226001,JiangsuProvince,China)
【Abstract】ObjectiveTo investigate the effect of all-trans retinoic acid (atRA) on renal tubulointerstitial fibrosis in the rats with 5/6 nephrectomy and the involved mechanisms.MethodsAdult male SD rats underwent 5/6 nephrectomy (5/6Nx).Two weeks later,nephrectomized rats were divided into 3 groups:5/6Nx group (soybean oil of 1 mL·kg-1·d-1,n=11),atRA1 group (atRA of 5 mg·kg-1·d-1,n=10) and atRA2 group (atRA of 10 mg·kg-1·d-1,n=11).Sham group (soybean oil,1 mL·kg-1·d-1,n=7) served as a nomal control.Rats were treated by intragastric gavage once a day for 12 weeks. Serum creatinine concentration and 24 hours urinary albumin excretion were measured.The renal tubulointerstitial fibrosis was scored on renal sections with VG staining.The expression levels of α-smooth muscle actin (α-SMA) and plasminogen activator inhibitor-1 (PAI-1) in renal cortex were examined by Western blot.ResultsTreatment of atRA decreased the elevated levels of urinary albumin excretion and serum creatinine concentration in 5/6 nephrectomized rats at 14 weeks after operation (all P<0.05).Renal tubulointerstitial fibrosis score in rats with 5/6 nephrectomy was markedly decreased after atRA administration (P<0.01).The increases in expressions of α-SMA and PAI-1 in renal cortex in rats with 5/6 nephrectomy were significantly downregulated by atRA treatment (all P<0.05).Renal tubulointerstitial fibrosis score correlated well with the expression of α-SMA (r=0.7176,P<0.01) or with that of PAI-1 (r=0.8098,P<0.01).ConclusionsTreatment with atRA ameliorates renal tubulointerstitial fibrosis in rats with 5/6 nephrectomy by decreasing both proteinuria and protein expressions of α-SMA and PAI-1 in renal cortex.【Key words】retinoic acid;nephrectomy;renal tubulointerstitial fibrosis;α-smooth muscle actin;plasminogen activator inhibitor-1
【中图分类号】Q 491.1
【文献标识码】A
doi:10.3969/j.issn.1672-8467.2016.01.005
(收稿日期:2015-04-20;编辑:段佳)
江苏省高校自然科学研究面上项目 (11KJD310001);南通市应用研究计划 (BK2014035)
△Corresponding authorE-mail:mahp@ntu.edu.cn

