犬细小病毒NY株VP2蛋白的原核表达及反应原性鉴定
毛倩倩,卜 宾,唐青海,阚云超,姚伦广,唐存多,焦铸锦,杨建伟(南阳师范学院南阳市兽医生物工程技术研究中心河南省伏牛山昆虫生物学重点实验室/昆虫生物反应器河南省工程实验室,河南南阳473061)
犬细小病毒NY株VP2蛋白的原核表达及反应原性鉴定
毛倩倩,卜宾,唐青海*,阚云超,姚伦广,唐存多,焦铸锦,杨建伟*
(南阳师范学院南阳市兽医生物工程技术研究中心河南省伏牛山昆虫生物学重点实验室/昆虫生物反应器河南省工程实验室,河南南阳473061)
摘 要:犬细小病毒(CPV)编码的VP2基因容易发生变异,导致病毒嗜性和致病性的改变。为制备一株高致病性的CPV毒株(NY株,基因型为2a型)重组VP2蛋白,构建重组原核表达载体pET28a-CPVVP2,转化E.coli BL21(DE3)表达菌株,通过不同温度、不同IPTG浓度和不同诱导时间等条件的优化进行表达蛋白,采用SDS-PAGE和Western blot进行蛋白鉴定。结果表明,重组CPV-NY毒株VP2蛋白(rVP2)的分子质量约为72ku,在不同温度条件下均以包涵体形式存在,在37℃条件下以终浓度为0.2 mmoL/L IPTG诱导4h表达量达到最高。rVP2不仅与His标签mAb反应,也能与CPV特异性阳性血清反应,说明rVP2具有良好的反应原性,为CPV抗体检测试剂盒和基因工程疫苗的研究奠定了基础。
关键词:犬细小病毒NY株;VP2;原核表达;鉴定
犬细小病毒病以出血性肠炎、剧烈呕吐、白细胞减少及心肌炎为主要特征[1],该病发病率高,传染性强,病死率高,成为危害犬和猫健康的重要传染病之一[2-3]。该病的病原是犬细小病毒(Canine parvovirus,CPV),该病毒属于细小病毒科(Pavoviridae),细小病毒属(Pavovirus)。该病毒基因组为单股、负链、线形DNA,全长5 323bp,编码3个结构蛋白VP1、VP2和VP3,其中,VP2基因全长1 755bp,编码584aa[4-5]。作为CPV衣壳的主要亚单位组分,VP2蛋白已被证明有良好的免疫原性,是制备CPV基因工程疫苗的侯选保护性抗原[6]。CPV毒株间的差异主要是由VP2蛋白氨基酸序列中某些位点的改变造成的[7]。在免疫压力和自然因素的综合影响下,该病毒由原始的基因1型进化为基因2型,继而又分化成2a和2b型将其取代,近年来又出现了2c型,每次变异都引起病毒在致病性和宿主嗜性方面的变化[8-9]。2010年,我国检测到CPV-2c型毒株[10],目前我国还是以2a和2b型为主要流行毒株[]。
本实验室从南阳地区分离到一株高致病性的CPV毒株(命名为CPV NY株),通过基因分析,该毒株属于2a型。本试验对CPV NY毒株编码的VP2蛋白进行原核表达,通过各项条件优化得到一株高效表达菌株,表达的重组蛋白具有良好的反应原性,为进一步研究相应的抗体检测试剂盒和基因工程亚单位疫苗奠定了基础。
1 材料与方法
1.1材料
载体pET28a为Novagen公司产品;大肠埃希菌BL21(DE3)感受态细胞购于北京天根生化科技有限公司;IPTG、内切酶(BamHⅠ、HindⅢ)购自TaKaRa公司、质粒提取试剂盒购自Axygen公司;BugBuster购自美国Novagen公司;Anti-His单抗和HRP-Goat amti-Mouse酶标二抗购自武汉三鹰生物技术有限公司;犬五联多抗购自西诺洁普公司;CPV高免血清购自原解放军兽医大学兽药生物制品研究中心;DAB显色试剂盒购自北京中杉金桥公司。
1.2方法
1.2.1VP2基因的扩增及重组原核表达载体的构建 以CPV DNA为模板,以CPV-VP2-ORF-F和CPV-VP2-ORF-R为引物进行PCR扩增,上游引物CPV-VP2-ORF-F的序列为ACTGGATCCATGAGTGATGGAGCAGTTCAAC(下划线序列为BamHⅠ酶切位点)下游引物CPV-VP2-ORF-R的序列为ACTAAGCTTTTAGTATAATTTTCT-AGGTGCTAGTTGA(下划线序列为HindHⅢ酶切位点)PCR反应体系为:模板CPV VP2质粒4μL;CPV-VP2-PRF-F 1μL;CPV-VP2-PRF-R 1μL;5×prime STAR GXL buffer 10μL;dNTP Mixture 4μL;Prime STAR GXLDMA poly merase 1μL;ddH2O 29μL。反应程序为:95℃4min;98 ℃10s,56℃30s,68℃2min,循环35次;最后68℃延伸7min,4℃保存。用胶回收试剂盒(Axygen生物技术有限公司)纯化PCR产物,回收的目的片段载体pET28a连接,转入BL21(DE3)感受态细胞中,用BamHⅠ和HindⅢ双酶切鉴定并测序。
1.2.2细菌培养和VP2基因的诱导表达与鉴定分别吸取pET28a-CPV-VP2和pET28a空载的转化菌液BL21(DE3)5μL于4mL含有Kan+的LB培养基中,于37℃、200r/min振荡培养过夜,次日,按照1∶100的接种比例分别将40μL菌液接种于4mL含有Kan+的LB培养基中放入37℃,200 r/min振荡培养1h~2h,当菌液OD 600nm=0.6 ~0.8时,加入终浓度为1mmol/L的IPTG,37℃、200r/min诱导4h,收集菌体。分别用100μL的BugBuster悬起,离心20min,包涵体用100μL PBS悬起,进行SDS-PAGE电泳。Western blot鉴定:分别是一抗为Anti-His单抗(1∶3 000稀释),二抗为HRP-Goat.anti-Mouse(1∶2 000稀释);一抗为CPV多克隆抗体(1∶200稀释),二抗为HRP-SPA (1∶2 000稀释);一抗为五联多抗CPV(1∶200稀释),二抗为HRP-SPA(1∶2 000稀释)。
1.2.3VP2表达条件的优化 最佳诱导温度试验:细菌培养方法同上,当菌液OD600nm=0.6~0.8时,每管加入终浓度为0.2mmoL/L IPTG,分别置于25℃、28℃、37℃,200r/min诱导4h后,收集菌体,方法同上,进行SDS-PAGE电泳。
最佳诱导剂浓度试验:当菌液OD600nm=0.6 ~0.8时,选择最佳诱导温度,不同IPTG浓度(0.2、0.4、0.6、0.8、1.0mmoL/L),200r/min诱导4h,方法同上进行SDS-PAGE电泳。
最佳诱导时间试验:当菌液OD600nm=0.6~0.8时,选择最佳诱导温度,诱导剂浓度分别诱导不同时间(1、2、4、8h),方法同上进行SDS-PAGE电泳。
2 结果
2.1CPV VP2基因的扩增与pET28a-CPV-VP2重组表达载体的构建
2.1.1CPVVP2基因的扩增 用上游引物CPVVP2-ORF-F和下游引物CPV-VP2-ORF-R以 CPV-VP2基因为模板进行扩增,产物经12g/L琼脂糖凝胶电泳,得到一段1 755bp的核酸片段,与预期结果相符(图1)。
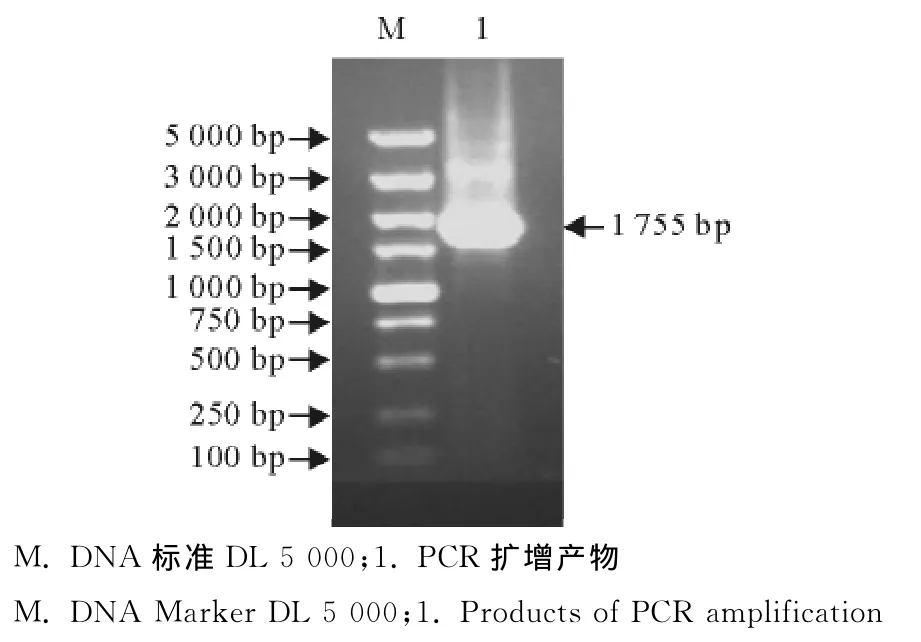
图1 CPV VP2基因的PCR扩增Fig.1 PCR amplification of CPV VP2gene
2.1.2pET28a-CPV-VP2重组表达载体的鉴定重组子pET28a-CPV-VP2经BamHⅠ和HindⅢ双酶切,12g/L琼脂糖凝胶电泳,分别得到片段为1 755bp的目的条带和5 369bp的载体片段,表明目的基因已经成功克隆到pET28a载体中(图2)。
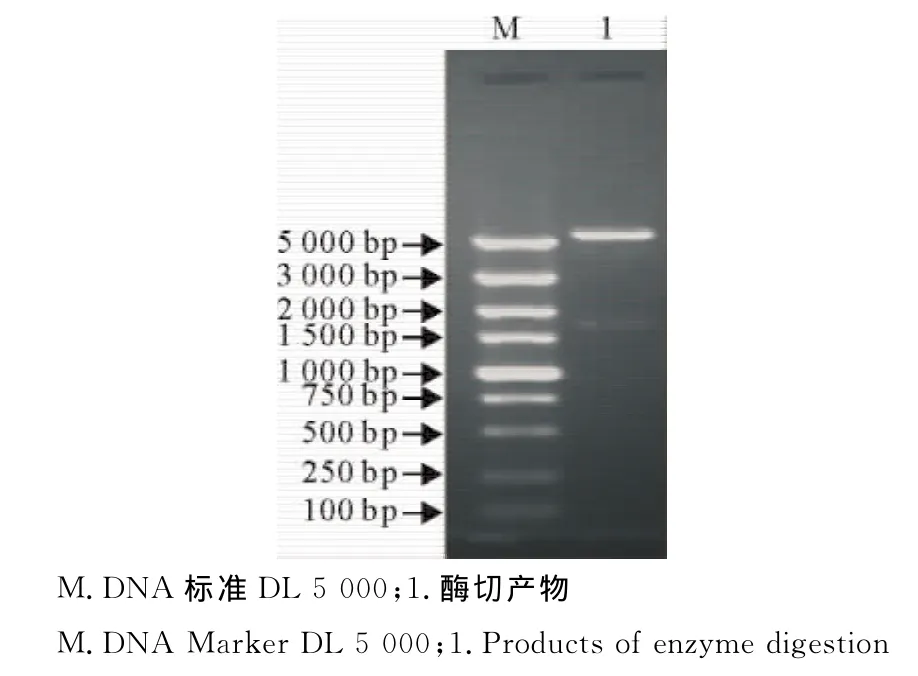
图2 重组表达载体pET28a-CPV-VP2的酶切鉴定Fig.2 Identification of recombinant plasmidpET28a-CPV-VP2by enzyme digestion
2.2CPV VP2蛋白的诱导表达与鉴定
2.2.1CPV VP2的诱导表达 在诱导温度为37℃,IPTG浓度为1.0mmoL/L,诱导4h,目的蛋白在pET28a-CPV-VP2包涵体中表达(图3),上清中不存在目的蛋白,目的蛋白条带约为72ku。
2.2.2重组蛋白rVP2的Western blot鉴定 将与2.2.1中的SDS-PAGED试验中一样的蛋白胶经转膜后采用Anti-His单抗,进行Western blot检测,pET28a-CPV-VP2包涵体中得到一条72ku的目的条带(图4),说明rVP2能与His单抗反应。采用一抗为CPV高免血清抗体(1∶200稀释)或者是采用商品化的犬五联多克隆抗体,二抗为HRP-SPA(1∶2 000稀释),进行检测,结果显示,pET28a-CPV-VP2包涵体蛋白在72ku处有一个目的条带(图5和图6),说明包涵体形式的重组蛋白能与阳性血清反应。
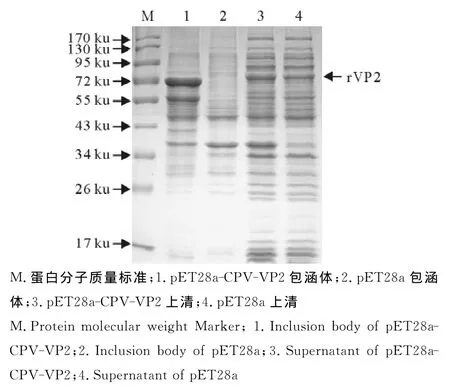
图3 重组蛋白rVP2的SDS-PAGEFig.3 SDS-PAGE of recombinant protein rVP2

图4 重组蛋白rVP2的Western blot鉴定(His单克隆抗体)Fig.4 Identification of recombinant protein rVP2by Western blot(His mAb)
2.3诱导条件的优化
2.3.1最佳诱导温度 IPTG浓度为0.2mmol/ L,诱导温度分别为25℃、28℃、37℃,诱导4h(图7),25℃时的蛋白表达量明显低于28℃和37℃,当诱导温度为28℃和37℃时,蛋白表达量无差别,且只存在于包涵体,在上清中不存在。
2.3.2最佳IPTG诱导浓度 诱导温度为37℃,IPTG浓度分别为0.2、0.4、0.6、0.8、1.0mmoL/L,诱导4 h(图8),结果表明IPTG浓度为0.2mmoL/L时,CPV-VP2蛋白表达量最高,仅在包涵体中表达。
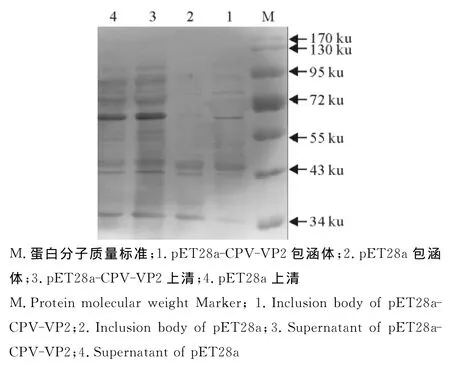
图5 重组蛋白rVP2的Western blot鉴定(CPV多克隆抗体)Fig.5 Identification of recombinant protein rVP2by Western blot(CPV pAb)
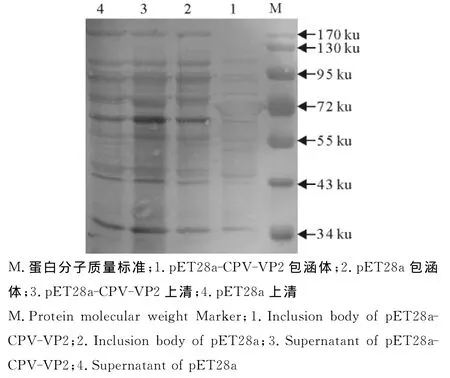
图6 重组蛋白rVP2的Western blot鉴定(犬五联多克隆抗体)Fig.6 Identification of recombinant protein rVP2by Western blot (canine five united pAb)
2.3.3最佳诱导时间 诱导温度为37℃,IPTG浓度为0.2mmoL/L,诱导时间分别为1、2、4、8h,结果显示,通过改变诱导时间发现,在诱导4h和8h时蛋白的表达量最高,且只存在于包涵体中(图9)。
3 讨论
由于CPV VP2基因容易发生变异,目前CPV已经出现了多个基因型,不同基因型的病毒嗜性和致病性均不尽一样。本试验室从南阳地区分离到一株高致病性的CPV毒株(命名为NY株),为了研究该病毒抗体检测试剂盒和基因工程亚单位疫苗,本试验通过扩增CPV NY毒株VP2基因,构建重组表达载体,进行表达条件的优化,并对重组蛋白rVP2的反应原性进行鉴定。结果表明,CPV NY毒株VP2基因全长1 755bp,编码585aa,就VP2核酸序列进化分析显示,该毒株属于CPV2a型(该毒株基因组全长数据待发表)。原核表达时,25℃诱导时的蛋白表达量明显低于28℃和37℃,当诱导温度为28℃和37℃时,蛋白表达量无太大差别,温度的改变并不能改变rVP2的表达形式,即便把温度降低至25℃目的蛋白还是以包涵体形式存在;当IPTG终浓度为0.2mmoL/L时,rVP2表达量最高,增加IPTG浓度无助于rVP2表达量的提高;在诱导4h时rVP2的表达量最高,如果再把诱导时间延长为8h蛋白量无明显增加。Western blot结果表明,rVP2包涵体形式与His-mAb和CPV阳性血清均呈现良好的反应活性。
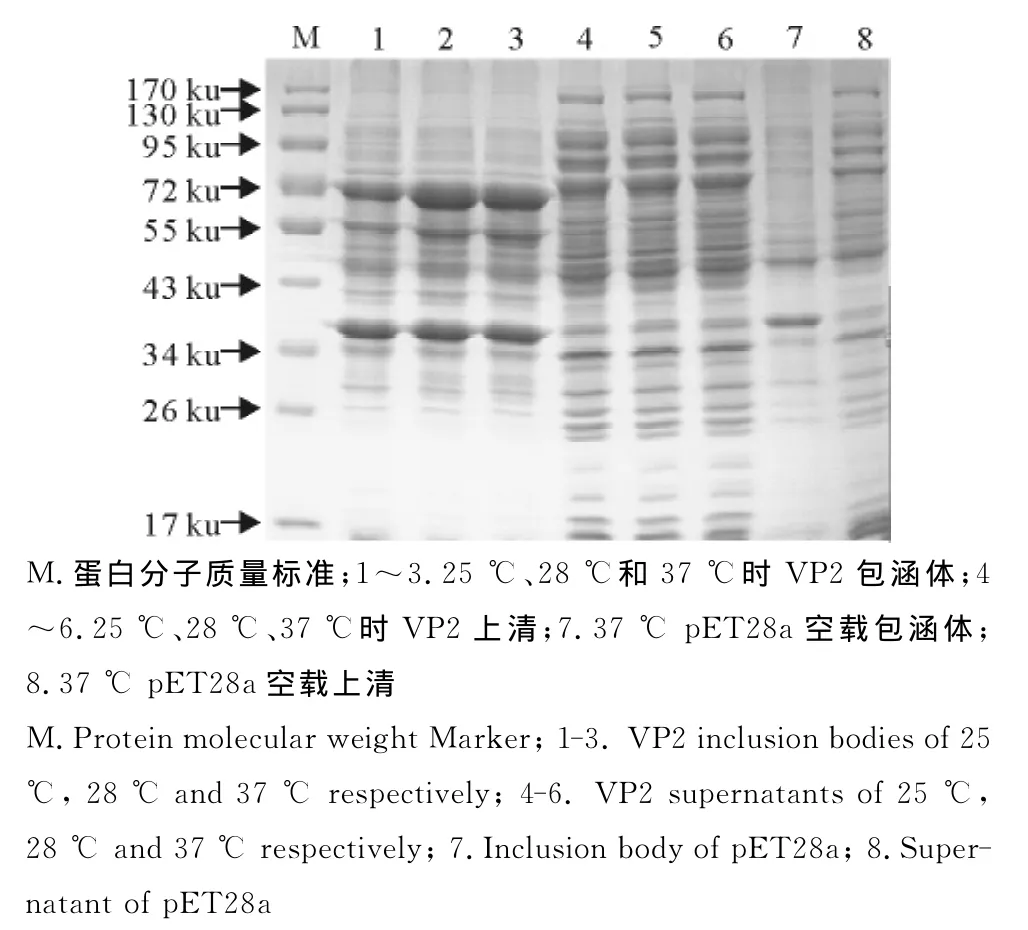
图7 诱导温度对蛋白表达的影响Fig.7 Effects of induction temperature on the expression of protein
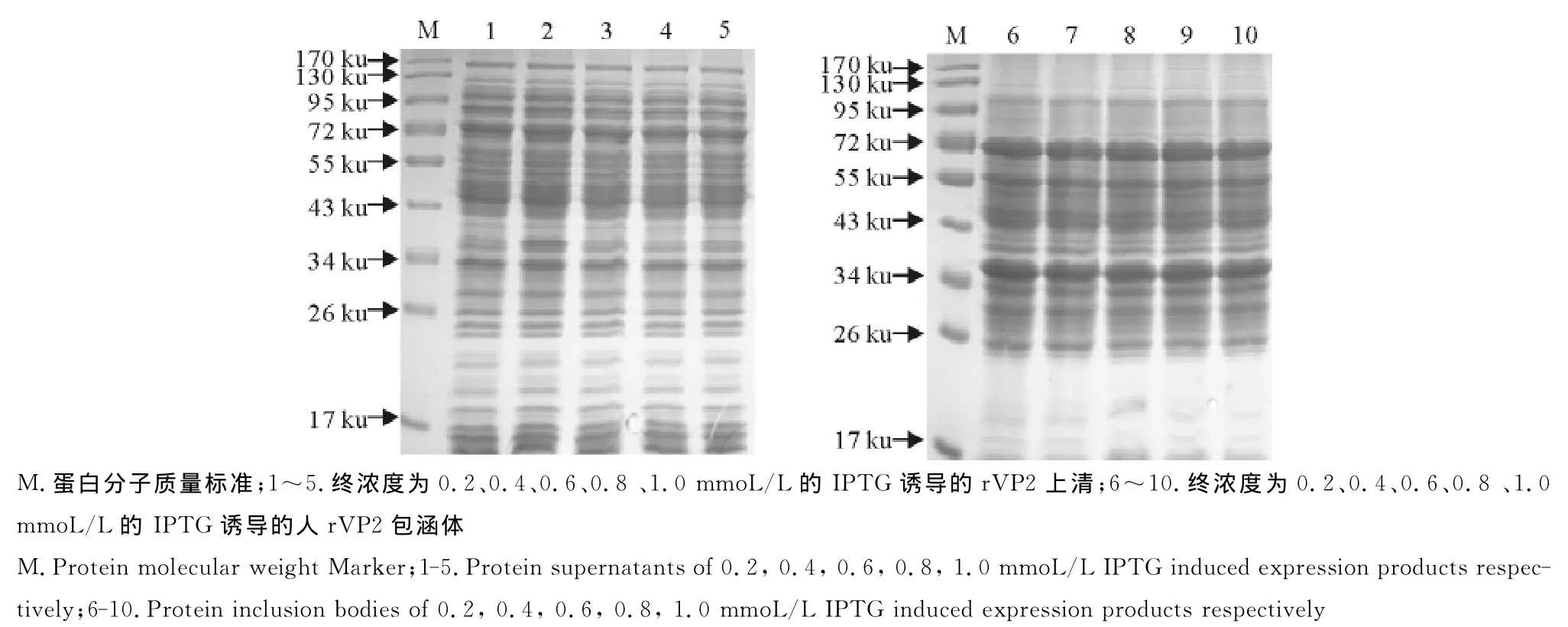
图8 不同IPT G浓度对蛋白表达的影响Fig.8 Effects of different IPTG concentrations on the expression of protein
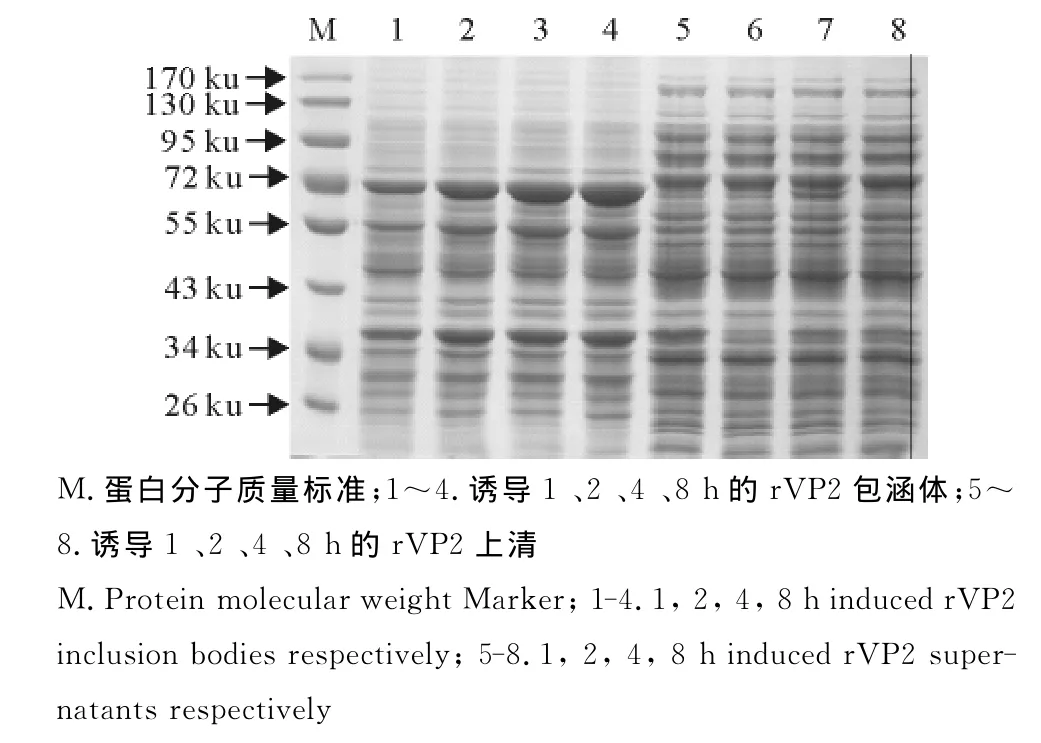
图9 诱导时间对蛋白表达量的影响Fig.9 Effects of induction time on the expression level of protein
原核表达系统中,CPV VP2蛋白的表达以包涵体和可溶性两种形式存在。李慕瑶等[12]将CPV VP2基因全长克隆到pET30a载体中,蛋白以包涵体形式存在;张坤和赵丹等[13-14]用同样的方法得到了以包涵体形式存在的VP2蛋白;陈胜男等[15]对VP2全长进行扩增,用pGEX-4T-2作为表达载体,转入E.coli BL21(DE3)中进行表达,通过Glutathione Sepharose 4B亲和层析柱法纯化目的蛋白,得到可溶性GST-VP2蛋白;王净等[16]对CPV VP2蛋白进行截短表达,得到可溶性融合蛋白GSTVP2;易立等[17]克隆去除5′和3′端的稀有密码子的VP2基因,构建原核表达载体pET28a-VP2和pET32a-VP2,转入E.coli BL21(DE3)中进行表达,但作者没有提及目的蛋白是可溶性还是包涵体形式。本试验克隆了VP2基因全长,构建原核表达载体,分别在VP2蛋白的N端和C端融合His标签,重组蛋白rVP以包涵体形式存在,无可溶性表达。通过对比分析,VP2蛋白是否为可溶性表达与该基因长度、稀有密码子含量、所用的表达载体和表达菌株等因素等有关。
原核表达系统制备的CPV VP2蛋白的两种形式(包涵体和可溶性)具有不同的免疫原性。Zeng[18]等将CPV VP2基因进行密码子优化后,克隆至pMAL-c2x载体中,诱导后得到可溶性目的蛋白,接种家兔后,产生很高的具有病毒中和活性的抗体(免疫后5周,中和效价为350倍),比CPV灭活疫苗免疫组中和抗体效价(同期效价为650倍)要低。李慕瑶等[12]对VP2蛋白的包涵体经过变性、复性处理纯化后能与CPV阳性血清反应;易立等[17]得到可溶性蛋白后用于建立ELISA方法,结果表明其具有很好反应原性。王净等[16]对CPV VP2蛋白进行截短表达(306-397aa和363-483 aa),得到可溶性蛋白与His单克隆抗体和CPV阳性血清反应良好,说明该蛋白具有很好的反应原性;陈胜男等[15]对得到的可溶性VP2蛋白进行Western blot分析发现其具有很好的免疫原性。本试验所得到的rVP2包涵体蛋白与His单抗和CPV阳性血清均反应良好,与文献报道相符。而且,将rVP2包涵体蛋白免疫家兔,能刺激机体产生高滴度的中和抗体(数据待发)。因此,VP2蛋白的可溶性或包涵体形式都具有很好的反应原性,在基因工程亚单位疫苗的开发中具有重要价值。
本试验成功构建了一株高效表达CPV NY毒株VP2基因全长的菌株,重组蛋白rVP2以包涵体形式存在,具有很好的反应原性。rVP2表达量大,纯化方便,为后续基因工程亚单位疫苗和诊断试剂研究奠定了基础。
参考文献:
[1] Perez R,Bianchi P,Calleros L,et al.Recent spreading of a divergent canine parvovirus type 2a(CPV-2a)strain in a CPV-2chomogenous population[J].Vet Microbiol,2012,155(2-4):214-219.
[2] Miranda C,Parrish C R,Thompson G.Canine parvovirus 2c infection in a cat with severe clinical disease[J].J Vet Diagn Invest,2014,26(3):462-464.
[3] 周云朵,康真玉,陈月平,等.犬细小病毒的分离鉴定与生物学特性分析[J].畜牧兽医学报,2011,42(10):1402-1408.
[4] Ju C M,Cheng Y,Ji Y K,et al.Genome sequence of canine parvovirus strain SC02/2011,isolated from a puppy with severe diarrhea in south China[J].J Virol,2012,86(24):13805.
[5] 李世静,嵇辛勤,主 性,等.犬细小病毒VP2基因测序分析[J].动物医学进展,2013,34(6):96-100.
[6] Feng H,Hu G Q,Wang H L,et al.Canine parvovirus VP2 protein expressed in silkworm pupae self-assembles into viruslike particles with high immunogenicity[J].PLoS One,2014,9(1):e79575.
[7] Perez R,Bianchi P,Calleros L,et al.Recent spreading of a divergent canine parvovirus type 2a(CPV-2a)strain in a CPV-2chomogenous population[J].Vet Microbiol,2012,155(2-4):214-219.
[8] Sutton D,Vinberg C,Gustafsson A,et al.Canine parvovirus type 2cidentified from an outbreak of severe gastroenteritis in a litter in Sweden[J].Acta Vet Scand,2013,55:64.
[9] Nicola D,Buonavoglia C.Canine parvovirus—A review of epidemiological and diagnostic aspects,with emphasis on type 2c [J].Vet Microbiol,2012,155(1):1-12.
[10] 张仁舟,杨松涛,冯 昊,等.中国国内首次检测到犬细小病毒CPV-2c[J].中国病原生物学杂志,2010,5(4):246-249+275.
[11] Zhong Z J,Liang L Q,Zhao J,et al.First isolation of new canine parvovirus 2afrom Tibetan mastiff and global analysis of the full-length VP2gene of canine parvoviruses 2in China [J].Int J Mol Sci,2014,15(7):12166-12187.
[12] 李慕瑶,姜 骞,刘家森,等.犬细小病毒VP2基因的原核表达及间接ELISA方法的建立[J].中国兽医学,2007,37 (3):218-222.
[13] 张 坤,马丽娟,李 刚,等.犬细小病毒VP2基因的原核表达及纯化[J].中国动物保健,2009,12:46-51.
[14] 赵 丹,贾 红,侯绍华,等.犬细小病毒VP2抗体竞争ELISA检测方法的初步建立[J].中国畜牧兽医,2012,37 (4):11-15.
[15] 陈胜男.犬细小病毒VP2基因的克隆、表达及其重组蛋白的抗原性研究[D].新疆乌鲁木齐:新疆农业大学,2010.
[16] 王 净,王 鹏,李 刚,等.犬细小病毒VP2截短基因的原核表达及表达蛋白抗原性分析[J].中国兽医学报,2012,32(7):967-970.
[17] 易立,程世鹏,王建科,等.犬细小病毒VP2蛋白的表达及间接ELISA方法的建立[J].中国兽医学报,2010,30(8):1038-1042.
[18] Zeng F Q,Yeung W,Lu Y J,et al.Expression,purification,and characterization of VP2capsid protein of canine parvovirus in E.coli[J].World J Microbiol Biotechnol,2008,24:457-463.
Prokaryotic Expression and Reactogenicity Identification of Canine Parvovirus NY Strain VP2 Protein
MAO Qian-qian,BU Bin,TANG Qing-hai,KAN Yun-chao,YAO Lun-guang,TANG Cun-duo,JIAO Zhu-jin,YANG Jian-wei
(Center for Nanyang Veterinary Biological Engineering Technology,Henan Provincial Engineering Laboratory of Insect Bio-reactor;Henan Provincial Key Laboratory of Insect Biology in Funiu Moutain;Nanyang Normal University,Nanyang,Henan,473061,China)
Abstract:Canine parvovirus(CPV)encoded VP2gene shows frequent genetic variation,which contributes to the tropism and pathogenicity changes of CPV.This study aimed to prepare the recombinant VP2protein(rVP2)encoded by a highly pathogenic CPV strain(NY strain)by prokaryotic expression system.A recombinant plasmid pET28a-CPV-VP2was constructed and transfected into E.coli BL21(DE3),rVP2 was expressed at different temperatures,or with different IPTG concentrations and with different induction time,SDS-PAGE and Western blot were used to analyze expression and antigenicity of rVP2.The results showed that the molecular weight of the rVP2was about 72ku,the protein existed in the form of inclusion body under different conditions.The expression levels showed the highest with 0.2mmoL/L final concentration of IPTG,induced for 4hat 37℃.rVP2can not only react with His-tag monoclonal antibody but also can react with specific positive serum of CPV,rVP2showed good reactogenicity.This study laid the foundation for the development of CPV antibody detection kits and genetic vaccine.
Key words:CPV-NY strain;VP2;prokaryotic expression;identification
作者简介:毛倩倩(1988-),女,河南人,硕士研究生,主要从事生物制药与疫苗工程研究。*通讯作者
基金项目:国家自然科学基金青年基金项目(31101837);河南省重点科技攻关项目(142102110101);南阳师范学院引进人才专项项目(70640);2015年度研究生创新项目(2015CX003)
收稿日期:2014-12-02
中图分类号:S852.655
文献标识码:A
文章编号:1007-5038(2015)06-0024-06

