非洲猪瘟病毒p72蛋白的真核表达及反应原性鉴定
梁云浩,曹琛福,叶奕优,花群义,张彩虹,曾少灵,陶 虹,廖立珊,刘建利,唐 勇,吕建强*(.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳58045;.暨南大学广东省分子免疫与抗体工程重点实验室,广东广州5063)
非洲猪瘟病毒p72蛋白的真核表达及反应原性鉴定
梁云浩1,2,曹琛福1,叶奕优1,花群义1,张彩虹1,曾少灵1,陶虹1,廖立珊1,刘建利1,唐勇2,吕建强1*
(1.深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045;2.暨南大学广东省分子免疫与抗体工程重点实验室,广东广州510632)
摘 要:将p72基因克隆到载体pFast Bac/NT-TOPO上,转化大肠埃希菌DH5α。将获得的重组载体pFastBac/NT-TOPO-p72,转化大肠埃希菌DH10Bac,获得重组杆状病毒质粒bacmid-p72。通过脂质体介导,将bacmid-p72转染sf9细胞,获得重组杆状病毒。用重组杆状病毒感染正常生长的sf9细胞,72h后收集细胞,超声破碎后取上清进行SDS-PAGE和Western blot分析。结果显示,重组蛋白大小约78ku,且重组蛋白可以与非洲猪瘟标准阳性血清反应。说明表达的重组蛋白为可溶性的,并具有良好的反应原性。
关键词:非洲猪瘟病毒;p72蛋白;脂质体介导;重组杆状病毒
非洲猪瘟(African swine fever,ASF)是一种猪的急性传染病,因猪感染非洲猪瘟病毒(African swine fever virus,ASFV)引起。非洲猪瘟的主要临床症状有高热、皮下有红斑、精神萎靡、进食减少,眼角结膜出现炎症,排泄物中有血丝等[1]。健康猪感染强毒株后3d~7d,出现临床症状,4d~10d后感染猪死亡,病死率接近100%。弱毒株感染后,患猪能够依赖自身免疫系统逐渐康复,但将终生携带非洲猪瘟病毒,成为非洲猪瘟的传染源。世界动物卫生组织(OIE)将其列为必须报告的动物传染病[2]。
1921年,在非洲肯尼亚首次发现非洲猪瘟病例,随后疫情在整个撒哈拉以南的非洲地区蔓延。20世纪60年代,非洲猪瘟传入欧洲大陆。西班牙、葡萄牙、法国、比利时、荷兰、意大利及撒丁岛成为非洲猪瘟的重灾区。20世纪70年代,非洲猪瘟传入南美洲的巴西及加勒比海地区,给当地的养殖业造成巨大损失。欧洲各国在花费了大量人力物力后,非洲猪瘟疫情得到了控制。但在意大利撒丁岛疫情时有发生,无法完全扑灭。2008年,非洲猪瘟在俄罗斯高加索地区暴发,并开始向乌克兰和哈萨克斯坦蔓延。我国西部与中亚各国接壤,并且有着极其相似的气候环境,存在非洲猪瘟跨境传播风险[3-5]。
非洲猪瘟病毒(ASFV)为虹彩病毒科非洲猪瘟病毒属的唯一成员[6]。该病毒抗极端环境能力强,在56℃加热70min或60℃下加热20min病毒才能被杀死。在pH4~10的条件下,病毒仍可保持活性。将猪肉自然风干制成的腊肠,或者32℃~49℃下烟熏12h,然后自然风干25d~30d制成火腿,猪肉中携带的非洲猪瘟病毒也无法被全部杀死,仍然具有感染活性。健康个体接触携带病毒的猪肉制品后,极易发生感染,造成疫情暴发[7]。
非洲猪瘟病毒(ASFV)为正20面体,直径约175nm~215nm。由外包膜、病毒衣壳、内包膜、核壳、病毒核酸5个部分组成[8]。病毒核酸为双链DNA,长度为170kb~190kb。病毒基因可编码200多种蛋白质,其中结构蛋白有54种[9]。p72是非洲猪瘟的一种结构蛋白,是病毒衣壳的主要组成部分,也是含量最多的病毒蛋白,占病毒蛋白总量的32%。p72基因序列保守,不同毒株之间都有相同的保守序列。p72蛋白同样也是主要的抗原蛋白,能够诱导免疫系统产生抗体,但抗体不具有中和病毒的能力[10]。
p72蛋白是非洲猪瘟病毒的主要检测抗原之一,大小约75ku。稳定性好,变异小。以p72蛋白为抗原,已经研发出了一系列检测产品[11-12]。我国为非洲猪瘟的非疫区,但随着疫情在中亚的蔓延,非洲猪瘟跨境传播的风险越来越大[13]。对非洲猪瘟检测试剂盒的研制,我国尚处于空白阶段,商业化检测试剂盒技术专利被国外公司长期垄断。本研究利用Bac-to-Bac真核细胞表达系统,成功表达了非洲猪瘟病毒的p72蛋白。经Western blot鉴定,可以和非洲猪瘟标准阳性血清发生反应,具有良好的反应原性,为检测方法的建立和检测试剂盒的研发提供了良好的材料。
1 材料与方法
1.1材料
1.1.1菌株和质粒 pFastBac/NT-TOPO Expression kit,为Invitrogen公司产品。大肠埃希菌(E.coli)DH5α、DH10Bac为试剂盒内自带。质粒pMD18T-p72(含ASFV p72全长基因,大小1941bp)和昆虫细胞sf9均为深圳出入境检验检疫局动植物检验检疫技术中心动物检疫实验室保存。
1.1.2血清和试剂 非洲猪瘟标准阳性血清购自OIE非洲猪瘟参考实验室(Pirbright Laboratary)。高保真PCR扩增酶AccuPrime Pfx DNA Polymerase或Platinum Pfx DNA Polymerase、小质粒提取试剂盒PureLink HiPure Mini Plasmid Purification Kit、大质粒提取试剂盒PureLink HiPure Plasmid DNA Miniprep Kit、Cellfectin○RⅡReagent转染试剂盒、SDS-PAGE预制胶、羊抗猪IgG-HRP、Sf-900ⅡSFM培养基、氨苄青霉素、庆大霉素、四环素、卡那霉素和X-Gal均为Invitrogen公司产品。
1.1.3引物合成 根据GenBank中的p72的序列(GenBank序列号:KJ195685.1)设计出第1组引物P1:5′-ATGGC ATCAG GAGGA GCTTT-3′,P2:5′-TTAGG TACTG TAACG CAGCA CA-3′,用于扩增p72目的基因,扩增产物大小为1 941bp。第2组引物P3:5′-AAATG ATAAC CATCT CGC-3′,P4:5′-GGTAT GGCTG ATTAT GATC-3′,用于鉴定目的基因与载体是否连接,扩增产物大小为2 446bp;交叉引物P1、P4用于鉴定目的基因与载体连接方向是否正确,若正向连接可得到大小为2 141bp的扩增产物,反向连接则无扩增产物。第3组引物:P5:5′-CCCAG TCACG ACGTT GTAAA ACG-3′,P6:5′-AGCGG ATAAC AATTT CACAC AGG-3′,用于鉴定重组杆状病毒质粒,扩增产物大小为4 371bp。
1.2方法
1.2.1真核重组载体的构建 用含有p72基因的质粒pMD18T-p72作为模板,用第一组引物进行扩增。将PCR产物用15g/L琼脂糖凝胶电泳,分析目的条带。在紫外灯下快速切割所需的目的条带,经过胶回收,得到p72基因PCR扩增产物。取4 μL目的基因扩增产物与1μL pFastBac/NT-TOPO载体进行连接,然后转化大肠埃希菌DH5α,涂布含有100μg/mL氨苄青霉素的筛选平板,挑取单克隆菌落,用PureLink HiPure Mini Plasmid Purifica-tion Kit提取质粒。用P1、P2鉴定重组载体上是否连接目的基因,用P3、P4鉴定目的基因是否连接到载体的正确位置,用P1、P2鉴定目的基因与载体的连接方向是否正确。同时经过测序分析后,将得到的重组质粒命名为pFastBac/NT-TOPO-p72。
1.2.2重组杆状病毒质粒的构建 根据表达试剂盒操作说明,将10μL pFastBac/NT-TOPO-p72转化到大肠埃希菌DH10Bac中,接入LB培养基中扩大培养。取出适量LB菌液,涂布含有氨苄青霉素、庆大霉素、四环素、卡那霉素和X-Gal的筛选平板。通过两次筛选,将确定为白斑的菌落用PureLink HiPure Mini Plasmid Purification Kit提取重组杆状病毒质粒。用第3组引物鉴定后,并经过测序分析,将重组杆状病毒质粒命名为bacmid-p72。
1.2.3重组杆状病毒的获得 按照Cellfectin®ⅡReagent转染试剂盒的操作说明,利用脂质体介导将bacmid-72转染在225mL培养瓶中生长的sf9细胞,将细胞置于28℃恒温培养箱中培养大约72 h。同时将用Sf-900ⅡSFM培养基培养的正常sf9细胞作为空白对照。观察到约80%的细胞发生病变后,收集培养上清。将收集的培养上清按1∶10的体积比加入到细胞Sf-900ⅡSFM培养基中,再次培养细胞。约72h后再次收集培养上清,即获得重组杆状病毒AcNPV-p72。
1.2.4重组蛋白的SDS-PAGE分析 重组病毒感染sf9细胞72h后,弃去培养上清,将细胞用20mL无菌PBS缓冲液从培养瓶壁上轻轻吹下来,把细胞悬液收集至50mL无菌离心管中。用同样的方法处理正常生长的sf9细胞,将细胞悬液收集至离心管中。将细胞悬液超声破碎10 min,在4℃下,14 000r/min的离心速度下30min,收集离心后的上清。从离心管中各取10μL上清,与Loading buffer根据比例混合,95℃水浴10min后制备上样样品。各取10μL上样样品,用预制胶进行SDSPAGE电泳,分析重组蛋白的表达情况。
1.2.5重组蛋白的Western blot分析 各取10 μL上清制备成上样样品,经SDS-PAGE电泳后,用Bio-Rad半干转膜仪将胶上的蛋白转至硝酸纤维素膜上。用含50g/L脱脂奶粉的TBST溶液浸没硝酸纤维素膜,37℃下封闭1h。用TBST溶液洗3次,10min/次。将非洲猪瘟标准阳性血清用PBS稀释500倍后,孵育硝酸纤维素膜,37℃下孵育1h。TBST溶液洗3次后,将羊抗猪IgG-HRP用PBS稀释2 500倍,37℃下孵育硝酸纤维素膜1h。TBST溶液洗3次后,避光条件下进行显色,显色3 min后立即用清水稀释显色液,终止显色反应。
2 结果
2.1真核重组载体的构建
以pMD18T-p72为模板,用P1、P2作为引物,进行PCR扩增。经琼脂糖电泳分析后,扩增得到大小1 941bp的扩增片段(图1),即为含有p72全长基因的目的基因片段(图1)。

图1 p72基因的PCR扩增Fig.1 PCR amplication of p72gene
将含有目的基因的凝胶进行回收后,获得目的基因扩增产物。将p72目的基因与载体pFastBac/ NT-TOPO进行连接,然后转化大肠埃希菌DH5α。涂布筛选平板后挑取单克隆菌,扩大培养提取重组质粒,用引物P1、P2进行鉴定,扩增得到大小1 941 bp的片段,表明载体上已连有目的基因;用P3、P4引物扩增,得到大小2 446bp(1 941+505)的片段,表明目的基因已经连到载体的正确位置;用P1、P4引物扩增,得到大小2 140bp(1 941+200)的片段,表明目的基因与载体的连接方向正确(图2)。不同引物对鉴定结果表明,p72目的基因与载体pFast-Bac/NT-TOPO正确连接。经测序分析后,结果与扩增鉴定结果完全一致,将构建的重组载体命名为pFast Bac/NT-TOPO-p72。
2.2重组杆状病毒质粒的构建
将构建好的重组载体转化大肠埃希菌DH10 Bac。通过两次蓝白斑筛选后,将挑取到的白斑单克隆菌落扩大培养,提取重组质粒。用P1、P2引物进行鉴定,得到大小1 941bp的片段,表明重组杆状病毒质粒上连有p72目的基因;用P5、P6引物进行鉴定,得到大小4 371bp(1 941+2 430)大小的片段,表明目的基因已经连接到重组杆状病毒质粒的正确位置(图3)。经测序分析后,与PCR鉴定结果一致,将得到的重组杆状病毒质粒命名为bacmidp72。
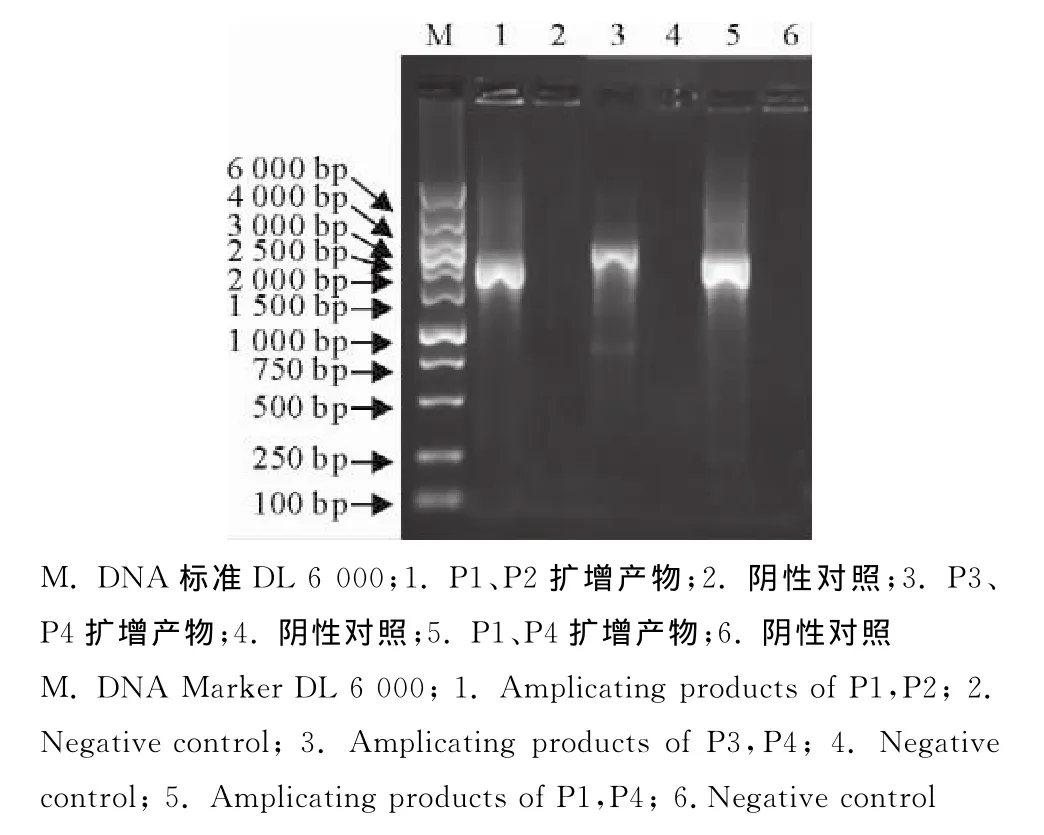
图2 重组载体的鉴定Fig.2 The identification of recombinant vector
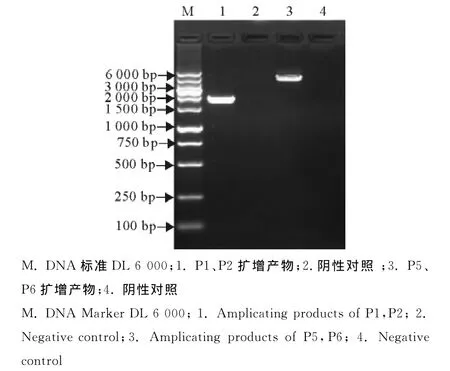
图3 重组杆状病毒质粒的鉴定Fig.3 The identification of recombinant bacmid
2.3重组蛋白的SDS-PAGE分析
将超声破碎后的细胞悬液离心,取离心后的上清制备上样样品。取10μL制备好的上样样品进行SDS-PAGE分析,在78ku处出现特异性条带,作为空白对照的正常sf9细胞则没有此条带,结果表明p72蛋白已经在sf9细胞内表达,且为可溶性表达。
2.4重组蛋白的Western blot分析
将制备好的上样样品进行SDS PAGE分析后,利用半干转膜仪将凝胶上的蛋白转至硝酸纤维素膜上。与非洲猪瘟标准阳性血清进行孵育后,再孵育酶标羊抗猪IgG HRP,加入显色液后进行显色。重组病毒感染后细胞超声破碎上清在80ku附近出现特异性条带(图4)。作为对照的正常细胞超声破碎上清未出现相同大小的条带。Western blot结果表明重组表达的非洲猪瘟病毒蛋白p72可以和非洲猪瘟标准阳性血清中的抗体结合,有很好的反应原性。
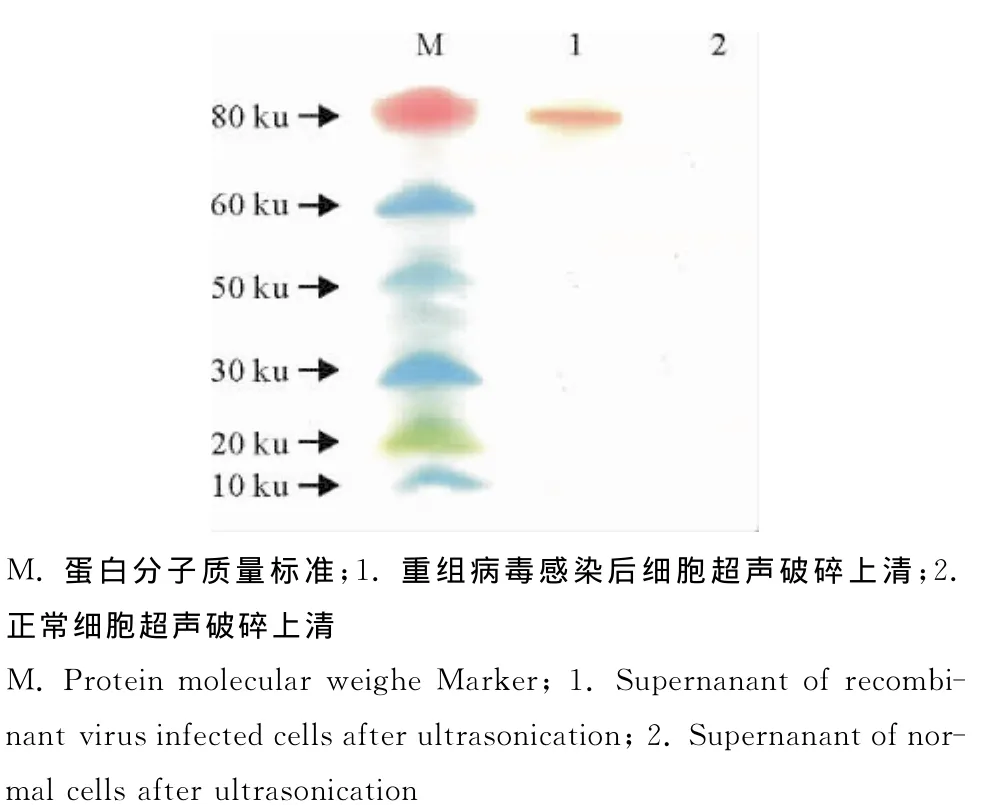
图4 重组蛋白的蛋白印迹鉴定Fig.4 Western blot analysis of recombinant protein
3 讨论
非洲猪瘟作为一种在世界许多国家蔓延的动物疫病,在中国目前没有病例上报。非洲猪瘟暴发速度快,致死率接近100%,尚无有效的预防疫苗和治疗措施,扑杀患病个体是唯一有效控制疫情蔓延的措施。建立快速、灵敏、特异的诊断方法是实施疫情防控措施的重要条件[14]。p72蛋白是非洲猪瘟病毒的重要结构蛋白,在病毒蛋白中含量最高。蛋白序列保守、稳定,极少发生变异,同时是病毒的主要抗原蛋白,可诱导机体产生特异性抗体。p72蛋白常被用作检测抗原,用于建立免疫学检测方法[15-16]。受限于严格的生物安全政策,作为非疫区的国家和地区很难获得非洲猪瘟活病毒。
与原核细胞蛋白表达相比,真核细胞蛋白表达需经过表达后修饰,如:折叠、糖基化、酰基化、磷酸化等。修饰后的蛋白与天然蛋白结构比较接近,最大限度地保留了天然蛋白的抗原表位,有很好的反应原性。其次,原核细胞表达会形成不可溶的包涵体。包涵体蛋白的变性、复性过程操作较为繁琐,且对蛋白的构象有一定的破坏作用。但真核细胞表达蛋白的表达量较低,在纯化过程中存在较大难度。本研究采用Bac-to-Bac真核细胞表达系统,表达出了非洲猪瘟病毒蛋白p72蛋白,且为可溶性表达。经过Western blot分析,重组蛋白可以和非洲猪瘟标准阳性血清发生反应,有很好的反应原性。与分子生物学检测方法比,免疫学检测方法,如间接酶联免疫吸附试验(ELISA)、免疫层析等,操作简便,对试验条件要求较低,可以快速、大规模检测血清样品,能够在基层检疫机构和小型养殖场推广。本研究重组表达的p72蛋白,有很好的反应原性,为免疫学检测方法的建立、单克隆抗体的制备和筛选提供了材料,为免疫检测试剂盒的进一步研发奠定了基础。
参考文献:
[1] 包静月,王志亮.非洲猪瘟流行病学研究进展[J].中国动物检疫.2013(6):72-75.
[2] 曾少灵,廖丽珊,唐金明,等.非洲猪瘟病毒VP73蛋白在昆虫细胞中的表达与间接ELISA方法的建立[J].动物医学进展,2013,34(1):1-6.
[3] Gogin A,Gerasimov A,Malogolovkin D,et al.African swine fever in the North Caucasus region and the Russian Federation in years 2007-2012[J].Virus Res,2013,173:198-203.
[4] Oganesyan A S,Petrova ON,Korennoy F I,et al.African swine fever in the Russian Federation:Spatio-temporal analysis and epidemiological overview[J].Virus Res,2013,173:204-211.
[5] Penrth M L,Lopes C,Banze J,et al.African swine fever in Mzambique:review,risk factors and considerations for control[J].Vet Res,2007,74(2):149-160.
[6] 常 华,花群义,段 纲.非洲猪瘟病毒的分子生物学研究进展[J].微生物学通报,2007(3):275-575.
[7] Costard S,Mur L,Lubroth J,et al.Epidemiology of African swine fever virus[J].Virus Res,2013,173(1):191-197.
[8] Salas M L,Andres G.African swine fever virus morphogenesis[J].Virus Res,2013,173:29-41.
[9] Rodriguez J M,Salas M L.African swine fever virus transcription[J].Virus Res,2013,173:15-28.
[10] Neilan,J G,Zasak L,Lu Z,et al.Neutralizing antibodies to African swine fever virus protein p30,p54and p72are not sufficient for antibody-mediated protection[J].Virology,2004,319:337-342.
[11] Oura C A L,Edwards L,Batten C A.Virological diagnosis of African swine fever:Comparative study of available tests [J].Virus Res,2013,173:150-158.
[12] Aguero M,Fernandez J,Romero L J,et al.A highly sensitive and specific gel-based multiplex RT-PCR assay for the simulanteous and differential diagnosis of African swine and classic swine fever in clinical samples[J].Vet Res,2004,35:551-563.
[13] Jori F,Bastos A D.Role of wild suids in the epidemiology of African swine fever[J].Ecohealth,2009,6(2):296-310.
[14] Otesile E B,Ajuwape A P,Odemuyiwa S O,et al.Field and experimental investigations of an outbreak of African swine fever in Nigeria[J].Rev Elevageet de Mdecine Vtrinaire des Pays Tropicaux,2005,58(1/2):21-26.
[15] King D P,Reid S M,Hutchings G H,et al.Development of a TaqMan PCR assay with internal amplilycation control for the detection of African swine fever virus[J].J Virol Meth,2003,107:53-61.
[16] Aguero M,Fernandez J,Romero L J,et al.A highly sensitive and specific gel-based multiplex RT-PCR assay for the simulanteous and differential diagnosis of African swine and classic swine fever in clinical samples[J].Vet Res,2004,35:551-563.
Eucarytotic Expression and Reactogenicity Identification of African Swine Fever Protein p72
LIANG Yun-hao1,2,CAO Chen-fu1,YE Yi-you1,HUA Qun-yi1,ZHANG Cai-hong1,
ZENG Shao-ling1,TAO Hong1,LIAO Li-shan1,LIU Jian-li1,TANG Yong2,LV Jian-qiang1
(1.Inspection &Quarantine Center for Animals and Plants,Shenzhen Entry-Exit Inspection and Quarantine Bureau,Shenzhen,Guangdong,518045,China;2.Guangdong Key Laboratory of Molecular Immunology and Antibody Engineering,Jinan University,Guangzhou,Guangdong,510632,China)
Abstract:In order to express African swine fever virus protein p72,the p72gene was cloned into pFastBac/ NT-TOPO vector,and then transformed into E.coil DH5αto obtain recombinant vector pFastBac/NTTOPO-p72.Next,the pFastBac/NT-TOPO-p72was transformed into E.coil DH10Bac to get recombinant bacmid-p72.The recombianant baculovirus was generated by lipsome mediation.The sf9cells were infected by recombinant baculovirus,the cells were collected after 72h.The supernant was analyzed by SDS-PAGE and Western-blot after ultrasonic breaking.The result showed that the recombinant protein was about 78ku,and could react with African swine fever standard positive serum.The results above demonstrated that,the expressed recombinant protein was soluble,and has good reactogenicity.
Key words:AFSV;protein p72;lipsome mediation;recombinant baculovirus
作者简介:梁云浩(1987-),男,湖南娄底人,主要从事动物新型疫苗与诊断方法研究。*通讯作者
基金项目:国家高技术研究发展计划项目(2012AA101301);农业公益性行业专项(200903037)
收稿日期:2014-07-30
中图分类号:S852.651
文献标识码:A
文章编号:1007-5038(2015)06-0029-05

