小反刍兽疫病毒与产气荚膜梭菌双重RT-PCR检测方法的建立
唐 娜,孙翠平,王玉茂,刘吉山,张 倩,贾 锐,谢金文,李书光,苗立中,沈志强,*
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600)
2014年春季,羊小反刍兽疫(Peste des petits ruminants,PPR)在我国呈现暴发、流行态势[1],迅速蔓延到全国多个省、市、自治区,引起全国广泛关注。小反刍兽疫俗称羊瘟,是由小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起的一种急性病毒性传染病,主要感染山羊、绵羊等小反刍动物,以发热、口炎、腹泻、肺炎为特征,发病率和病死率均高,与由产气荚膜梭菌(Clostridiumperfringens)引起的羊梭菌性疾病共同成为2014年影响国内养羊业的两大主要传染病[2]。
研究发现,春季接诊病羊临床诊断中,羊小反刍兽疫与产气荚膜梭菌性疾病临床症状相似,都可表现腹泻、死亡,临床剖检可见出血性肠炎,胃黏膜出血坏死、肾脏变软等病变[3-4]。这一方面提示存在小反刍兽疫与产气荚膜梭菌共同感染或继发感染的可能,另一方面也给两种疫病的鉴别诊断提出了更高的要求。鉴于此,本实验室根据2014年流行的小反刍兽疫病毒N蛋白和产气荚膜梭菌α毒素编码的两段基因序列特点,综合应用RNA/DNA提取技术和PCR/RT-PCR技术,建立了鉴别羊小反刍兽疫病毒与产气荚膜梭菌的双重PCR检测方法,为进一步开展羊小反刍兽疫与产气荚膜梭菌病的诊断与防控研究和诊断试剂开发应用提供参考。
1 材料与方法
1.1 材料
1.1.1 毒株和菌株 试验所用的PPRV毒株来自天康畜牧生物技术股份有限公司生产的小反刍兽疫活疫苗,所用产气荚膜梭菌株为购自中国兽医微生物菌种保藏管理中心的CVCC C57-1菌株。肉毒梭菌C 型 (C62-4)、腐败梭菌(C55-2)、大肠埃希菌(C83-1)、绵羊链球菌(C74-10)、羊痘病毒(CV41)均购自中国兽医微生物菌种保藏管理中心,由山东绿都生物科技有限公司保存;羊口疮病毒(SD1201)[5]、牛病毒性腹泻病毒[6]为本实验室分离毒株。
1.1.2 样品 临床样本采自2014年1月~6月期间山东、河南、江苏和河北地区送诊的疑似患羊的肝脏、胃肠组织及血液样品。
1.1.3 主要试剂 AxyPrep DNA/RNA小量提取试剂盒购自爱思进生物技术有限公司;pMD18-T载体、反转录试剂盒、rTaqDNA 聚合酶、DNA 凝胶回收试剂盒、大肠埃希菌DH5α菌株等其他试剂购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计 通过GenBank在线序列比对,应用MegAlign软件分别对多株代表性产气荚膜梭菌株的α毒素基因序列和PPRV代表性毒株的N基因序列进行比对分析,确定其保守区及非保守区序列,采用Prime 5.0软件设计2对特异性引物(表1),由上海捷瑞生物工程有限公司合成。
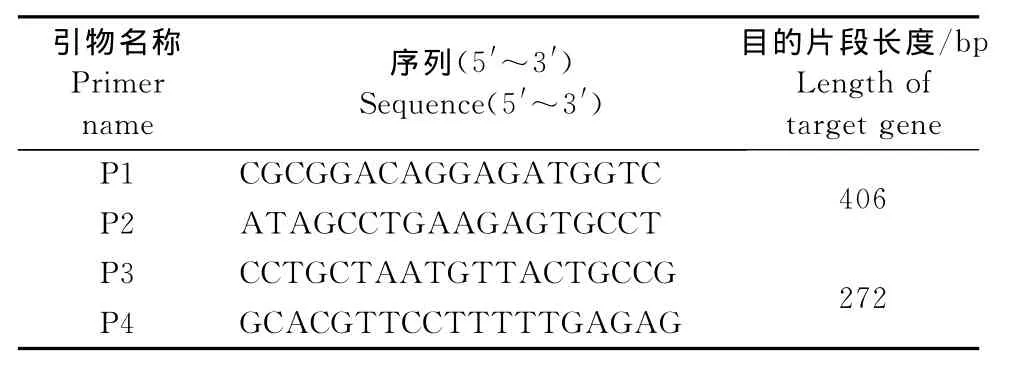
表1 PPRV、产气荚膜梭菌引物序列Table 1 Primer sequences of PPRV and Clostridium perfringens
1.2.2 样品中细菌DNA与病毒RNA的提取 以商品化RNA/DNA提取试剂盒为基础,对样品处理步骤进行了改进,同步提取细菌DNA。
在无菌条件下,将新鲜采集的1g组织样品洗去血污,尽量剪碎,加入少量无菌水,振荡后静置5 min,吸取上层液体,12 000r/min离心3min,弃去上清,沉淀加入50μL溶菌酶(20mg/mL)悬浮混匀,37℃孵育20min。将剩余的剪碎组织碾磨匀浆并冻融3次,12 000r/min离心3min,吸取上清150 μL,与上述加入溶菌酶的悬浮液混合,然后按照试剂盒说明书步骤提取DNA/RNA。
从活疫苗和菌落中提取DNA/RNA,先以相应稀释液或无菌水将样品溶解或悬浮,混合均匀后取150μL样品液加入50μL溶菌酶,37℃孵育20min后,按照试剂盒说明书步骤提取DNA/RNA。
1.2.3 双重RT-PCR检测方法的建立 按照反转录试剂盒说明书步骤,应用引物P2对提取的DNA/RNA进行反转录。设立基本反应条件和反应程序进行PCR 扩增,反应体系:premix rTaq10μL,P1-P4共1.5μL,反转录的 DNA 模板2μL,补足RNase free H2O 6.5μL,反应各组分混匀后,放入PCR仪进行扩增。基本程序为:94℃4min;94℃30s,53℃ 30s,72℃ 35s,共30个循环;72℃ 7 min,4℃2min。PCR产物进行15g/L琼脂糖凝胶电泳。
1.2.4 RT-PCR扩增产物的鉴定 将含PPRV N蛋白基因和α毒素基因序列的凝胶切下,按胶纯化回收试剂盒说明书回收PCR产物,按常规方法与pMD18-T载体连接;将连接产物转化至大肠埃希菌DH5α感受态细胞,利用热激法转化,涂布Amp+LB平板,于37℃培养12h~16h,挑取单个菌落培养过夜,按高纯质粒小量制备试剂盒说明书提取质粒并PCR鉴定,将提取的阳性质粒送上海生工生物工程技术有限公司进行测序,并与GenBank登录的序列比对分析。
1.2.5 双重RT-PCR反应条件优化 以1.2.3的反应体系为基础,对溶菌酶、反转录酶作用时间,以及PCR扩增条件进行优化:比较溶菌酶、反转录酶分别作用5、10、20、40、60min情况下的扩增效果;应用梯度PCR仪优化退火温度;分别梯度稀释引物,优化引物浓度(0.01μmol/L~50μmol/L)。
1.2.6 特异性试验 应用上述方法提取肉毒梭菌C型(C62-4)、腐败梭菌(C55-2)、大肠埃希菌(C83-1)、绵羊链球菌(C74-10)、羊痘病毒(CV41)、羊口疮病毒(SD1201)、牛病毒性腹泻病毒等菌种和毒种的DNA/RNA,并应用优化的RT-PCR扩增体系进行扩增,同时设置阴性对照和阳性对照,琼脂糖凝胶电泳检测条带情况。
1.2.7 灵敏度试验 设置8个检测浓度,进行该方法的灵敏度检测:测定PPRV疫苗液的TCID50浓度,根据浓度分别将疫苗倍比稀释成终浓度为10-5~102TCID50/mL,将产气荚膜梭菌C57-1菌液根据菌落计数情况分别将菌液倍比稀释成终浓度为10-3~104CFU/mL,按照1.2.2、1.2.3、1.2.4方法进行RT-PCR扩增,琼脂糖凝胶电泳检测条带情况。
1.2.8 重复性试验 选择1.2.7中第3、5、7号浓度梯度共3个样品各做3个重复,共9份,按照1.2.2、1.2.3、1.2.4方法进行 PCR扩增,分析该方法的批内差异。相隔1周后,由3人分别按相同方法步骤检测一次,分析该方法的批间差异。
1.2.9 临床样品检测 收集39份临床送诊的疑似患羊肝脏、胃肠组织及血液样品,应用所建立的鉴别RT-PCR方法对样品进行处理和检测。
2 结果
2.1 双重RT-PCR检测方法的建立与扩增产物鉴定
从PPRV阳性肝脏、胃肠组织、产气荚膜梭菌阳性肝脏组织,以及混合样品中,应用所建立的双重RT-PCR分别扩增出与预期大小一致的PPRV N基因部分序列和产气荚膜梭菌α毒素部分基因序列,克隆测序分析证实所扩增序列与网上相应序列分别具有较高同源性。从电泳图上可以明显区分出PPRV和产气荚膜梭菌(图1),扩增出的目的片段大小分别为406bp和272bp左右。根据结果,确立采用溶菌酶处理-试剂盒提取法作为组织样品的RNA/DNA提取方法,以两步法RT-PCR作为基本双重RT-PCR检测方法。
2.2 RT-PCR反应条件优化
通过对溶菌酶作用时间、反转录反应时间、引物浓度等优化试验证明,当引物浓度分别在1μmol/L~50μmol/L时(图2),溶菌酶作用时间为10min~60min(图3),RT-PCR均能扩增出特异性条带。退火温度变化对反应结果影响不明显。最终选择溶菌酶作用20min,引物浓度为1μmol/L~10μmol/L为最佳反应条件。
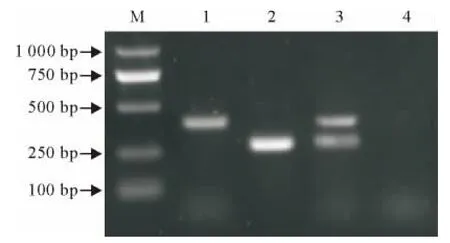
图1 双重RT-PCR扩增结果Fig.1 Duplex RT-PCR results
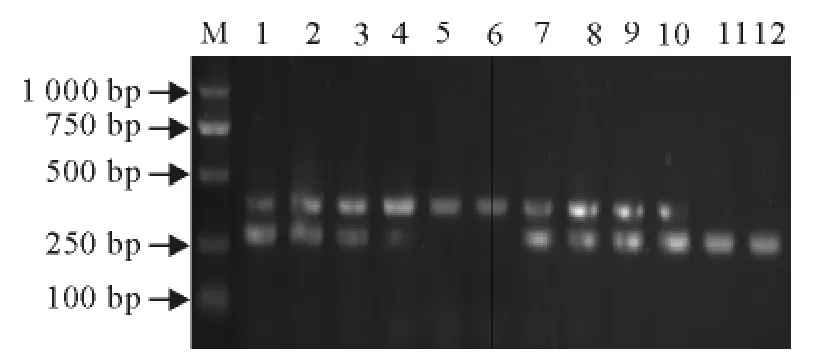
图2 不同引物浓度配比时双重RT-PCR扩增结果Fig.2 Duplex RT-PCR results with different primer concentrations
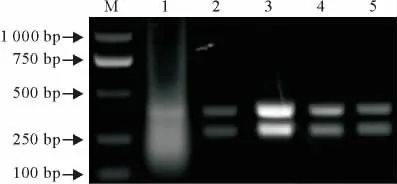
图3 溶菌酶作用不同时间双重RT-PCR扩增结果Fig.3 Duplex RT-PCR results with different lysozyme reaction time
2.3 特异性试验
应用上述实验方法对4种羊病料中常见菌的菌液样品和3种易感染病毒的细胞培养物样品进行扩增,结果均为阴性(图4),表明该方法具有良好的特异性。
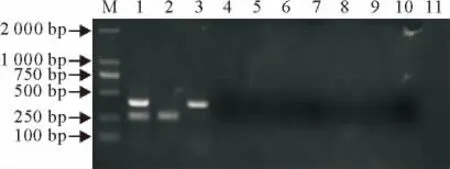
图4 双重RT-PCR特异性检验Fig.4 Specificity test results of duplex RT-PCR
2.4 灵敏度试验
从扩增结果可见(图5),本方法具有较高的灵敏度。当PPRV疫苗株稀释到0.001TCID50/mL时,C57-1菌液稀释到1个CFU/mL时,PCR扩增仍可为阳性。
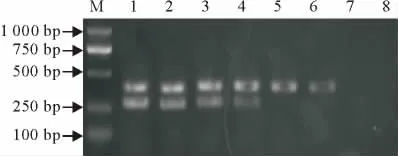
图5 梯度稀释浓度时双重RT-PCR的检测灵敏度Fig.5 Sensitivity test results of duplex RT-PCR with different dilutions
2.5 重复性试验
用建立的RT-PCR分别重复性地检测1.2.7中3个浓度的样品,其批间差异和批内差异分别为4.54%和1.65%,初步分析可能与保存一段时间后病毒和细菌的活力下降、以及半数致病变浓度和菌落计数的测定误差相关。
2.6 临床样品检测结果
用建立的RT-PCR方法检验来自江苏、山东、河南、河北的39份疑似样本,检测出PPRV阳性5份(阳性率12.8%),产气荚膜梭菌阳性11份(阳性率28.2%),其中2份样品PPRV与产气荚膜梭菌均为阳性,提示临床上可能存在一定程度的共同感染。
3 讨论
在动物疾病分子诊断技术的应用过程中,现有的商品化细菌提取方法与病毒提取方法存在较大差别,实际检测时通常需要分开进行。本研究参考国内外多篇报道[7-8],根据组织病料的生物化学特征和梭菌的菌体结构特点,结合商品化RNA/DNA试剂盒现有技术,改进了组织中病毒与细菌RNA/DNA提取方法,初步实现了组织样品中细菌与病毒核酸的同步提取。
羊小反刍兽疫在国内大面积的暴发与流行,促使我们更加关注该病的分子流行病学和遗传变异研究。根据国内外报道,以及基因库登录序列比对分析表明,2014年国内流行毒株具有一定的特点。以N蛋白为例,这些毒株之间的N基因序列具有较高的同源性(99.5%~100%)[9],但与西藏流行毒株同源性相对低一些,与伊拉克等国家流行的毒株同源性相对较高[10]。因此,本研究选择GenBank中与国内流行毒株N蛋白基因同源性较高的参考毒株Sungri/96株为模板,以N蛋白基因序列C末端高保守区域为靶基因[11],设计了一对特异性引物,Blast分析表明,该引物能够有效匹配多个亚群的PPRV N基因,且具有非常好的特异性。RT-PCR试验也发现,应用该对引物能够检测到0.001TCID50/mL的病毒,与国内外报道的检测方法相比,灵敏度较高[12-13]。
目前国内诊断羊细菌病的主要手段仍然以传统的细菌分离、培养、鉴定为主[14],耗时较长,操作复杂,生物安全风险大。在诊断羊感染产气荚膜梭菌引起的羊猝狙、羔羊痢疾、肠毒血症等疫病时,由于该类疫病有发病急、死亡快、治疗困难等特点,采用传统诊断方法更是难以及时有效地做出诊断[15]。近年来,人们陆续开发了多种PCR方法用于鉴定产气荚膜梭菌,并取得了较好的效果[16]。本研究通过前期试验探讨了组织中梭菌DNA的提取技术,并设计了产气荚膜梭菌A、B、C、D、E型通用的α毒素编码基因扩增引物,依托PPRV RT-PCR建立的双重RT-PCR方法既可以直接从患病羊组织体液样品中快速检测产气荚膜梭菌(灵敏度达10CFU/mL),又能够实现PPRV与产气荚膜梭菌的快速鉴别诊断。
通过初步临床应用,从组织样品中检出多例PPRV和产气荚膜梭菌,说明本检测方法对于羊小反刍兽疫和产气荚膜梭菌病的快速鉴别诊断和致病机理研究具有实际应用价值。不过,由于目前关于羊小反刍兽疫与羊产气荚膜梭菌性疾病的致病机理研究尚不透彻,两种病混合感染作用机制、病原的体内分布情况等均不明确,本研究所建立的鉴别检测方法仍然需要在实践中进一步验证与优化。
[1]黄建龙,王昌建,陈桂华,等.湖南省对首例小反刍兽疫的诊断报告[J].中国动物检疫,2014(8):52-54.
[2]刘永宏,曹胜波,赵 丽,等.中国小反刍兽疫疫情分析[J].西北农业学报,2014(9):19-26.
[3]次仁罗布.小反刍兽疫的综合防控措施[J].山东畜牧兽医,2013(5):40.
[4]王六合,徐 敏,李爱巧,等.羊梭菌性疾病的诊治与体会[J].草食家畜,2011(1):87-88.
[5]唐 娜,刘吉山,王玉茂,等.一株羊口疮病毒分离株的生物学特性研究[J].动物医学进展,2014,35(6):49-53.
[6]祖立闯,王金良,李 娇,等.牛病毒性腹泻病毒套式RT-PCR检测方法的建立及初步应用[J].中国兽医学报,2010,30(12):1598-1601,1605.
[7]Mathieson W,Thomas G A.Simultaneously extracting DNA,RNA,and protein using kits:Is sample quantity or quality prejudiced[J].Anal Biochem,2013,433(1):10-18.
[8]Albina E,Kwiatek O,Minet C,et al.Peste des petits ruminants,the next eradicated animal disease[J].Vet Microbiol,2013,165(1-2):38-44.
[9]秦娟娟.DNA/RNA同步提取方法学的建立及其法医学应用研究[D].山西太原:山西医科大学,2013:13.
[10]Muthuchelvan D,De A,Debnath B,et al.Molecular characterization of peste-des-petits ruminants virus(PPRV)isolated from an outbreak in the Indo-Bangladesh border of Tripura state of North-East India[J].Vet Microbiol,2014,174(3-4):591-595.
[11]Kumar K S,Babu A,Sundarapandian G,et al.Molecular characterisation of lineage IV peste des petits ruminants virus using multi gene sequence data[J].Vet Microbiol,2014,7(1-2):39-49.
[12]Mahajan S,Agrawal R,Kumar M,et al.Sandwich ELISA based evaluation of clinical samples for Peste des petits ruminants(PPR)virus detection[J].Small Ruminant Res,2012,106(2-3):206-209.
[13]张喜悦.小反刍兽疫ELISA及PCR诊断方法的建立[D].吉林长春:吉林农业大学,2008:20-29.
[14]胡来根.羊梭菌性疾病的鉴别诊断[J].畜牧与饲料科学,2009,30(5):160-161.
[15]徐 琼,何宇乾,吴海燕.小反刍兽疫研究进展[J].动物医学进展,2012,33(8):93-96.
[16]王光华.产气荚膜梭菌的分子诊断与免疫研究[D].北京:中国农业科学院,2010:15-26.

