山东部分地区H9N2亚型禽流感病毒分离鉴定及HA和NA基因的遗传进化分析
王光锋,李 舫,王洪利
(山东畜牧兽医职业学院,山东潍坊 261061)
禽流感(Avian influenza,AI)是由禽流感病毒(Avian influenza virus,AIV )引起的禽类的一种传染病[1],部分亚型禽流感病毒也可以感染人,自1871年首次在意大利报道以来,世界各地都有特定毒株引起的AI的暴发和流行,给世界养禽业造成了巨大的经济损失。AIV亚型众多,遗传变异极为频繁,抗原性变异主要是指流感病毒表面血凝素(HA)和神经氨酸酶(NA)这两种蛋白的改变,它们的变异决定着病毒的宿主亲嗜性(感染人或禽)、致病性(高致病性或低致病性)、免疫性和暴发流行等[2]。我国自1994年首次报道从鸡群分离到H9N2亚型AIV以来[3],目前绝大部分省市都有H9亚型AIV的流行,并且宿主谱扩散至山鸡、鹌鹑等禽类品种,且检出阳性率不断增高[4]。
近几年来,对我国部分省、市、区活禽市场禽群及发生呼吸道感染的蛋鸡、肉鸡开展H9N2亚型AI的病原学检测,发现H9亚型AIV的阳性率高达60%以上,说明H9亚型AI在我国广泛存在[5-7]。山东是养禽大省,H9亚型AI同样普遍流行[8]。H9亚型AIV感染家禽可导致产蛋下降、免疫抑制,与其他病原共感染或继发感染时导致高病死率,给养禽业造成了巨大的经济损失。同时,H9亚型AIV可以感染人、猪等哺乳动物,在公共卫生上具有重要意义[9]。
AIV基因组为8节段的负链RNA,很容易发生基因突变和重排现象,因此有必要对H9亚型AIV进行流行病学调查和遗传进化分析。本课题组于2013年从山东省潍坊、淄博、青岛、临沂、济南、滨州和烟台等地区疑似禽流感发病鸡群中分离到14株病毒,经鉴定为H9N2亚型AIV,并对其HA、NA基因保守区片段进行了扩增和序列比对分析,以期了解山东地区近年来H9N2亚型AIV的遗传变异情况,为H9亚型禽流感的防控策略提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病料和鸡胚 病料采自2013年山东不同地区疑似禽流感病死鸡的肝、脾、肺和脑等组织。10日龄SPF鸡胚购自山东农科院家禽所。
1.1.2 标准抗原和阳性血清 禽流感H9亚型灭活疫苗(A/chicken/Shandong/6/96株)、禽流感病毒H5、H7、H9亚型阳性血清、新城疫病毒(NDV)阳性血清购自哈尔滨维科生物技术开发公司。
1.1.3 主要试剂 Trizol reagent、DEPC购于Invitrogen公司;RT-PCR试剂盒、凝胶回收试剂盒购自北京天恩泽基因有限公司;无水乙醇、异丙醇、氯仿等均为国产分析纯。
1.1.4 引物设计与合成 根据GenBank上公布的H9N2亚型AIV全基因组序列,应用Primer 5软件分别设计了2对扩增引物,各引物的序列、用途及扩增长度见表1。所用引物由上海生工生物工程技术服务有限公司合成,用灭菌1×TE缓冲液稀释至20μmol/L,分装,置-20℃保存备用。
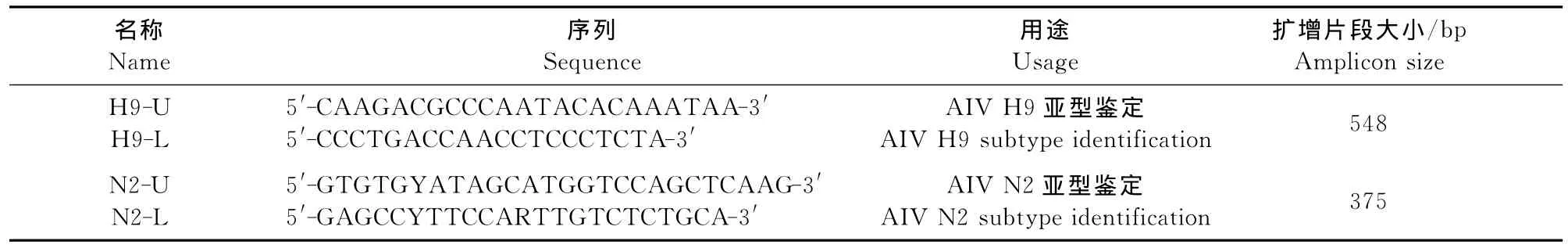
表1 PCR所用引物Table 1 The primers of PCR
1.2 方法
1.2.1 病毒的分离培养
1.2.1.1 病料处理 将采集的疑似禽流感病鸡的肝、脾、肺和脑等组织病料剪碎研磨后,按1∶5比例加入pH7.2的PBS(内含1 000单位/mL青霉素、1 000μg/mL的链霉素),制成匀浆。在-20℃反复冻融3次,8 000r/min离心15min,取上清并以0.22μm的滤膜过滤除菌。
观察比较两种检查方式半月板损伤诊断结果与手术后诊断结果比较。半月板损伤程度分级[2]:0度:半月板正常无损伤;I度:轻度退行性变,出现团片状信号;Ⅱ度:较重度退行性变,出现线状信号,未至关节面;Ⅲ度:半月板撕裂伤,线性信号至关节面。
1.2.1.2 鸡胚接种 将上述滤液经尿囊腔接种10日龄SPF鸡胚,每胚接种0.2mL。弃去24h内死亡鸡胚,记录接种死亡时间,收获24h之后死亡鸡胚的尿囊液。
1.2.1.3 鸡胚的半数致死量(ELD50) 将分离毒株的第二代尿囊液做104、105、106、107、108、109、1010倍稀释,分别接种10日龄SPF鸡胚,0.1mL/枚,每一稀释度接种6枚,记录鸡胚死亡情况,据Karber法计算其ELD50。
1.2.2 血凝与血凝抑制试验 根据 GB/T 18936-2003《高致病性禽流感诊断技术》[10]进行病毒的血凝与血凝抑制试验。根据病毒的血凝效价,配制4个血凝单位的抗原,分别与AIV(H5、H7、H9)及NDV标准阳性血清进行血凝抑制试验。
1.2.3 RT-PCR检测
1.2.3.1 病毒 RNA 的提取 参照 Trizol reagent说明书进行。所用试剂均为RNase-free,器皿均用DEPC水处理并经过高压灭菌。取250μL病毒尿囊液,加入750μL Trizol reagent试剂,混匀后室温孵育5min;加入200μL氯仿,剧烈振摇15s,室温孵育2min~3min,4℃、12 000r/min离心15min,取上清液500μL;加入500μL异丙醇,混匀后室温静置10min,4℃、12 000r/min离心10min,弃上清液;加入1 000μL 750mL/L乙醇(DEPC处理水配制),4℃、12 000r/min离心5min,弃上清;沉淀干燥后悬于适量的DEPC处理水中备用。
1.2.3.2 RT-PCR扩增 RT-PCR反应根据北京天恩泽公司两管式RT-PCR试剂盒说明书进行。
反转录采用20μL体系,在PCR反应管中分别加入3μL已制备的RNA,加入1μL随机引物(0.2 μg/μL),补水到12μL,70℃保温5min变性模板后立即冰浴,按顺序加入4μL RT-buffer(含dNTP)和2μL反转录酶,瞬时离心混匀。反应程序:42℃60min,70℃保温10min以终止反应,然后放置冰上待用。
取5μL~10μL扩增产物通过12g/L琼脂糖凝胶电泳,观察结果。
1.2.3.3 HA、NA基因的遗传进化分析 HA基因、NA基因保守片段PCR产物经核酸电泳鉴定大小正确后,利用凝胶回收试剂盒回收,回收产物送宝生物工程(大连)有限公司测序,测序结果提交到GenBank进行比对,并用DNAstar 5.0与GenBank中下载的H9N2亚型禽流感病毒典型代表株和地方流行株的HA和NA基因序列进行核苷酸序列同源性比较,用 MEGA 4.0软件绘制基因进化树(表2)。
表2 分离毒株和参考毒株信息Table 2 The information about isolates and reference strains
2 结果
2.1 病毒的分离鉴定
鸡胚接种分离到14株病毒(潍坊3株、淄博2株、青岛2株、临沂2株、济南2株、滨州2株、烟台1株),分离株病毒的鸡胚平均死亡时间差异不大,在90.0h~120.5h之间。其中 CK/SD/WF3毒株的鸡胚平均死亡时间最短为90.0h,而其他病毒的鸡胚平均死亡时间都在90h以上,说明它们的致病力较弱。分离毒株对鸡胚的ELD50为10-6.33/0.1mL~10-8.17/0.1mL,其中 CK/SD/WF3毒株的 ELD50为10-8.17/0.1mL,表现出较其他13株病毒强的致病力。血凝试验表明,所有毒株尿囊液均可凝集10mL/L鸡红细胞,其血凝价为26~211。血凝抑制试验结果表明,分离病毒只被禽流感病毒H9亚型阳性血清特异性抑制,血凝抑制效价均为28,不被禽流感病毒H5、H7亚型阳性血清、新城疫病毒阳性血清抑制,初步判定分离毒株是H9亚型禽流感病毒。
2.2 RT-PCR检测
RT-PCR产物在12g/L的琼脂糖凝胶电泳分析表明,HA基因片段长度为548bp(图1A),NA基因片段长度为375bp(图1B),且分离株与阳性对照株 A/chicken/Shandong/6/96 株扩增的产物大小一致,与预期结果相符。
2.3 HA和NA基因测序与分析
设计的HA引物预期能扩增出548bp的碱基,测序结果为548bp;NA引物预期能扩增出375bp,测序结果为375bp。14株病毒HA基因裂解位点氨基酸序列除分离株CK/SD/WF12为-PSRYSRGL-,CK/SD/JN2为-PARSSR-GL-,其余12株病毒裂解位点均为-PSRSSR/GL-,为2个非连续的碱性氨基酸R,符合低致病性AIV毒株HA基因裂解位点的序列特点。
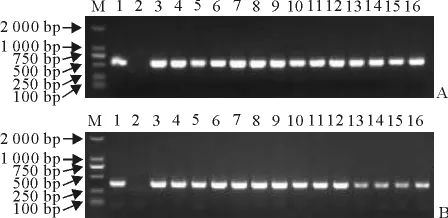
图1 分离毒株RT-PCR鉴定Fig.1 RT-PCR identification of the isolated stiains
将HA和NA基因的序列分别与GenBank中已发表的国内参考毒株HA和NA基因的核苷酸序列进行对比分析。分离到的14株H9N2亚型AIV的HA基因,彼此间核苷酸序列同源性为88.5%~100.0%,推导的氨基酸同源性为87.4%~100.0%;与GenBank已发表的H9N2亚型AIV国内参考毒株的核苷酸序列同源性介于80.5%~99.8%,推导的氨基酸同源性为80.1%~100.0%。14株病毒NA基因彼此间核苷酸序列同源性为93.9%~100%,推导的氨基酸同源性为96.0%~100.0%,亲缘关系密切;与参考毒株的核苷酸序列同源性介于86.6%~100.0%;推导的氨基酸同源性为89.5%~100.0%。
2.4 HA和NA基因的遗传进化分析
应用MEGA4软件分别绘制了14株病毒HA、NA基因的遗传进化树。14株病毒的HA基因属欧亚系CK/BJ/94这一大分支,其中13株病毒与代表株 CK/F/98及 CK/BJ/94有一定遗传距离,与DK/Y280/97同源性最高,核苷酸同源性达90.3%以上,属于Y280分支,而CK/SD/JN2独立于其他13株病毒之外,与代表株CK/F/98遗传距离最近,核苷酸同源性为96.9%,属于F/98分支,说明不同地域间H9N2亚型AIV存在一定差异。NA基因同样均来自CK/BJ/94这一大分支,与DK/Y280/97遗传距离最近,同源性达93.6%以上,属于Y280分支(图2)。
3 讨论
禽流感病毒低致病力毒株HA基因的裂解位点特征为-PARSSR/G-,而高致病性毒株的分子特征为-R-X-R/K-R/G-(X 为非碱性氨基酸)[11]。本研究分离毒株的裂解位点氨基酸序列为P-S-R-S-SR或P-S-R-Y-S-R,从分子水平上证实为低致病力毒株。从核苷酸组成分析,S与R仅有1个碱基的差异,即AGU (AGC)-AGA (AGG),因此,H9亚型AIV在其裂解位点附近的氨基酸有突变成碱性氨基酸即成为高致病力毒株的可能。但不同于参考毒株Y280(P-A-R-S-S-R),分离毒株第2位氨基酸残基由非极性氨基酸(A)突变为极性氨基酸(S),是否会影响病毒的部分生物学特性,需要进一步的试验研究。
目前H9N2亚型AIV的HA和NA基因的进化均分为欧亚和北美2大分支,其中欧亚分支进一步又分为3个亚分支,代表株分别为A/chicken/Beijing/1/1994(CK/BJ/94 亚 系)、A/Quail/Hong Kong/G1/97(QA/G1/97 亚系)和 A/duck/Hong Kong/Y439/1997(DK/Y439/97 亚 系)[12-13],而 内部基因形成更多分支,组成不同的基因型[14]。
从进化树可以看出,本研究分离的14株病毒,除济南分离株CK/SD/JN2外,其余13株病毒的HA和NA基因均属于欧亚分支CK/BJ/94分支中的Y280亚系,与其他报道一致[15-16]。这13株病毒和山东省2006年分离株CK/SD/LY/06、2010年分离株 CK/SD/BD/10、2013年分离株 CK/RZ/853/13亲缘关系较近,而与1996年分离株CK/SD/6/96、2000年分离株 CK/SD/1/00及代表株 CK/BJ/94(北京分离株)、CK/F/98(上海分离株)亲缘关系较远,提示2006年-2013年分离株和1994年-2000年分离株在遗传进化上有了一定差异。但从发育树上可知,所有分离的H9N2亚型AIV都属于BJ/94分支,提示山东省 H9N2亚型AIV HA基因、NA基因可能处在一个比较稳定的遗传演化过程。
将山东分离株与不同地域分离株进行遗传进化分析显示,AIV H9N2亚型山东分离毒株与国内不同地域分离的H9N2亚型毒株遗传进化并没有表现出特殊的地域偏好性,与地理位置相距较远的广东、浙江、上海、湖南等地方分离毒株同源性亦较高。病毒是通过候鸟还是运输发生传播是值得研究的一个方面,明确病毒的传播途径和方式对山东地区禽流感的控制和预防具有重要意义。
20世纪90年代以来,我国大陆各地相继发生了H9N2亚型禽流感疫情,使用疫苗后该病得到了较好的控制,临床上该病毒的分离率明显下降。但近几年来,该病毒在国内养殖场广泛流行。有学者对当前疫苗的免疫效力产生了怀疑,因为现有疫苗株基本上分离自20世纪90年代,随着HA蛋白抗原漂移,现有疫苗株已不能有效保护流行株的感染[17]。从本研究14株病毒的HA基因、NA基因序列的遗传进化分析可以看出,2010年之后分离株的遗传距离较近,而与目前中国广泛使用的H9N2亚型禽流感灭活苗的种毒株 CK/SH/F/98 、Ck/SD/6/96虽同位于BJ/94分支,但具有较远的遗传距离(图2)。因此,疫苗株与流行株之间的抗原差异可能是导致近年来H9亚型禽流感免疫保护效果不好的重要原因之一。这提示制备疫苗时,要采用流行毒株作为种毒才能产生良好的免疫保护。

图2 H9N2亚型禽流感病毒的HA、NA基因的遗传进化树Fig.2 Phylogenetic trees of HA and NA genes of H9N2AIV
HA和NA基因相对频繁的变异,使得低致病力流感病毒基因重组后可能成为毒力较强的毒株,多数H9亚型AIV的受体结合位点226位均为L,具有人受体结合特异性,对公共健康具有潜在的重大威胁[18-19]。所以在今后的工作中,加强对H9N2亚型AI的流行病学监测是非常必要的。
本研究通过对山东省2013年不同地方分离的H9N2亚型AIV的HA和NA基因遗传进化分析,丰富了山东省鸡源禽流感流行病学信息,为了解山东省流行的H9N2亚型AIV的变异情况,指导禽流感疫情防控以及筛选疫苗病毒株提供了依据。
[1]卡尔尼克B W.禽病学[M ].10版.高 福,苏敬良.译.北京:中国农业出版,1999:742-758.
[2]Li C,Yu K,Tian G,et al.Evolution of H9N2influenza viruses from domestic poultry in Mainland China[J].Virology,2005,340(1):70-83.
[3]陈伯伦,张泽纪,陈伟斌.禽流感研究:Ⅰ鸡A型流感病毒分离与血清学初步鉴定[J].中国兽医杂志,1994,22(10):3-5.
[4]孙泉云,陈 琦,夏炉明.H9N2亚型禽流感流行现状[J].动物医学进展,2011,32(10):107-111.
[5]Siddique N,Naeem K,Anmed Z,et al.Evolution of RT-PCR for the detection of influenza virus serotype H9N2among broiler chickens in Pakistan[J].Int J Poul Sci,2008,7(11):1122-1127.
[6]张泉鹏,李作生,鲍晓伟,等.云南省不同宿主H9N2感染调查和NA分子进化分析//中国畜牧兽医学会家畜传染病学分会第十三次学术研讨会论文集[A].广西南宁:中国畜牧兽医学会家畜传染病学分会,2009:973-977.
[7]周锦萍,刘 键,李凯航,等.上海地区活禽批发市场H9亚型禽流感病毒调查[J].中国动物传染病学报,2010,18(3):56-6l.
[8]武利利,刁有祥,鞠小军,等.山东地区16株H9N2亚型禽流感病毒 HA基因的序列分析[J].病毒学报,2012,28(3):272-277.
[9]Lin Z1,Xu C,Liu B,et al.Analysis of the phylogeny of Chinese H9N2avian influenza viruses and their pathogenicity in mice[J].Arch Virol,2014,159(10):2575-2586.
[10]中华人民共和国农业部.高致病性禽流感防治技术规范[S].北京,2007.
[11]Rohm C,Horimoto T,Kawaoka Y,et al.Do hemagglutinin genes of highly pathogenic avian influenza virus constitute uqique phylogenetic lineages[J].J Virol,1995,209(2):664-670.
[12]Zhang P,Tang Y,Liu X,et al.A novel genotype H9N2influenza virus possessing human H5N1internal genomes has been circulating in poultry in eastern China since 1998[J].J Virol,2009,83(17):8428-8438.
[13]Guo Y,Krauss S,Senne D A,et al.Characterization of the pathogenicity of members of the newly established H9N2influenza virus lineages in Asia[J].Virology,2000,267(2):279-288.
[14]Li K S,Xu K M,Peiris J S,et al.Characterization of H9 subtype influenza viruses from the ducks of southern China:a candidate for the next influenza pandemic in humans[J].J Virol,2003,77(12):6988-6994.
[15]李树纯,李心海,仲书官,等.H9N2亚型禽流感病毒基因组的遗传进化分析[J].病毒学报,2012,28(1):7-13.
[16]刘 琳,姜双应,汪立杰,等.青海湖地区5株H9N2亚型禽流感病毒全基因组序列进化分析[J].病毒学报,2014,30(2):109-118.
[17]梁茂银.3株H9亚型禽流感病毒的分离与遗传进化分析[J].畜牧与饲料科学,2011,32(7):122-123.
[18]Chen F,Yan Z Q,Liu J,et al.Phylogenetic analysis of hemagglutinin genes of 40H9N2subtype avian influenza viruses isolated from poultry in China from 2010to 2011[J].Virus Gen,2012,45(1):69-75.
[19]Xue Y,Wang J L,Yan Z Q,et al.Sequence and phylogenetic analysis of surface protein genes of emerging H9N2influenza viruses isolated from poultry in two geographical regions of China[J].Virus Gen,2014,48(3):479-485.

